

(本文节选自张自然博士在2017年5月26日召开的中国化学制药工业协会九次会员大会上的报告。)
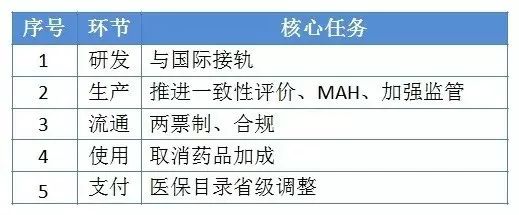
2017年1月24日,国务院办公厅发布的《关于进一步改革完善药品生产流通使用政策的若干意见》(国办发〔2017〕13号),从药品的研发生产、流通和使用的全生命周期提出要求,基本上奠定了接下来整个医药、医疗全行业的发展基调,政策重点以及监管执行方向,可谓是医药领域的纲领性文件。现笔者就逐个环节梳理政策热点,并探讨未来走势。
13号文的核心要点
2017年3月11日,CFDA发布《关于调整进口药品注册管理有关事项的决定(征求意见稿)》,决定了全球新药将同步在中国上市 。
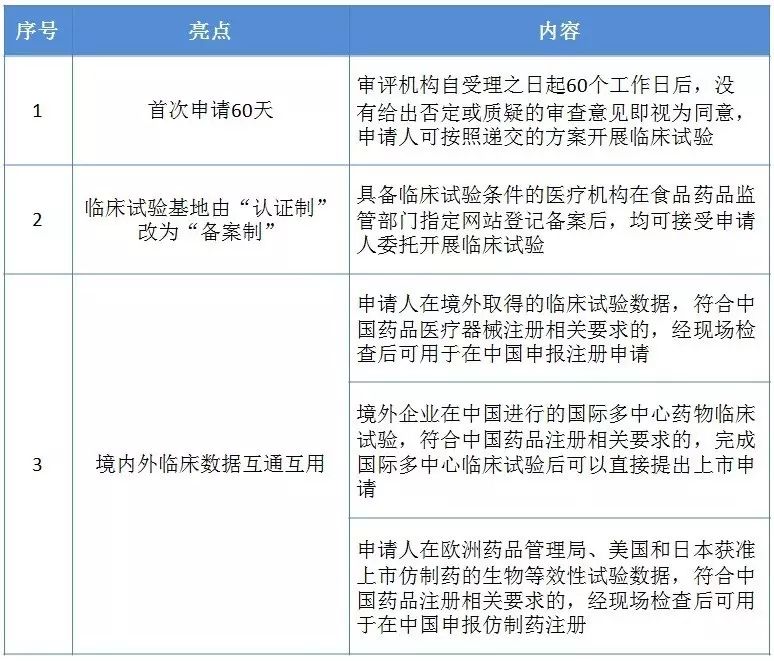
1)在中国进行国际多中心药物临床试验的,取消临床试验用药物应当已在境外注册或者已进入Ⅱ期或者Ⅲ期临床试验的要求,疫苗类药物除外;
2)对于在中国进行的国际多中心药物临床试验,完成国际多中心药物临床试验后,可以直接提出药品上市注册申请;
3)对于申请进口的化学药品新药以及治疗用生物制品创新药,取消应当获得境外制药厂商所在生产国家或者地区的上市许可的要求。
2017年5月11日,CFDA同时发布的52〜55号等4个《征求意见稿》,奠定了中国药品研发与国际接轨的基础。
1)《关于鼓励药品医疗器械创新加快新药医疗器械上市审评审批的相关政策》(2017年第52号)
A、支持罕见病治疗药物和医疗器械研发。罕见病治疗药物和医疗器械申请人可提出减免临床试验申请,加快罕见病用药医疗器械审评审批。
B、鼓励医疗机构优先采购和使用疗效明确、价格合理的新药。支持创新药按规定纳入基本医疗保险支付范围。
2)《关于鼓励药品医疗器械创新改革临床试验管理的相关政策》(2017年第53号)
3)关于鼓励药品医疗器械创新实施药品医疗器械全生命周期管理的相关政策》(2017年第54号)
总结药品上市许可持有人试点经验,结合《中华人民共和国药品管理法》的修订,将上市许可持有人制度在全国的药品和医疗器械许可(注册)人中普遍实行。
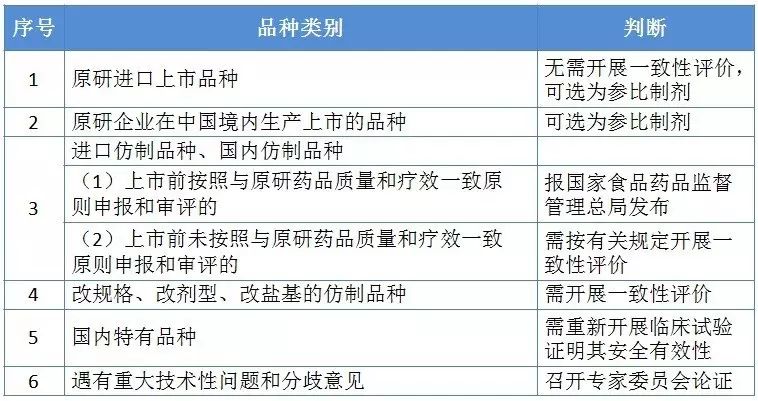
1)2017.03.28,CFDA发布《仿制药质量和疗效一致性评价品种分类指导意见》(2017年第49号)
一致性评价品种分为以下6类:
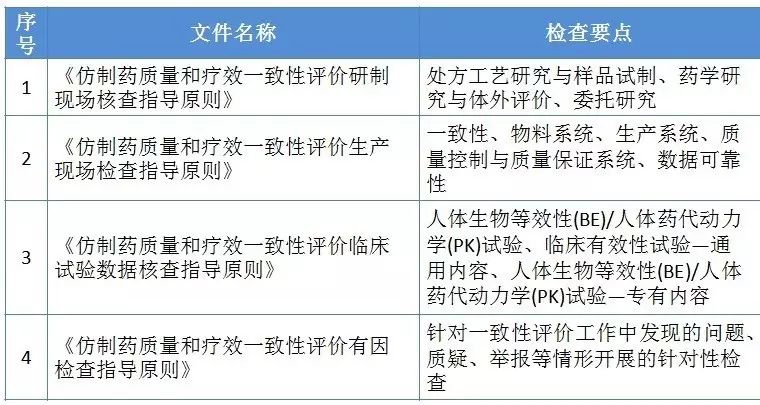
2)2017年5月16日,CFDA发布仿制药质量和疗效一致性评价4个指导原则
核心:真实性、一致性、数据可靠性、研究过程的合规性。
一致性评价4个指导原则检查要点
3)一致性评价工作进展
据食品药品检定研究院仿制药一致性评价办公室萧红街介绍,截至5月18日,在2018年底前必须完成一致性评价的289个品种中,232个品种已经有备案,品种没有备案的主要原因有:
a)是12版基药目录中的老品种,市场上销售并不多,企业对销量小的品种开发积极性低;
b)原研药找不到;
c)是国内特殊品种。
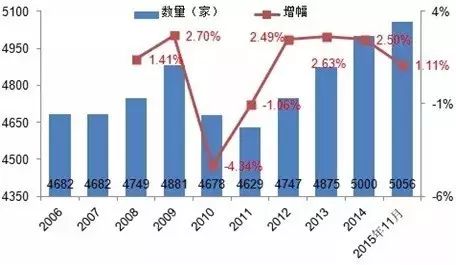
2015年8月以来,制药行业迎来了4个最严的监管,2015年、2016年、2017年1~3月分别收回GMP证书147张、170张和47张,加之新药研发的省级(全球新)、一致性评价的推进和资本的助推,也使得实力欠佳的中小企业被并购,使得全国原料药和制剂生产企业的数量由2015年的5056家下降到2016年11月底的4176家(数据源自《2016年度食品药品监管统计年报》)。
制药企业数量
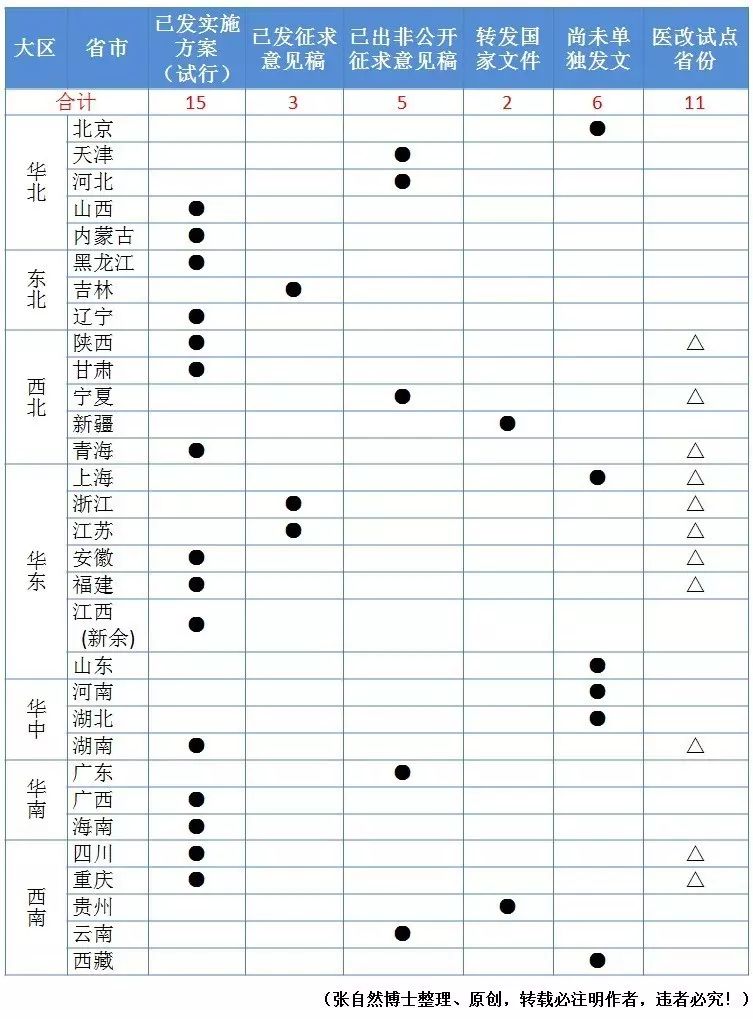
国家卫计委要求试点省份和地区要在6月底前出两票制方案,到2018年,全国实施两票制。
截至2017年5月24日,除15个省发布了实施方案(试行)、3个省发布了征求意见稿、5个省拟定了征求意见稿(尚未发布)、2个省转发了国家文件外,还有6个省尚未单独发文,详见下表。
1)“两票制”背后的流通整治正在加大力度
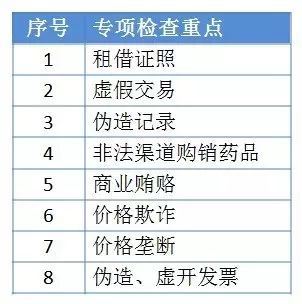
2)2017年5月11日,CFDA发布《关于鼓励药品医疗器械创新实施药品医疗器械全生命周期管理的相关政策》(征求意见稿)。开始了大规模的大型中西医结合医院巡查打击医药购销领域商业贿赂的行动。巡查周期:到2017年年底结束。
3)2017年5月12日,国家中医药局发布《大型中西医结合医院、民族医医院巡查细则(2017年版)》
对医药代表的三个禁止:
1)禁止医药代表承担药品销售任务;
2)禁止医药代表私下与医生接触;
3)禁止医疗机构任何人向医药代表、药品生产经营等企业人员提供医生个人开具的药品处方数量。
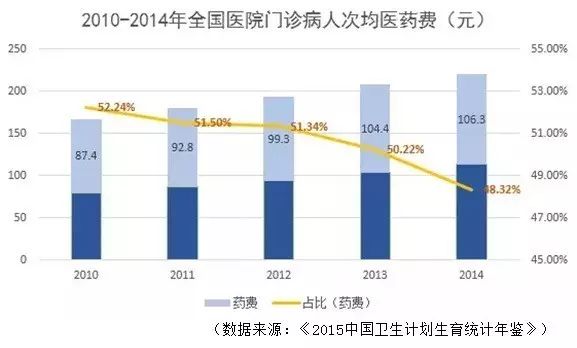
2014年4月19日,卫计委等7部委发布《关于全面推开公立医院综合改革工作的通知》(国卫体改发〔2017〕22号)
要求“9月30日前,所有公立医院全部取消药品加成(中药饮片除外)。到2017年底,前4批试点城市公立医院药占比(不含中药饮片)总体下降到30%左右”。
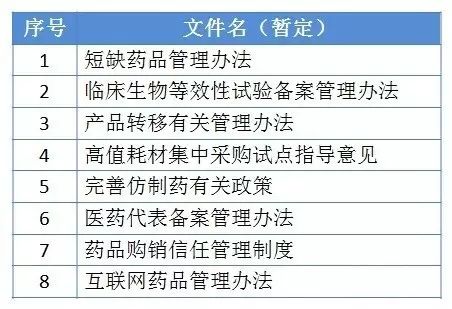
5月17日在上海召开的全国药交会上,国务院医改办督导处朱处长透露,6月底前,还将发布以下文件:
在2017年5月11日国家卫计委召开的发布会上,国家卫生计生委体改司梁万年司长表示,2017年在药品供应保障方面还有如下重点工作:

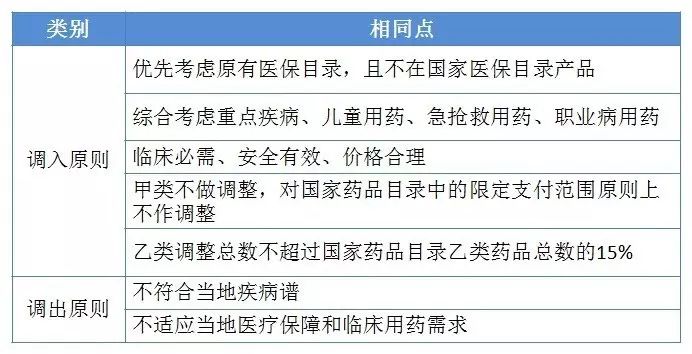
2017年3月18日,人社部陈金甫司长在重庆召开的内部会议上,明确要求各省2017年7月31日前必须完成医保目录增补工作,同时就调整名额做了要求,各省医保目录的调整数量控制在291个,增补仅限于乙类,且不得超过国家乙类数量的15%。
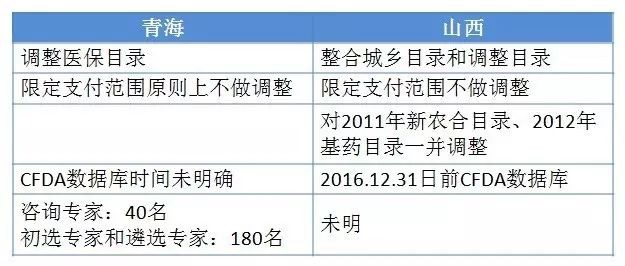
2017年5月8日和5月23日,青海和山西分别第一个发布了医保目录调整征求意见稿和正式医保调整方案。
青海、山西两省医保目录调整不同点
青海、山西两省医保目录调整相同点
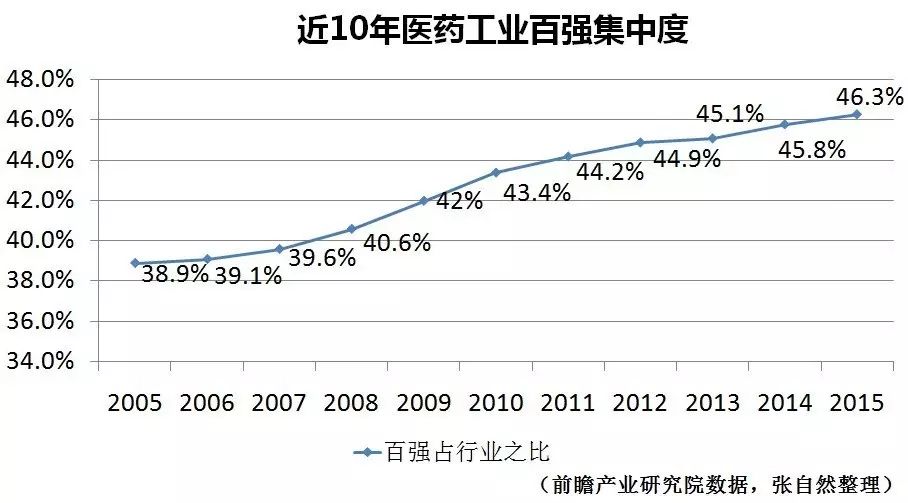
医药行业的大力整顿,加速了行业集中度的提升,为提高药品疗效、质量和溯源奠定了管理基础。
10年来,医药工业的百强集中度提升了7.4个百分点,已由2005年的38.9%提升到2015年的46.3%,但距离欧美等前3家药企即占到行业绝大部分的距离还很远。
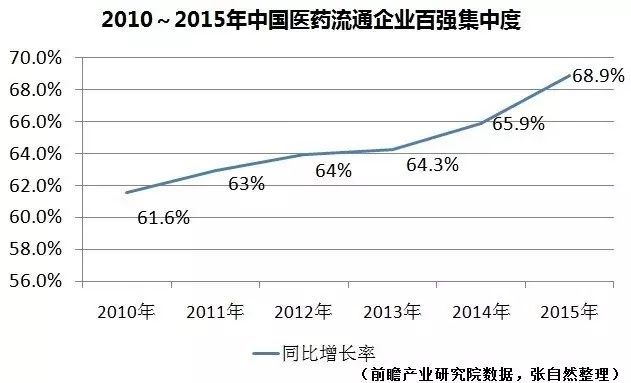
医药商业的集中度提升速度更快,由2010年的61.6%提升到2015年的68.9%,5年提升了7.3个百分点,但距离美国前3家药企即占到行业90%的距离更远。
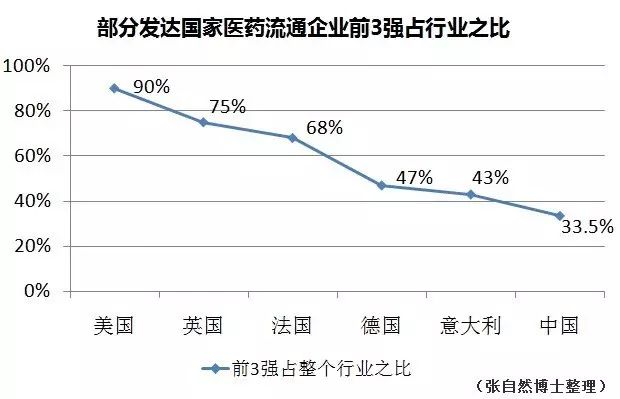
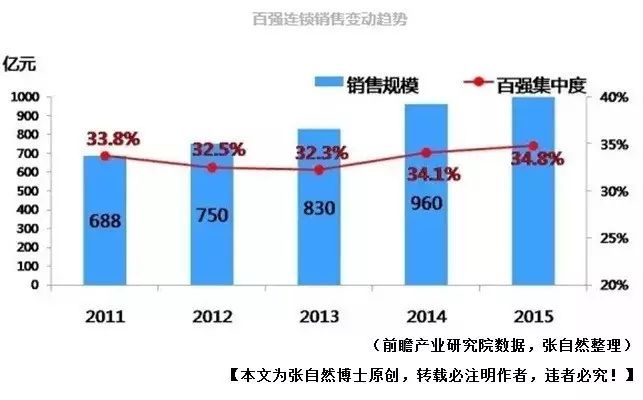
医药连锁的的集中度由2011年的33.8%提升到2015年的34.8%,可谓进展缓慢,而美国前3家连锁的营销即占了整个行业的76%(2015年,IMS数据)。
(本文作者系中国化药制药工业协会特邀副会长,兼政策法规专委会主任)
■编辑 余如瑾
★更多深度报道见《医药经济报》~ 















