二、实验结果
1,RNA:m5C、RCMTs和hnRNPK在ARLCs中水平增加

图1. RNA:m5C、RCMTs和hnRNPK在ARLCs和ASLCs中表达及hnRNPK结合效率
如图1a,与ASLCs细胞系OCI-M2和SC相比,M2AR和SCAR细胞系中NSUN1/2/3、DNMT2和hnRNPK显著增加(~3倍),有意思的是,他们的增加促进了RNA:m5C形成但不影响DNA:m5C水平(图1b和1c)。纯化重组的hnRNPK蛋白,FAM分别标记poly(C)RNA和poly(m
5
C)RNA,体外结合实验发现,hnRNPK更易结合发生m5C修饰的RNA(如图1d和1e)。这些结果提示
RNA:m5C、RCMTs和hnRNPK可能参与白血病细胞中对5-AZA的响应/抗性。
2,白血病细胞中不同功能RCMT复合体
如图2a,在OCI-M2细胞中,使用不同浓度RNase消化后进行免疫共沉淀,hnRNPK直接与DNMT2和NUSN3相互作用而不依赖与RNA。为进一步研究hnRNPK和RCMTs的功能,研究者进行了一系列RNAi干扰实验,在SC细胞中分别敲减hnRNPK、DNMT2、NSUN1/2/3,Western blot检测发现,敲减hnRNPK、DNMT2和NSUN3后,不仅降低靶蛋白表达而且显著减少三个蛋白中其他蛋白(如图2b),
这暗示hnRNPK、DNMT2和NSUN3很可能形成功能复合体
;此外,敲减hnRNPK轻微降低SPI1/PU.1表达,但不影响总的RNA聚合酶II表达;敲减NSUN1和NSUN2后,抑制两者中其他蛋白表达,但并不影响hnRNPK、DNMT2和NSUN3表达(如图2c)。MTT实验发现,分别敲减hnRNPK、DNMT2、NSUN1/2/3都能显著抑制SC细胞生长(如图2d),这提示上述蛋白是白血病细胞生长所必须的。由此推断,
在白血病细胞中,hnRNPK与不同的RCMTs形成不同的功能复合体对于其稳定性和细胞生存至关重要。
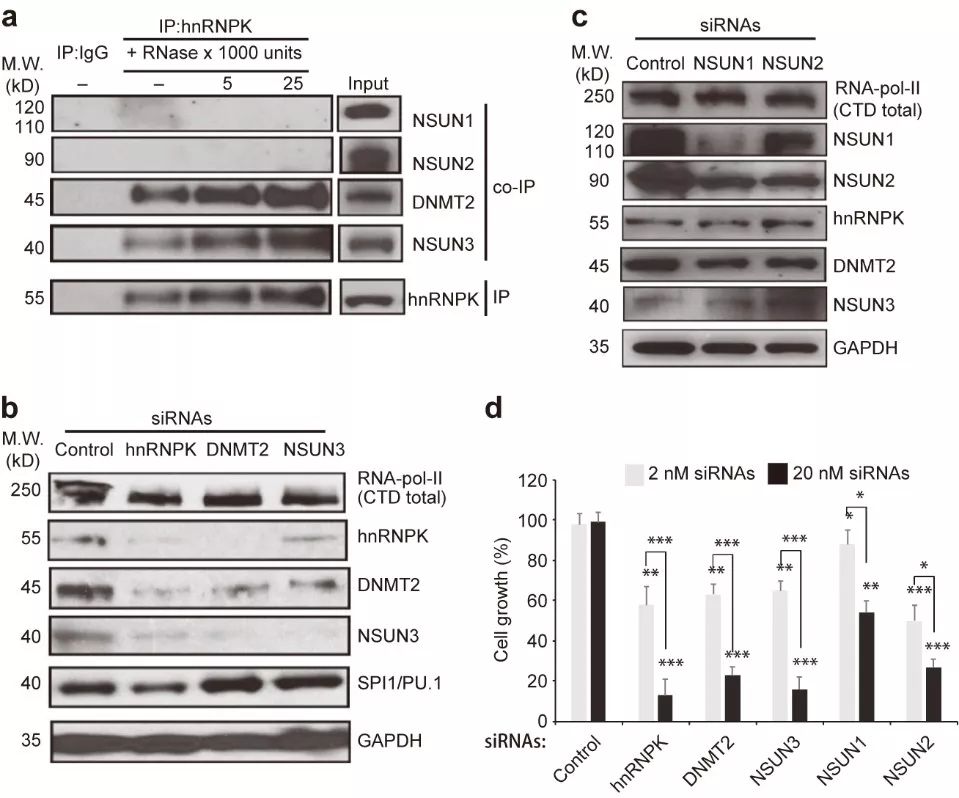
图2. 白血病细胞生存所需的不同功能的hnRNPK/RCMT复合体
3, 5-AZA诱导细胞系相关的染色体改变
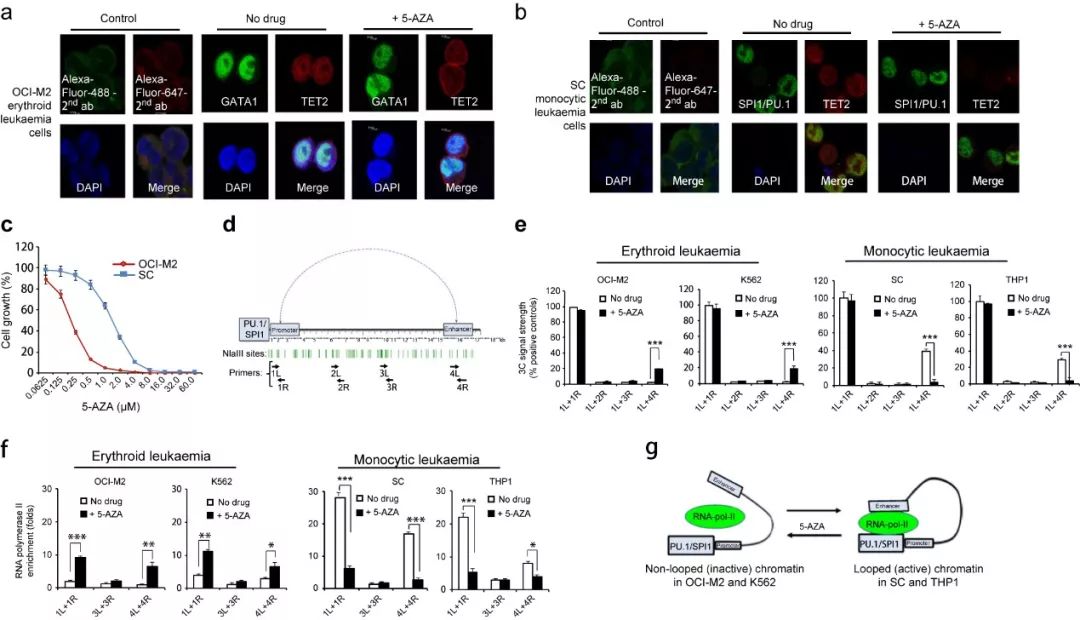
图3 白血病细胞中细胞系相关的药物响应染色体结构改变
为研究5-AZA对染色体结构的影响,研究者分析了细胞系特定转录因子(transcription factors,TFs),GATA1和SPI1/PUC.1以及TET2在细胞中的亚细胞定位及共定位,在OCI-M2中,GATA1和TET2共定位形成点样染色体结构,5-AZA处理后破坏这种结构(如图3a);在SC细胞系中,具有相似的模式,即SPI1/PUC.1和TET2共定位形成点样染色体结构,5-AZA处理后破坏改结构(如图3b)。如图3c所示,与SC细胞系相比,OCI-M2对AZA处理更加敏感,在1μM AZA处理后基本不生长。染色体构象俘获技术发现在OCI-M2和K562细胞系中,SPI1/PUC.1基因中1L和4R配对引物检测几乎没有PCR信号,但5-AZA处理后有高水平的PCR信号(图3e左),暗示
5-AZA处理导致增强子与启动子的相互作用
;相反,在SC和THP1细胞系中,SPI1/PUC.1基因中1L和4R配对引物检测有高水平的PCR信号,而5-AZA处理后显著降低PCR信号(图3e右),这表明不同类型的白血病对5-AZA的响应是不同的。进一步的ChIP实验证明,AZA处理后,OCI-M2和K562细胞中SPI1/PUC.1启动子和增强子处RNA聚合酶II显著增加,而SC和THP1细胞中是相反的(如图3f)。这些结果提示,在OCI-M2和K562细胞中,AZA处理形成非环装结构的失活的染色质结构,减少RNA聚合酶II在启动子的富集,而在SC和THP1细胞中,AZA处理形成环的激活的染色质结构,促进增强子和启动子的相互作用,增加RNA聚合酶II在启动子的聚集,促进基因转录(图3g),这暗示在
白血病细胞中,5-AZA可诱导细胞系相关的特定基因染色体结构改变。
4,RNA/hnRNPK介导TF-染色体修饰蛋白相互作用
为阐明细胞系相关的5-AZA响应的染色体结构变化,研究者通过Western blot、IP和Co-IP检测细胞系特定转录因子GATA1和SPI1/PUC.1以及不同染色体修饰蛋白TET1/2/3、DNMT1、DNM73A/3B和EZH1/2的表达和相互作用。
在OCI-M2和SC细胞中,TET1/2/3、DNMT1、DNM73A/3B和EZH1/2表达水平差不多(图4a,input),GATA1在OCI-M2中高表达,在SC中几乎不表达,而SPI1/PUC.1在OCI-M2低表达,在SC中高表达。如图4a,在OCI-M2中,GATA1与TET2和DNMT3A/B相互作用,SPI1/PUC.1与DNMT1和EZH2相互作用;在SC中,SPI1/PUC.1选择性结合TET2,与DNMT3A/B并不相互作用。如图4b和4c,在OCI-M2细胞中,加入5-AZA 30分钟后, SPI1/PUC.1与DNMT1的相互作用迅速减弱;在SC细胞中,加入5-AZA 10分钟后,SPI1/PUC.1与TET2的相互作用基本没有了,这意味着5-AZA能迅速破坏TFs与染色体修饰蛋白的相互作用。如图4d,在OCI-M2细胞中,RNase破坏GATA1-TET2和SPI1/PUC.1-DNMT1之间的相互作用,但不影响SPI1/PUC.1-EZH2之间的相互作用;如图4e,在SC细胞中,SPI1/PUC.1-TET2相互作用对RNase消化很敏感,这些结果提示,
RNA介导TET2与GATA1或者SPI1/PUC.1的相互作用。
然而,在生理情况下,并不能有效检测TET2或GATA1和SPI1/PUC.1结合的RNA。因此,研究者筛选商业化hnRNP家族蛋白抗体作为诱饵确定相互作用的RNPs。如图4f,在OCI-M2细胞中,只有hnRNPK与GATA1和TET2相互作用。这些结果提示,在白血病细胞中,RNA/hnRNPK介导细胞系特定TFs和染色体修饰蛋白间5-AZA 敏感性相互作用(如图4g)。
5, hnRNPK结合CDK9形成5-AZA敏感型激活染色质
CDK7/TFIIH和CDK9/P-TEFb能分别磷酸化RNA聚合酶的C端结构域(C-terminal domain,CTD)第5位和第2位的丝氨酸,即CTD-S5P、CTD-S2P,分别促进转录起始和延伸
10,11
。Western blot显示在OCI-M2细胞中,在5-AZA处理1.5h后, CTD-S2P显著减少,而总的RNA聚合酶、RCMTs、hnRNPK 、CDK9/P-TEFb和CDK7基本不变化(如图5a)。Rnase消化偶联IP和co-IP揭示在OCI-M2细胞中,hnRNPK和CDK9/P-TEFb间存在直接相互作用,而与CTD-S2P和CDK7//TFIIH间存在间接相互作用(如图5b)。结合最近研发的5-EU核酸标记技术和激光共聚焦荧光显微镜,研究者在体证明hnRNPK和激活的RNA聚合酶(CTD-S2P)共定位在新生的RNA,而且与5-AZA敏感性OCI-M2细胞和相比,5-AZA抗性M2AR细胞中这种共定位显著增加(如图5c)。

图4. RNA/hnRNPK介导不同细胞系特异TFs和染色体修饰蛋白的相互作用
此外,在OCI-M2细胞中,5-AZA迅速破坏hnRNPK与CTD-S2P/CDK9/7的相互作用(如图5d),但是5-AZA并不影响hnRNPK与DNMT2和NSUN3的相互作用(如图5e)。基于上述结果,研究者提出了一个模型(如图5f):在白血病细胞中, 在新生RNA附近,hnRNPK/RCMT介导5-AZA敏感的染色体结构激活。
6, 在ARLCs中NSUN1/BRD4直接结合RNA聚合酶II CTD-S2P
为探索RNA聚合酶II和RCMT复合体在5-AZA抗性细胞中的作用,研究者比较了上述蛋白在ASLCs和ARLCs中表达情况。Western blot显示,
与5-AZA敏感细胞系OCI-M2和SC
相比,总的RNA聚合酶II、CTD-S2P、CDK7、CDK9/P-TEFb、BRD4和BRD2
在5-AZA抗性细胞系M2AR和SCAR
中轻微增加(如图6a)。与预期结果一致,与ASLCs相比,hnRNPK相关的CTD-S2P在M2AR细胞中显著增加(如图6b)。意外的是,hnRNPK与CTD-S2P和GATA1增加的相互作用对5-AZA更加敏感,在5-AZA处理20分钟后,它们之间的相互作用就被破坏了(如图6b),这暗示
对于5-AZA抗性,存在一个非hnRNPK依赖性机制。
这便引导研究者在ARLCs中寻找介导RNMTs和CTD-S2P相互作用的因子。如图6c,CTD-S2P-NSUN1相互作用仅存在于M2AR细胞,且对5-AZA不敏感,相反,CTD-S2P与DNMT2和NSUN3相互作用在M2AR细胞中对5-AZA很敏感。
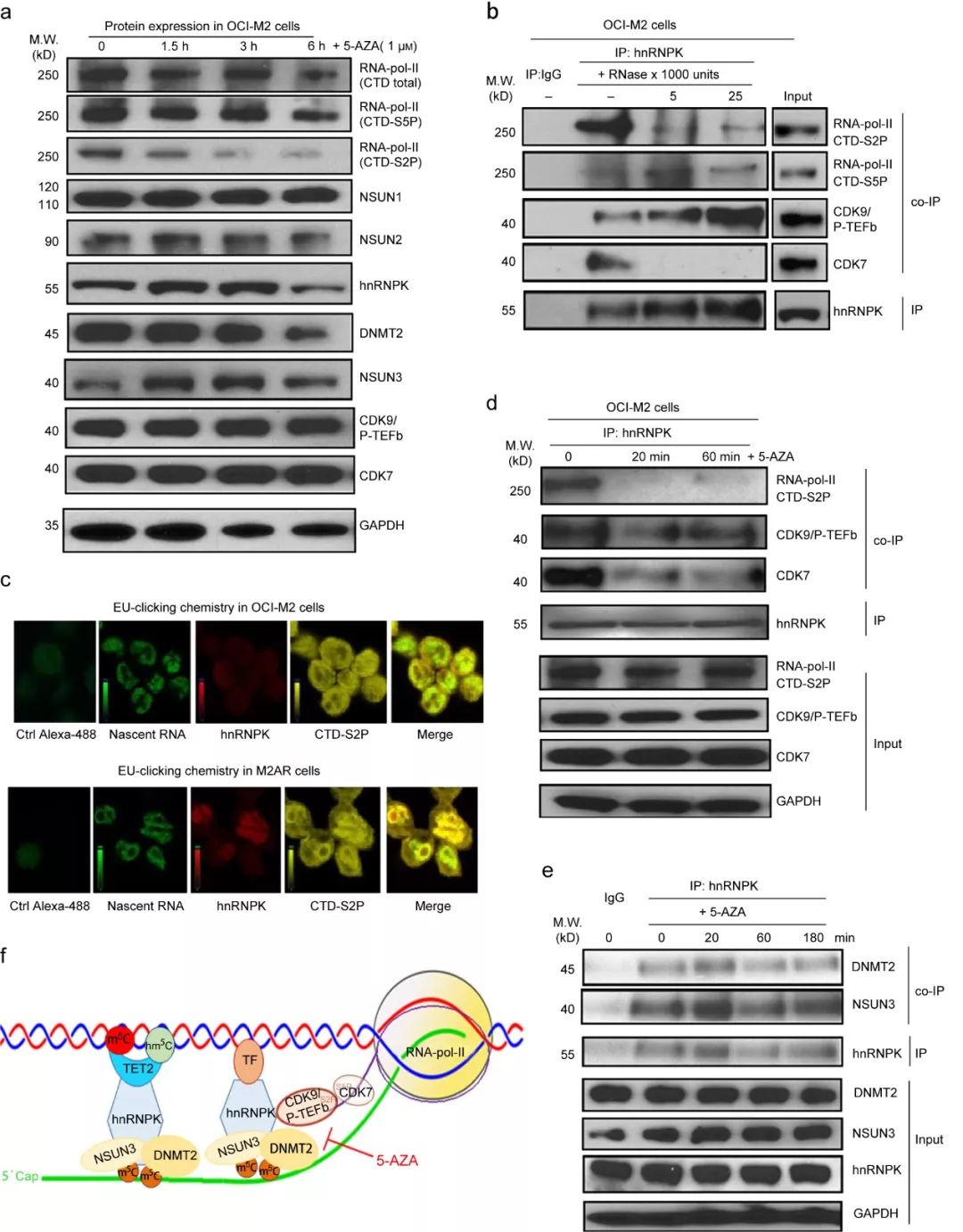
图5. 5-AZA破坏激活的RNA聚合酶II和hnRNPK/RCMT复合体
此外,如图6d,与OCI-M2细胞相比,BRD4相关的CTD-S2P在M2AR细胞中显著增加,而BRD4相关的CDK9/P-TEFb在M2AR细胞中基本无变化,BRD4与NSUN1的相互作用仅存在于M2AR细胞中。这些结果揭示NSUN1/BRD4/CTD-S2P是ARLCs中特有的复合体,暗示在
白血病细胞中NSUN1/BRD4介导5-AZA抗性。
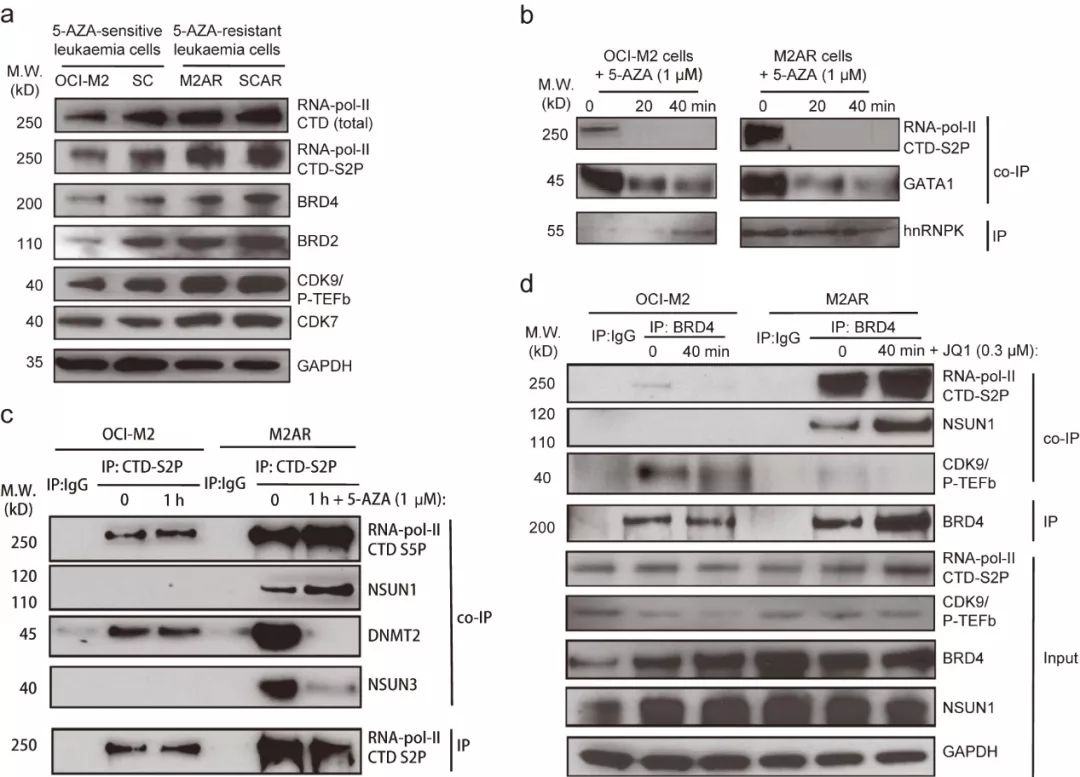
图6. 在ASLCs中确定CTD-S2P与NSUN1和BRD4的相互作用
7, 在ARLCs中存在不同的NSUN1/BRD4相关的活性染色质
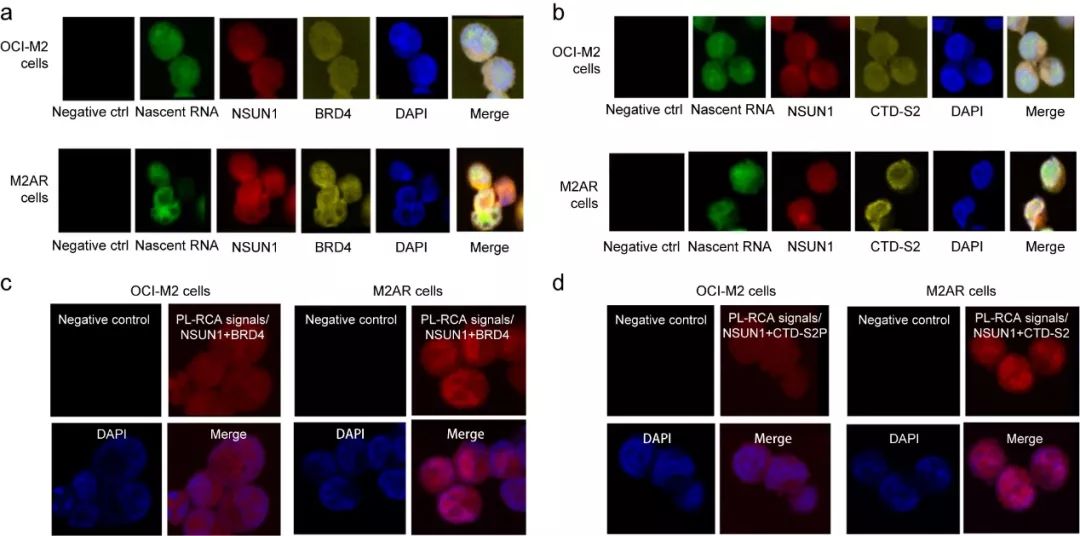
图7. 在ARLCs中在不同的NSUN1/BRD4相关的染色体结构
如图7a和7b,NSUN1、BRD4和CTD-S2P在OCI-M2细胞和M2AR细胞中与新生RNA都存在共定位,然而,在OCI-M2细胞中,NSUN1、BRD4和CTD-S2P与新生RNA的共定位是跟分散,相反,在M2AR细胞中,这些共定位形成不同核周围颗粒。PL-RCA实验进一步确定,与OCI-M2细胞相比,NSUN1和BRD4与CTD-S2P在M2AR细胞中具有更强的信号。这些结果证明
在ARLCs中存在不同的NSUN1/BRD4相关的活性染色体结构。
8, 靶向NSUN1/BRD4偏好抑制ARLCs细胞生长
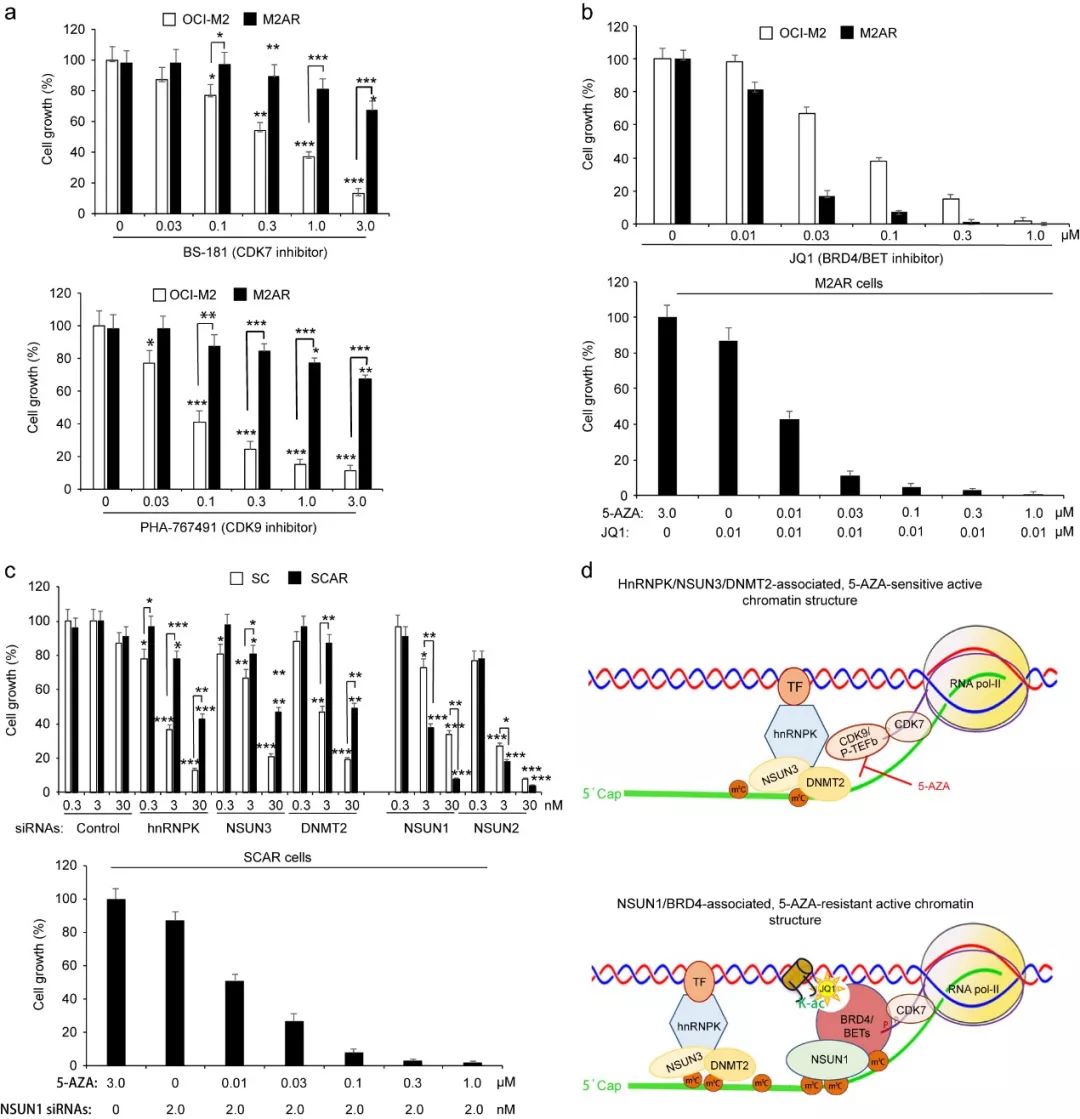
图8. CDK7/9 和BRD4的抑制剂以及RSMT siRNAs对ASLCs和ARLCs细胞生长作用
基于以上研究,研究者猜测ASLCs和ARLCs对靶向CTD激酶和RCMTs的抑制剂和siRNAs有不同的响应,分别使用BS-181和PHA-767491抑制CTD激酶活性、CDK7/9激酶活性,JQ1抑制BRD4。如图8a,与M2AR细胞相比,BS-181和PHA-767491对OCI-M2细胞生长抑制作用更强;然而,JQ1偏好抑制M2AR细胞生长(如图8b)。如图8c,敲减hnRNPK、NSUN3、NSUN2和DNMT2偏好抑制OCI-M2细胞生长,而敲减NSUN1偏好抑制M2AR细胞生长,此外,在5-AZA抗性细胞系SCAR中敲减NSUN1后,该细胞对5-AZA敏感。因此,
在5-AZA抗性细胞中,NSUN1/BRD4复合体对于5-AZA抗性起着关键作用。
9,mRNA:m5C在5-AZA抗性的临床AML/MDS细胞中显著增加
为进一步确定临床上AML/MDS中5-AZA抗性细胞中mRNA:m5C的临床特点,研究者收集了18例临床的AML/MDS病人细胞,其中9例是5-AZA抗性的病人,9例是5-AZA敏感性的病人。如图9a,质谱能够有效分辨mRNA:m5C和mRNA:A的峰,而且在典型的AZA抗性AML患者细胞中,m
5
C/A显著增加,这与定量分析不同临床样本中m
5
C/A比率是一致的,即m
5
C/A在5-AZA抗性AML/MDS患者细胞中显著增加(如图9b),在标准化后,这种差异更加显著(如图9c)。质谱结果暗示
在AML/MSD中,mRNA:m5C对于介导5-AZA抗性起着重要的作用。
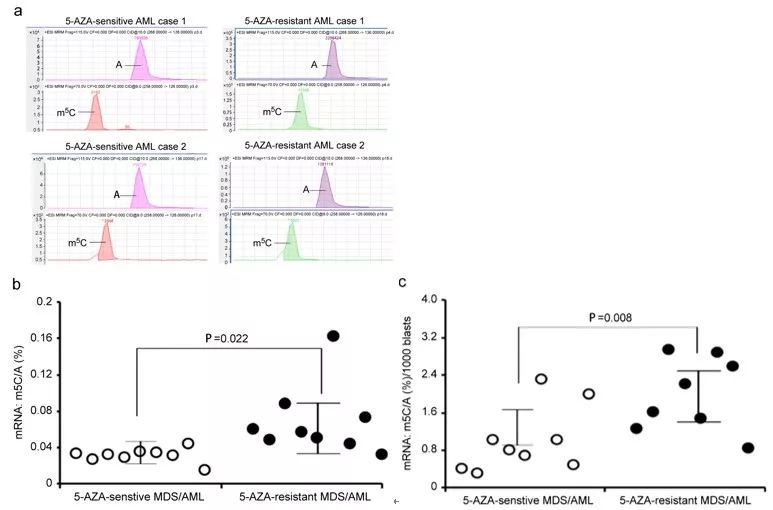
图9. 质谱分析临床5-AZA敏感/抗性的MDS/AML样本中mRNA:m5C水平
10, 在临床标本中存在与NSUN1/BRD4相关的活性染色质
研究者使用PL-RCA分析了5-AZA敏感性/抗性的AML/MDS中NSUN1、BRD4和CTD-S2P中的表达和共定位情况,如图10a和10b,与5-AZA敏感性AML病人细胞相比,NSUN1/CTD-S2P和BRD4/CTD-S2P在5-AZA抗性AML病人细胞中具有更强的共定位。由于临床样本中细胞数目有限,研究者不能实施进行co-IP和EU核酸标记实验,但通过形态学、免疫组化等分别检测了源自于正常对照组和多系发育异常(multilineage dysplasia,RCMD)亚型及AML病人组细胞中hnRNPK、NSUN1和BRD4的表达和亚细胞定位情况。如图10c,与正常组相比,hnRNPK、NSUN1和BRD4在MDS/RCMD和AML中显著增加,且它们的增加与MDS/AML病程相关;如图10d,与正常组相比,hnRNPK和CTD-S2P共定位在AML中显著增加。这些数据提示,在临床上,hnRNPK、NSUN1和BRD4的表达水平与MDS/AML病程相关,且参与调控5-AZA抗性和疾病发展。
最后,研究者对OCI-M2和M2AR、SC和SCAR细胞系进行了测序,特别分析了表观调控因子、DNA和RNA修饰蛋白相关的基因突变,与OCI-M2细胞相比,16个RNA修饰蛋白基因是M2AR细胞特异的;相似的是,与SC细胞相比,15个RNA修饰蛋白基因是SCAR细胞特异的,这些基因的发现将有助于进一步揭开白血病中5-AZA抗性的机制。