正文
什么是生物钟?
一、 昼夜节律的分子机制
迈克尔·杨(Michael W. Young)的父母出生于美国田纳西州东部的诺克斯维尔,1946年他们驱车前往迈阿密度蜜月。与诺克斯维尔的冬季不同,迈阿密的冬季温暖宜人。短短的几天他们便爱上了那里,并选择在那里定居。
迈克尔·杨在三年后出生。尽管他家族中从没有人从事过医学或者科研相关工作,父母也没有接受过大学教育,但他们却非常热衷于培养孩子对科学的兴趣。他们给迈克尔·杨买了显微镜和望远镜,迈克尔·杨做化学实验弄脏了家里的地板他们也完全不在乎。迈克尔 杨小时候对机械很感兴趣,而且曾经自己制作过卡丁车。
但更让迈克尔·杨感兴趣的是他家的后花园。那里有各种各样的动物,美洲蜥蜴、犀鸟、鹦鹉,还有花朵能够昼开夜合的奇怪植物。十二三岁的时候他的父母给他买了一本关于生物学和进化论的书,书中有一段关于控制花朵生物钟的描述。书中说对于生物体内的生物钟组成结构和作用机制我们一无所知。
确实如此。人们很早就观察到很多生物可以预测并适应环境中的日照变化。18世纪的时候法国科学家Jean Mairan将含羞草置于恒定黑暗的环境下。他发现含羞草的叶片活动仍能保持24小时的波动变化。这次发现也被认为是生物具有内源性节律的最早证据。
含羞草Artist unknown
19世纪的生物钟研究只停留在植物学,而到了20世纪由于生态学、动物行为学、原生动物学、进化生物学、哺乳动物生理学以及人类生物医学、农学等学科的发展,人们发现这是存于包括人类在内的多种生物体内的现象。而这个时钟其实有助于我们为日常的生理机能做好准备。这种规律性的适应被称为“昼夜节律”。但是人体内部生物钟的工作原理仍然是个谜。
到了上世纪60年代,生物钟的研究已经形成了一个细分的领域。1960年举行的冷泉港会议成了该领域的重要事件,会议后ColinPittendrigh总结了16条生物钟特性。尽管当时大多数人相信生物钟是由内在因素导致的,但Frank Brown等人却相信生物钟由与地球自转相关的物质引起的。
如果要研究一个生物体内的体系,那么我们必须清楚该体系的性质、与此相关的解剖学位置,而且必须阐明它的内在机制。当时已经发现生物钟几乎与物理时钟一样精准,但却具有一定的适应性和动态性,而且几乎所有的真核生物都存在生物钟。如果要研究生物钟的内在机制,尽管当时存在争议,但基因研究仍然是比较好的策略。
二、 Per基因
在上世纪70年代,加州理工学院的Seymour Benzer 和他的学生Ronald Konopka选择通过研究果蝇来寻找控制果蝇昼夜节律的基因。他们使用致突变剂诱导果蝇生物钟变化,发现一些果蝇的昼夜节律延长,一些果蝇的昼夜节律缩短,而有的果蝇昼夜节律则完全紊乱。而最重要的是他们发现这些类型的昼夜节律变化都指向了同一个基因。他们给这个新基因起了个名字:per(period, 周期)。那么这个基因是如何影响节律的呢?
基因的克隆为该问题的解决奠定了基础。美国布兰达斯大学的分子生物学教授罗斯迈克尔巴什 (Michael Rosbash) 和遗传学教授杰弗里 霍耳(Jeffrey Hall)是一对篮球场上的好战友,球场让他俩经常有机会在一起讨论一些科学上的新发现。当Benzer和Konopka发表了他们关于果蝇生物钟突变种的时候,罗斯巴什和霍耳注意到了这一发现的重大意义,于是他们俩就决定合作来克隆这个果蝇的生物钟基因。经过了2年多的努力,罗斯巴什和霍耳的实验室终于在1984年从果蝇中克隆到了per基因。
而迈克尔杨也在同一时期拿到了per基因克隆。1971年迈克尔 杨从德克萨斯大学奥斯汀分校毕业,并选择继续攻读博士学位。他当时痴也迷于果蝇的研究,通过随机诱导果蝇染色体重组来研究其与果蝇存活的相关性,并研究非致死重组的果蝇表型。当他在进行这项研究的时候Ron Konopka 和 Seymour Benzer 报道了果蝇的per基因与昼夜节律的相关性,而迈克尔 杨发现在染色体重组过程中曾使该基因产生断裂。
1978年迈克尔杨成为洛克菲勒大学的副教授,利用分子生物学手段来克隆per基因。而且他的课题组发现将包含per基因的重组DNA注射入含有per突变的动物体内会恢复期昼夜节律,并且发现昼夜节律突变的果蝇体内产生PER蛋白存在功能缺陷。

果蝇 by Adriana Paoletti
接下来在1988年罗斯巴什和霍耳发现PER蛋白具有昼夜变化规律,在1990年又发现per基因转录生成的mRNA也具有昼夜节律。所以PER蛋白的浓度会循环变化,其周期为 24 小时并且和昼夜节律相同。之后科学家需要研究的一个重大课题,就是 PER 这个蛋白如何保持稳定的周期变化。罗斯巴什和霍耳提出了一个假说:PER蛋白可以控制per基因的表达:PER蛋白和per基因形成了一个抑制反馈的环路,PER蛋白可以抑制基因合成自己,这样就形成了一个连续循环的环路。
但这个模型仍然存在几个问题,比如PER蛋白质只有从细胞质进入细胞核,才能抑制per基因。之后罗斯巴什和霍耳的研究表明每当晚上的时候PER蛋白会在细胞核里积累。但是它是如何进入细胞核的?1994年迈克尔杨发现了第二个节律基因tim (timeless)。tim基因可以编码 TIM蛋白,同样为正常节律所需。迈克尔 杨发现TIM蛋白会结合到 PER蛋白上,然后两个蛋白可以一起进入细胞核并且在那里抑制per基因的活性。
三、 完整的机制
罗斯巴什,霍耳以及迈克尔 杨的研究阐述了生物钟的理论基础,这也是他们拿诺奖的原因。可惜的是Seymour Benzer 和他的学生 RonaldKonopka因已经去世无缘诺奖。在随后的几年里,其他一些分子也被发现。我们将省略该部分的发展历史,直接叙述生物钟的分子机制:
1 抑制反馈的环路 果蝇分子生物钟的基础抑制反馈的环路发生在基因转录层面,细胞核内活化的per基因能够转录生成mRNA,PER蛋白能够稳定存在并且在细胞浆内累积。PER蛋白在夜晚达到最大浓度并进入细胞核。在细胞核内PER蛋白能够抑制自身基因转录。在早晨的时候PER蛋白会降解,几小时之后所有PER蛋白消失并解除对per基因的抑制,PER蛋白的生成重新开始。
2Per基因的转录活化 per基因的转录需要CYC和CLOCK蛋白结合到per基因的启动子才能够进行。在夜晚的时候CYC/CLOCK复合物能够结合到启动子位置并诱导per基因转录。而当PER蛋白与CYC/CLOCK复合物直接作用之后会抑制转录过程的进行。在早晨的时候PER蛋白分解,接触对CYC/CLOCK复合物的抑制,转录重新开始。
3 PER蛋白与TIM形成复合物 tim基因与per基因都能够被CYC/CLOCK复合物活化。转录生成的TIM蛋白与PER蛋白形成二聚体抑制PER蛋白的降解。PER/TIM复合物进入细胞核与CYC/CLOCK复合物产生直接相互作用并抑制tim与per基因的转录。日出之后TIM蛋白会降解并导致TIM蛋白随之降解。基因的抑制作用解除,转录继续。
4PER蛋白与TIM蛋白降解果蝇doubletime蛋白 (属于激酶) 通过产生磷酸化诱导PER蛋白降解,在PER蛋白与TIM蛋白结合之后PER蛋白却无法被doubletime诱导降解降解。日出之后会引起果蝇眼内的感光的隐花色素异构化,并使之活化。活化的隐花色素能够诱导TIM蛋白降解。由于TIM蛋白降解,PER蛋白无法保持稳定而随之被降解。突变的doubletime蛋白会导致昼夜节律延长。
生物钟 by Lance Bifoss
这个过程并不是一成不变的,多种因素能够对该过程进行精细调控。比如果蝇眼内的感光的隐花色素能够结合TIM蛋白并诱导其加速分解解释了光在生物节律调节中的作用。
生物钟调节
人的细胞昼夜节律与上述过程基本一致:细胞内的昼夜节律通过影响蛋白的合成、转运、结合以及降解而产生。而生物钟能够通过参与昼夜节律分子机制的组分来影响极为众多的基因与蛋白功能,从而影响人的体温、血压、肠胃蠕动、心率、代谢速率、毛发生长等等一系列过程。虽然在缺乏外界因素的情况下生物钟能够独立运行并保持基本节律,但这并不意味着生物钟完美无缺不需要修正,相反在某些情况下我们需要重置我们体内的生物钟。比如光照的变化能够调节脑内的生物钟使其能够与外界的光照同步。但人的生物钟是调节的呢?
人的下丘脑内存在一对用来掌控人生物钟的一对神经元从称为视交叉上核(SCN),如果对SCN进行电刺激,那么人的昼夜节律将会以预定的方式产生改变。切除SCN将会消除生理运动、睡眠、饮食的昼夜节律 (人的睡眠不止是受昼夜节律调控)。因为人的一系列行为与日出日落的周期同步,所以日光将会是调节人生物钟的重要因素。

下丘脑 by Tillian Reeves
这一过程是由下丘脑通过视网膜下丘脑束来完成的。视网膜神经节细胞的轴突与SCN神经元的树突通过突触直接相连,而视网膜产生的输入信号足以对人的昼夜节律产生调节,以适应外界的白昼与夜晚的变化。神经节细胞能够表达黑视蛋白(Melanopsin),光照可使该细胞缓慢激活并将信号通过视网膜下丘脑束传导至SCN,而SCN调节昼夜节律之后将信号通过突触连接或分泌加压素将信号传递到脑的其他部位并产生一系列变化。
而在此过程中SCN能够将来源于视网膜的昼夜更替的信息传递给松果体。松果体形似松果,位于上丘脑且能够分泌褪黑素。褪黑素的分泌因SCN导致的松果体活化或抑制而呈昼夜节律变化。研究发现松果体分泌的褪黑素能够影响多种体内过程。
以上解释了昼夜节律和生物钟的基本概念(注意昼夜节律和生物钟并不等同,生物钟引起并能够调节昼夜节律),那么生物钟对人的健康会有什么影响?
生物钟的意义
昼夜的更替伴随着人的一生,是影响人类生活最重要的规律之一。而人也会产生与之适应的睡眠觉醒周期以适应黑夜与白昼的变换。当然生物钟不仅作用于人的睡眠和觉醒,还能对人的情绪,食欲,心脏功能,免疫系统产生影响。但我们早已对生物钟的存在熟视无睹,只有在某些特定的情况下我们才能够感受到他的重要性。
提起生物钟对人生活的影响,大家首先想到的可能是长途飞行导致的时差(Jet lag)。时差问题不仅可以影响人的睡眠,还可能对人的认知功能产生影响,并让人变得劳累,易怒,且有可能产生头痛,消化问题。这正是由于人的内在生物钟与外在环境时间的错位导致的。
另一个引起生物钟紊乱的常见例子是轮班制工作。与时差问题相同,轮班制工作也可能导致包括睡眠障碍在内的一系列问题。但与时差问题不同的是轮班制工作可能会长期进行,所以对身体的影响可能更明显。流行病学研究发现轮班制与2型糖尿病相关,而且可能导致女性患乳腺癌风险提升,并可能提升其他癌症风险。这可能是由于昼夜节律紊乱影响了褪黑素的肿瘤抑制作用,因此世界卫生组织把轮班制也列为可能致癌因素(probable carcinogen)。轮班工作也可能导致诸如心脏病、高血压、精神疾病的慢性病疾病加重。

生物钟 by Fatherly
由于生物钟能够影响体内几乎所有的生理过程,所以药物疗效和毒副作用也会因生物钟的存在和药物治疗的时点选择而产生差异,该研究领域被称为时间治疗学(chronotherapeutics)。
人的睡眠习惯一般会有差异,有些人习惯早睡,有些人习惯晚睡。这种习惯一般会长期保持而且通常人们能够适应这种习惯。但某些因内在原因导致的昼夜节律睡眠障碍确是一种疾病。该类疾病患者通常具有超过24小时的昼夜节律,或者因为昼夜节律功能损伤或传入/传出通路受损引起对外界环境变化无法做出反应,而且该昼夜节律睡眠障碍通常是注意缺陷多动障碍的合并病症。
治 疗
生物钟紊乱会对人的工作生活和健康产生很大影响,但我们该如何治疗生物钟相关障碍呢?由于时差问题通常只是暂时性的,几天后症状便可自行消失,因此并不需要治疗。对于经常长途飞行并且饱受时差困扰的人以及轮班制工作的人,医生可能会酌情开具类似唑吡坦的短效催眠药。此外光照或者避光疗法在某些情况下可以帮助调节昼夜节律。
对于大多数昼夜节律睡眠障碍患者需要包括特定时间光照/避光,合理睡眠时间计划,以及药物干预的多重策略进行治疗。药物的治疗包括褪黑素,莫达非尼等药物。莫达非尼用于治疗睡眠唤醒障碍的作用机制尚不清楚。
褪黑素是一种内源性激素,即使你没听过这个名词,你肯定也听过一句广告词:今年过节不收礼,收礼只收XXX:褪黑素正是该产品的主要成分。褪黑素在美国和加拿大是非处方药,在中国则作为保健食品销售,在其他一些国家,褪黑素可能需要凭处方使用或者处于未批准状态。褪黑素由视网膜、眼部晶状体、胃肠道及松果体中的松果体细胞生成。松果体产生的褪黑素是内分泌荷尔蒙会进入血液,视网膜和胃肠道则产生旁泌性荷尔蒙。下丘脑的视交叉上核会由视网膜接收每日光暗的规律,从而影响褪黑素的制造。
褪黑素治疗睡眠障碍疾病的作用存在一些争议,而在癌症、癫痫、继发性痛经以及精神错乱等疾病领域没有合理的临床证据支持其有效性。褪黑素在动物体内的主要生物作用是通过活化褪黑素受体产生的。而其他如线粒体或细胞核保护作用则基于其抗氧化作用。

褪黑素引发的怪梦 Artist unknown
褪黑素受体属于G蛋白偶联受体家族,人体内主要存在两种亚型MT1和MT2。MT1能够表达于SCN,参与生物钟的调节过程。MT2受体则可表达于视网膜。虽然褪黑素具有一系列的生理作用,并且有证据支持其治疗作用,但其药代性质不佳,比如首过效应强,半衰期短从而限制了它的疗效和应用。基于其信号通路而开发药物能够帮我们找到比褪黑素本身活性更高,选择性更好,药代性质更佳的药物。
新 药
由于存在内源性配体,因此可以利用褪黑素为模板来设计新的化合物。已上市的药物都能够对两种受体产生作用。1986年开始褪黑素受体激动剂的作用研究就已经开始,但到目前为止仍未完全理解,褪黑素受体激动剂与受体结合后会影响一系列生理过程。而药物开发的适应症主要集中于睡眠障碍。
雷美替胺是第一个上市的褪黑素受体调节剂,其半衰期约为1-2小时,明显长于褪黑素的20-30分钟。阿戈美拉汀是第一个上市的治疗重度抑郁的褪黑素受体调节剂,相比其他类型的抗抑郁药物,阿戈美拉汀不会产生停药综合症和导致性功能障碍(关于该化合物的研发过程可阅读文末参考文献中Nature Reviews Drug Discovery的精彩文章 doi:10.1038/nrd3140)。2013年FDA批准另一个褪黑素受体激动剂他司美琼上市用于治疗完全失明患者的昼夜节律睡眠障碍(非24小时障碍)。
已上市褪黑素受体通路相关药物
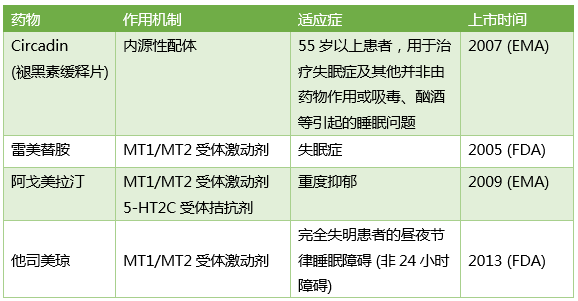
由于褪黑素所参与的信号通路影响极为广泛,所以褪黑素受体调节剂的潜在治疗领域不只局限于睡眠障碍,还包括疼痛,炎症,心血管疾病,中枢神经系统疾病以及癌症或者代谢类疾病等等。但大多数褪黑素受体调节剂是上世纪八九十年代合成的,现在该领域的研发并不活跃。
褪黑素受体主要有MT1和MT2两种受体(MT3为低亲和受体),它们在体内的多种组织内表达,要确定每种受体的特性和具体参与的过程也比较困难。未来MT1/MT2选择性抑制剂的开发可能会占主导,但我们必须站在对褪黑素受体通路深刻理解的基础上才能更好的帮助我们开发新的药物,拓展新的适应症。
结 语
已故的Seymour Benzer和Ronald Konopka以及今年获得诺贝尔奖的三位科学家对于昼夜节律的分子机制做出重要贡献,但我们不应该忘记无数参与昼夜节律/生物钟研究,以及相关的新药研发的科研工作者。科学的重大进展并不是凭一己之力就能完成的,在表彰三位获奖者的同时,我们并不能忘了背后默默奉献的其他人。
最后还应该感谢很多科学家的挚爱:果蝇。

By Josh Wheless
参考资料
1. Nature Reviews Molecular Cell Biology, 6: 965-971. 2005.
2. Bora Zivkovic, Circadian clock without DNA--History andthe power of metaphor. 2011
3. The Drosophila Molecular Clock Model, YOUTUBE.
4. Michael Rosbash (Brandeis): Understanding Circadian Rhythms,YOUTUBE.
5. Autobiography of Michael Young.
6. Nature, 485, 45–46. 2012.
7. Neuroscience exploring the brain. BOOK.
8. HHMI, The Drosophila Molecular Clock Model.
9. Wikipedia: Circadian rhythms. Melatonin receptor agonist.
10. Nobel Prize Release.
11. Psychiatric Times, The Role of Melatonin in theCircadian Rhythm Sleep-Wake Cycle.
12. Your Body's Internal Clock and How It Affects YourOverall Health. 2012
13. NIH, Circadian Rhythms Fact Sheet.
14. Mayo Clinic, Jet lag disorder.
15. Continuum (Minneap Minn). 19:132–147. 2013.
16. Nature Reviews Drug Discovery, 6: 628-642. 2010.
17. Journal of Medicinal Chemistry, 57(8):3161-85. 2014.
Jerry专栏
艾滋病疫苗研发的漫漫长路
深度长文:为什么CRISPR必须拿诺奖?(上)














