今天的题目很惊悚有没有?即便抗癌药物产生耐药性,也只是对癌细胞生长没有抑制作用,怎么会刺激癌细胞增长呢?
要回答这个问题,我们需要了解一个概念,剂量-效应曲线。所谓剂量-效应曲线是指一种外来化合物剂量与个体或群体呈现某种效应的定量强度,或平均定量强度之间的关系。
听起来很拗口是不是?那么我们可以将剂量-效应曲线类比为一个人的喝酒后的反应,例如喝一瓶啤酒基本无变化(药物剂量很低,基本无效应),两瓶微醺(药物剂量提高,效应初现),三瓶烂醉如泥(药物剂量进一步提高,效应明显)。
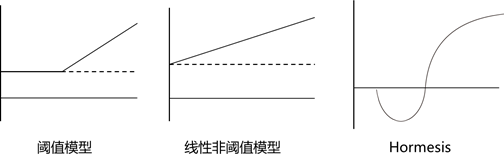
传统的剂量-效应关系一般用两个模型可以预测:阈值模型和线性非阈值模型。它们认为
当酒喝到一定量之后,必然会醉酒,喝得越多,醉酒的可能性越大。 但是2005年Calabrese在《Nature》上发文质疑了传统的阈值模型和线性非阈值模型,提出了更为普遍的适用的Hormesis模型。
Hormesis模型与传统模型差别主要体现在低剂量上,传统模型认为饮酒量较低时,人体基本不出现任何反应。
但是Hormesis模型认为,当饮酒量较低时,会出现兴奋反应(小酌后,有的人会话密有没有?)。
这种兴奋效应在临床应用的很多药物中都有体现。如一些抗肿瘤药物(如苏拉明)在高剂量下抑制细胞增殖,此时具有临床疗效,而在低剂量条件下又成为一种局部激动剂刺激细胞增长。
So,抗癌药物刺激癌细胞生长的说法并非耸人听闻。
今天米粒儿跟大家分享一篇Hormesis领域研究论文,由此初步了解Hormesis现象产生的原因。
标题:
Hormetic effect of panaxatriol saponins confers neuroprotection in PC12 cells and zebrafish through PI3K/AKT/mTOR and AMPK/SIRT1/FOXO3 pathways
(回复
17427
下载论文,一周内有效)
本文关注临床常用的心血管疾病治疗药物人参三醇皂苷(PTS)对神经细胞PC12和斑马鱼帕金森氏症的Hormesis效应和神经保护效应。研究思路有着满满的套路感,共分三个阶段:效应(表型),体外机制研究,体内验证实验。
(1)研究发现PTS在低剂量刺激PC12的生长,高剂量则呈现明显的抑制效应。低剂量PTS处理后明显减轻6-OHDA引起的细胞毒性。
(2)低剂量PTS处理后激活PI3K/AKT/mTOR细胞增殖通路和AMPK/SIRT1/FOXO3细胞生存通路。
(3)低剂量PTS处理可挽救6-OHDA引起的斑马鱼多巴胺能神经元损失,修复斑马鱼运动损伤。高剂量PTS处理则呈现明显神经毒性。

以这种较为套路化的研究思路,仍然可以发表在5分杂志(Scientific reports),它的秘诀是什么呢?首先,Hormesis效应研究关注较少且具有明显的临床意义,因此该选题具有一定的创新性。此外,从研究深度来讲,本文通过体内和体外实验阐明了造成这种不同效应的机制,这在Hormesis研究领域是不多见的,因此本研究具有相当的深度。
通过以上分析,大家是不是对Hormesis研究跃跃越试了,那么具体的实验如何设计呢?我们仔细剖析一下这篇论文,从中便可以得到答案。
首先,
采用MTT方法,作者检测了不同浓度PTS处理对PC12细胞增殖影响。结果显示,PTS在低浓度促进细胞增殖,其中浓度为0.12mg/ml时刺激效应最大(30.3%)。而当浓度增加至4mg/ml时,PTS呈现出轻微的抑制效应。这一结果表明PTS对PC12细胞增殖呈现明显Hormesis效应。
进一步的,
作者探讨PTS是否对6-OHDA引起的细胞死亡产生保护效应。PC12细胞暴露于低剂量PTS 24小时后,再经过0.25mM 6-OHDA处理。
采用MTT和TUNEL染色,分别检测细胞增殖和细胞凋亡变化情况。结果表明PTS预处理后,细胞增殖明显加快,细胞凋亡比例降低。这一结果证明低剂量PTS可以抑制6-OHDA的神经毒性。
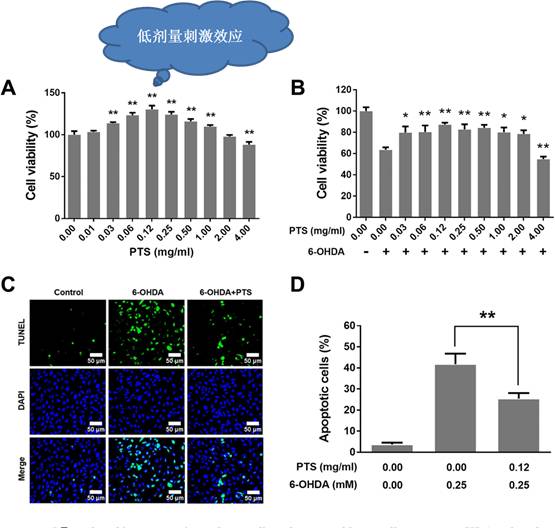
接下来,
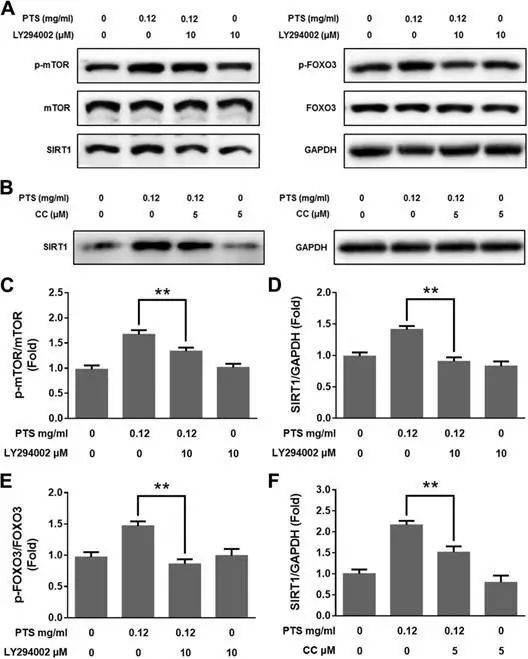
作者在效应的基础上,继续进行机制探讨,回答低剂量PTS如何促进PC12细胞增长。作者选择了两条通路:PI3K/AKT/mTOR细胞增殖通路和AMPK/SIRT1/FOXO3细胞生存通路。
采用western blot检测了通路中关键蛋白表达变化。发现低剂量PTS暴露后,PI3K/AKT/mTOR和
AMPK/SIRT1/FOXO3通路都被激活。
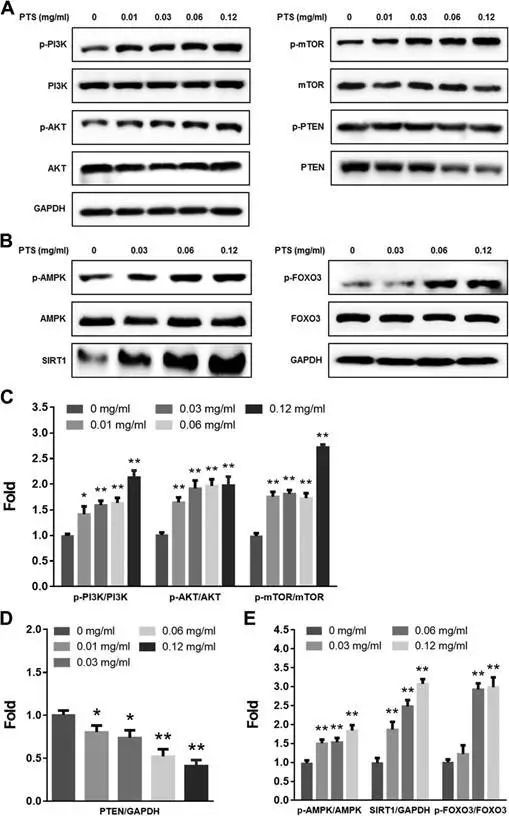
而加入PI3K/AKT/mTOR和AMPK/SIRT1/FOXO3通路抑制剂LY294002,CC,rapamycin,NAM后,PTS低剂量的刺激效应减弱,这一结果进一步表明PI3K/AKT/mTOR和AMPK/SIRT1/FOXO3通路参与PTS Hormesis效应调节。
紧接着,
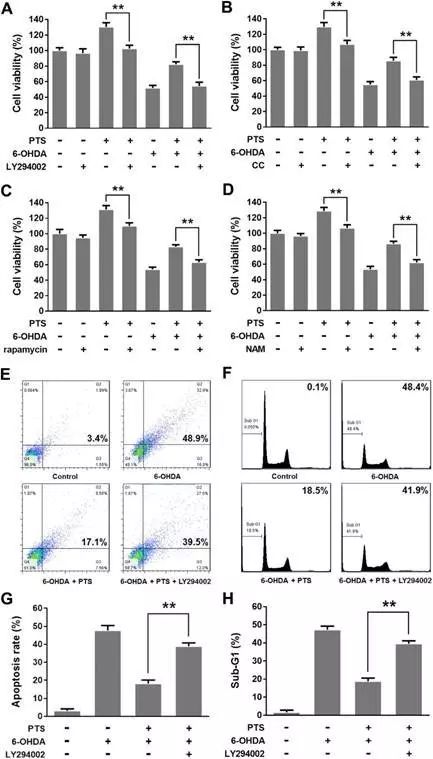
作者探讨了PI3K/AKT/mTOR和AMPK/SIRT1/FOXO3是否参与PTS低剂量神经保护作用的调节。
MTT结果表明加入抑制剂LY294002,CC,rapamycin,NAM后,PTS的保护作用消失,而细胞凋亡比例明显升高。这些结果表明PI3K/AKT/mTOR和AMPK/SIRT1/FOXO3参与PTS低剂量神经保护作用的调节
最后,
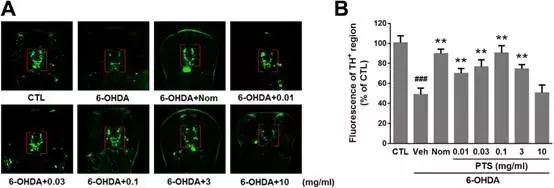
作者以斑马鱼为动物模型,研究PTS体内神经保护作用效应和机制。如下图所示,经过6-OHDA处理48h后,斑马鱼DA神经元消失50%左右,而当低剂量PTS和6-OHDA同时处理时,神经元消失比例明显降低。高剂量PTS则没有这种效果。