▎药明康德/报道

默沙东(MSD)公司近日宣布,FDA已批准PD-1单抗KEYTRUDA ®(pembrolizumab)联合化疗药培美曲塞和卡铂(PEM/carbo)用于转移性非鳞状非小细胞肺癌(NSCLC)的一线治疗,且不受PD-L1表达量的限制。FDA根据肿瘤反应率和无进展生存期(PFS)数据加速审批该适应症。
这是FDA首次批准PD-1单抗作为转移性NSCLC组合疗法。KEYTRUDA也是目前唯一一个被批准同时作为单药和联合疗法用于转移性NSCLC患者一线治疗的PD-1单抗。这项批准使得KEYTRUDA成为更多肺癌患者的选择,尤其是初诊的部分肺癌患者。
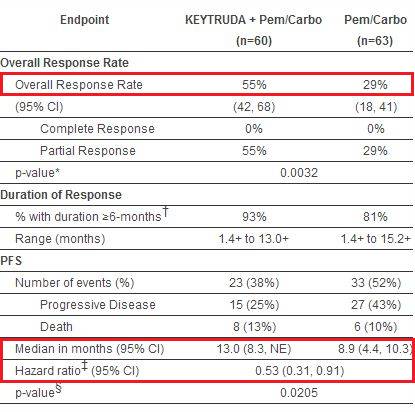
该组合用药方案的批准是基于KEYNOTE-021临床试验。该试验招募了123名未经治疗的转移性非鳞状NSCLC患者,不含EGFR或ALK基因突变,不受PD-L1表达量限制。在这项试验中,KEYTRUDA联合化疗的有效率几乎是单独使用化疗的两倍(客观缓解率ORR指标分别是55%对29%)。此外,KEYTRUDA联合化疗的中位无进展生存期是13个月,对比单独化疗的8.9个月有明显延长(PFS 13.0个月对8.9个月),联合化疗能降低47%的疾病进展风险(HR 0.53)。
▲来自KEYNOTE-021试验的临床数据(图片来源:默沙东官网)
此前,FDA已批准KEYTRUDA单药作为PD-L1阳性肺癌患者的一线治疗,用于不含EGFR或ALK基因突变,且具PD-L1高表达的转移性NSCLC患者,PD-L1表达量要经过FDA批准的诊断试剂测试,肿瘤比例分数[TPS]≥50%。同时,FDA也批准KEYTRUDA单药用于转移性NSCLC患者的二线治疗,患者的PD-L1表达量要求是TPS≥1%,之前接受过含铂化疗后疾病仍进展。含有EGFR或ALK基因突变的患者,如果在使用FDA批准的靶向药治疗后仍疾病进展,也可以接受KEYTRUDA治疗。
默沙东研究实验室总裁Roger M. Perlmutter博士认为:“KEYTRUDA与培美曲塞/卡铂联合用药对改善疾病缓解是显著的,这也凸显了寻找新疗法,解决转移性非鳞状细胞非小细胞肺癌患者未满足需求的重要性。FDA的批准将进一步支持我们致力于改善癌症患者的生活。”

▲默沙东研究实验室总裁Roger M. Perlmutter博士(图片来源:默沙东官网)
宾夕法尼亚大学医院(Hospital of the University of Pennsylvania)胸外科肿瘤主任、医学教授Corey Langer博士谈到:“ 这个批准标志着治疗肺癌的一个重要里程碑。现在,不论PD-L1表达如何,pembrolizumab联合培美曲塞和卡铂可以用在转移性非鳞状非小细胞肺癌患者的一线治疗处方中。医生应继续根据每个患者的个人特征,包括生物标志物,组织学和其他临床指标,来确定每个人的最佳治疗方案。”
Bonnie J. Addario女士是肺癌幸存者和Bonnie J. Addario肺癌基金会创始人,她表示:“ 这种免疫疗法、培美曲塞和卡铂的组合对患者而言是个好消息,祝贺默沙东公司和FDA如此迅速地对我们患者治疗方案进行重要补充。这项批准又给肺癌患者带来新的希望。”
参考资料:
[1] FDA Approves Merck’s KEYTRUDA® (pembrolizumab) as First-Line Combination Therapy with Pemetrexed and Carboplatin for Patients with Metastatic Nonsquamous Non-Small Cell Lung Cancer (NSCLC), Irrespective of PD-L1 Expression
[2] FDA Approves Frontline Pembrolizumab Combo for NSCLC
















