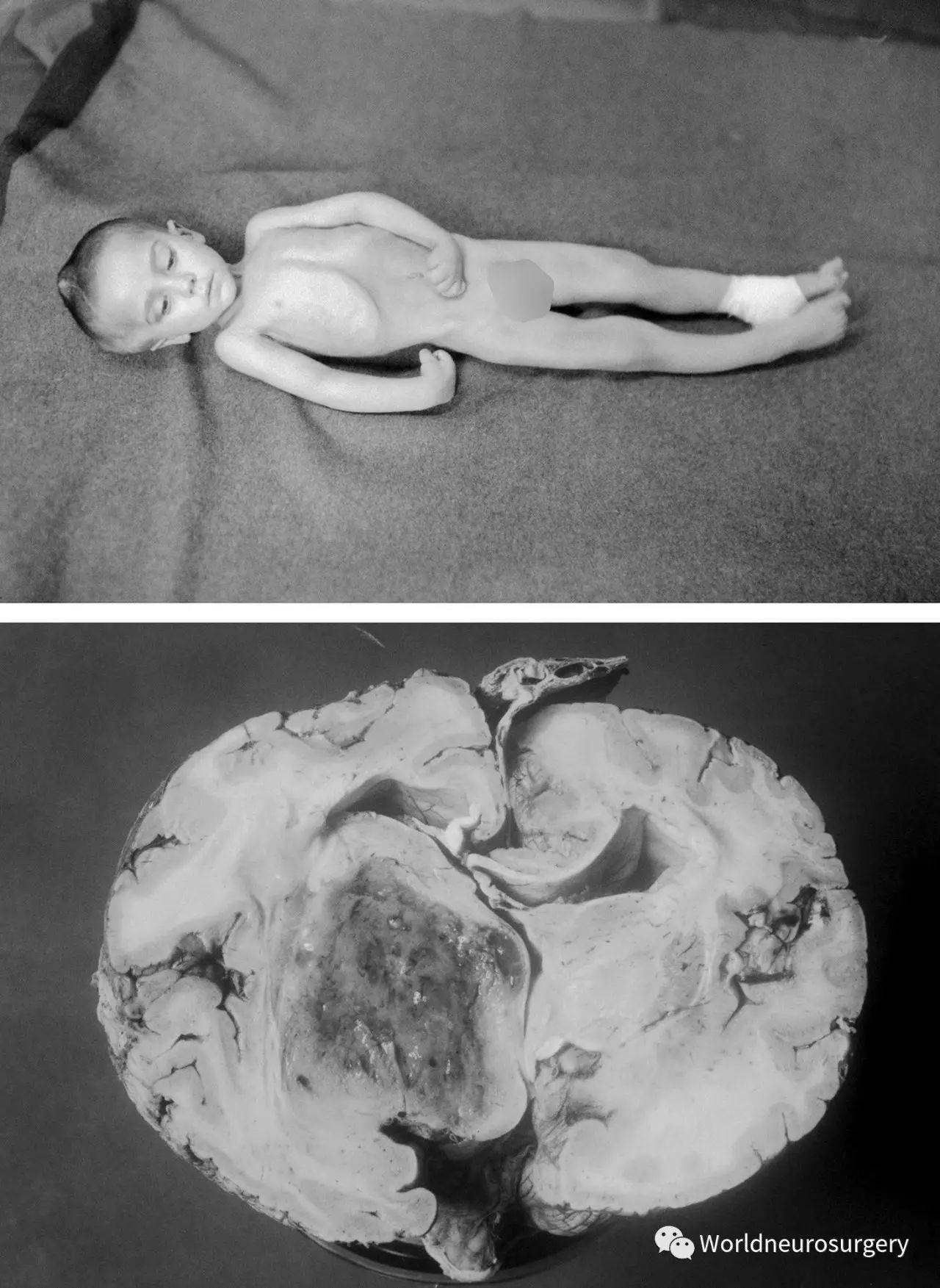
图1:1926年,患儿哈维-库欣接受了右顶开颅术,术中未见明显异常。术前这名儿童左侧肢体偏瘫进行性加重,术中未见皮层明显异常。随后,这名患者的神经功能继续恶化,呈去皮质强直状态(上图由库欣教授的住院医师大卫-杜夫提供),最终颅脑尸检标本显示为丘脑高级别胶质瘤(陈列于耶鲁大学库欣脑肿瘤注册中心)。
高级别胶质瘤可以起源于神经胶质细胞,也可以由低级别胶质瘤分化而来。高级别胶质瘤(WHO Ⅲ、Ⅳ级)包括间变性星形细胞瘤,间变性少突胶质星形胞瘤,多形性胶质母细胞瘤,胶质母细胞瘤,以及间变性少突胶质母细胞瘤。
原发性和继发性多形性胶质母细胞瘤的分子遗传学差异明显。原发性初级多形性胶质母细胞瘤表皮生长因子(EGFR)相对高表达,PTEN基因缺失,以及CDKN2A(p16)凋亡,而继发性多形性胶质母细胞瘤常常包含TP53和异柠檬脱氢酶(IDH)突变。
尽管神经肿瘤学和显微外科技术不断发展, 但是高级别胶质瘤患者的五年生存率仍然不足10%,总的中位生存期仍不到两年。然而,如果患者接受肿瘤扩大切除,以及经过放疗和替莫唑胺化疗(TMZ) 等辅助治疗,则有助于提高生存率。
患者的年龄、功能状态(KFS卡氏评分)、肿瘤组织学分型是确定患者预后的最重要参数。尽管努力做了大量调查研究, 但胶质瘤的切除程度对肿瘤的自由侵袭扩展,以及对患者生存期的影响,仍然不清楚。进行相关随机研究也是不切实际的。大量可靠的回顾性报告已经证明,切除肿瘤至少达到78%,才能显著提高生存率,而且已经证明,越多切除肿瘤,生存率越能进一步提高。
很明显,不是在手术室,而是在实验室可以发现治疗胶质母细胞瘤的有效方法。不利的是, 高级别胶质瘤有生物学和分子异质性,这是限制设计(甚至相同肿瘤) 有效治疗方案的主要因素之一。
手术目的仍然是完整切除肿瘤强化部分,同时保留神经功能。手术处理前后过程中的任何不足,将会导致风险/受益比增加。
这些肿瘤通常发生在幕上额叶、颞叶或枕叶。它们通常膨胀性或蔓延/浸润性生长至深部结构。手术前应针对手术目的制定周密计划,这也是手术过程中最重要的一部分。
术中神经导航技术和荧光技术, 包括5-ALA和荧光素,显著提高了肿瘤切除范围。尽管如此,有研究表明,这些技术的使用,并没有明显提高患者的总体生存率。
手术中我常规使用导航和荧光技术,通过荧光技术,能更有效的完全切除肿瘤的强化部分。
对于神经功能良好的年轻患者,治疗模式在安全的基础上,应更积极一些。对于年龄超过65岁的患者,尽管手术全切肿瘤强化部分,但预后仍然很差,因此,这些患者更适合活检加辅助治疗。对于多发病灶,亦应当采取相对保守的外科策略。最终,应当基于由神经外科医生、神经肿瘤医师、放射肿瘤医师组成的团队(脑肿瘤组)多学科讨论的结果,对患者进行个性化治疗。
诊断
高级别胶质瘤患者经常出现各种各样的症状,如肿瘤弥漫性浸润至强化范围之外导致的记忆功能障碍,或许这些症状无助于病灶的定位。询问病史时,家属或患者本人在谈及病史过程中,常回忆起个性改变和记忆缺失。
颅高压常导致头痛和呕吐,头痛位置常为非特异性的。癫痫发作可以是主要症状,亦可在诊断后和治疗过程中发作。神经功能缺陷与肿瘤部位一致,并与血管性水肿有关。
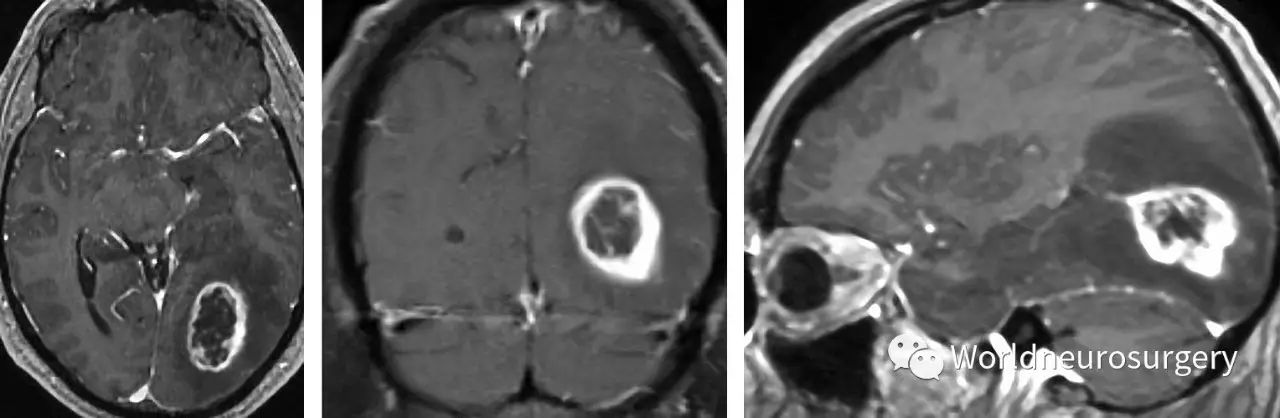
图2:左枕叶病灶,环形强化,符合高级别胶质瘤的典型影像学表现。请注意:肿瘤尾端进入脑室(右图)。
评估
计算机断层扫描(CT)常为最先获得的影像资料,然而,为观察肿瘤范围及对比强化,进一步磁共振成像(MRI)平扫和增强检查是必需的。在考虑做任何占位性病变扩大切除前,应当排除神经胶质瘤病、多发病变以及软脑膜胶质瘤。
肿瘤的大小常与占位效应和水肿不成比例。对于环形强化病变,常需与淋巴瘤、转移性肿瘤、放射性坏死、血肿吸收期、近期梗塞、多发硬化斑块和脑脓肿等疾病鉴别。对怀疑为非手术病变,如淋巴瘤和多发性硬化进行活检前,需要完善进一步的非侵入性检查。
脓肿常常是多发的,伴有明显的周围水肿和规则的厚壁强化。此外,病人伴有原发感染的症状,如发热、萎靡,以及近期的慢性感染或血源性化脓性炎症。如病灶于脑室周围,有明显的实质性均匀强化,则更支持淋巴瘤的诊断.
单光子发射计算机断层扫描 (SPECT)和正电子发射X线断层扫描(PET)对高级别胶质瘤的诊断有帮助和提示意义,因为它们可以提供脑血流量图像,但它们都没有足够特异性可以代替活检。磁共振波谱成像和磁共振灌注成像可以帮助鉴别复发肿瘤和放射性坏死。
手术适应症
肿瘤切除的手术适应症包括组织学诊断(相对于单纯活检),改善肿瘤引起的症状,以及延长患者生存期。在年轻患者中,可手术切除额叶、右侧颞叶脑浅部亚功能区巨大肿瘤。然而,手术切除邻近或位于功能区的肿瘤仍有争议,尤其对于一般状况良好的患者。
一般较难证明手术相关的短暂性神经功能缺损。功能较差的患者很难从外科手术中获益,因此应该选择活检,对大于70岁的老年患者,必须非常审慎的选择较为积极的外科手术。
一些具有多中心的肿瘤,比如横跨胼胝体,或起源于深层结构如丘脑的肿瘤,不适合进行手术。即使没有病理诊断,有些丘脑肿瘤也可采取辅助治疗,因为丘脑组织活检风险很大。
尽管应用术中唤醒技术,我仍不相信可以安全地切除岛叶深部的高级别胶质瘤。纵然功能神经纤维束和皮层得到了保留,但术后神经功能仍有可能下降。如病灶在非优势半球表浅位置,且患者较为年轻,可考虑应用术中唤醒技术切除肿瘤。
切除感觉运动区和语言中枢等功能区的高级别胶质瘤,常导致神经功能恶化,即便术中保留了这些神经纤维束和脑皮质,也可能发生这种情况。因此,要切除已浸润语言区的肿瘤,我会很谨慎的衡量手术对于这些患者的风险收益比。不幸的是,不管我们多么努力,这些患者生存时间都很短,甚至用来恢复术后暂时性神经功能缺损的时间都没有。
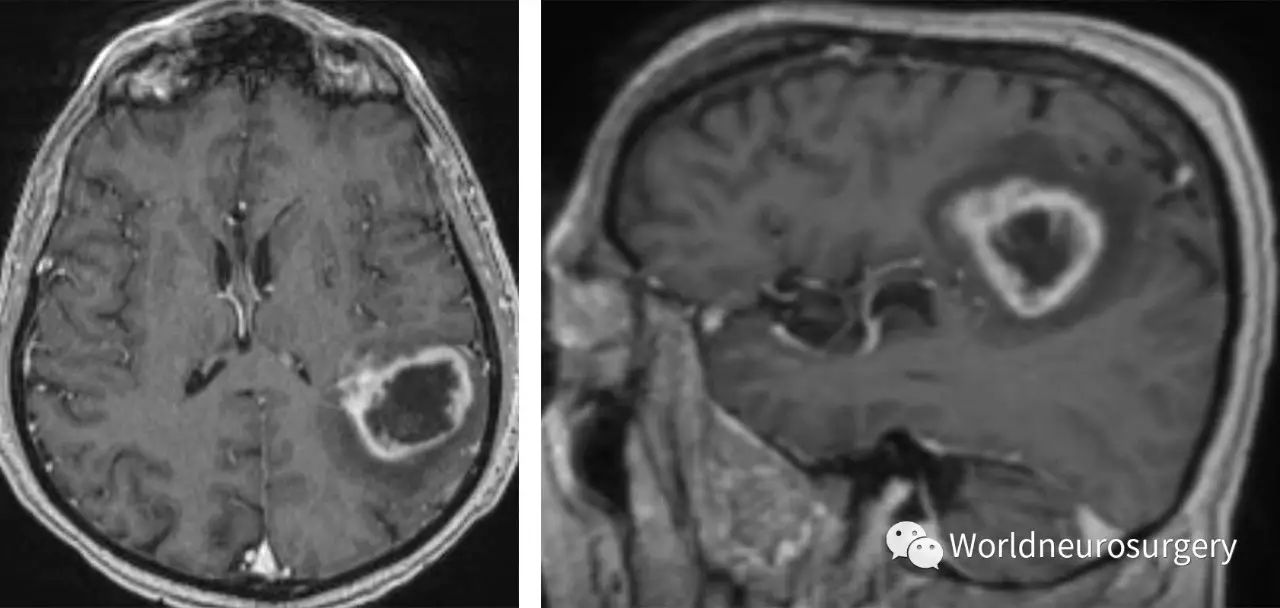
图3:上图显示的是一位62岁的患者,角回周围高级别胶质瘤,表现为轻度的言语困难。在我看来,尽管利用术中唤醒技术,切除此肿瘤仍很有可能导致永久的言语功能障碍。仅对肿瘤进行了活检,而后进一步辅助治疗。
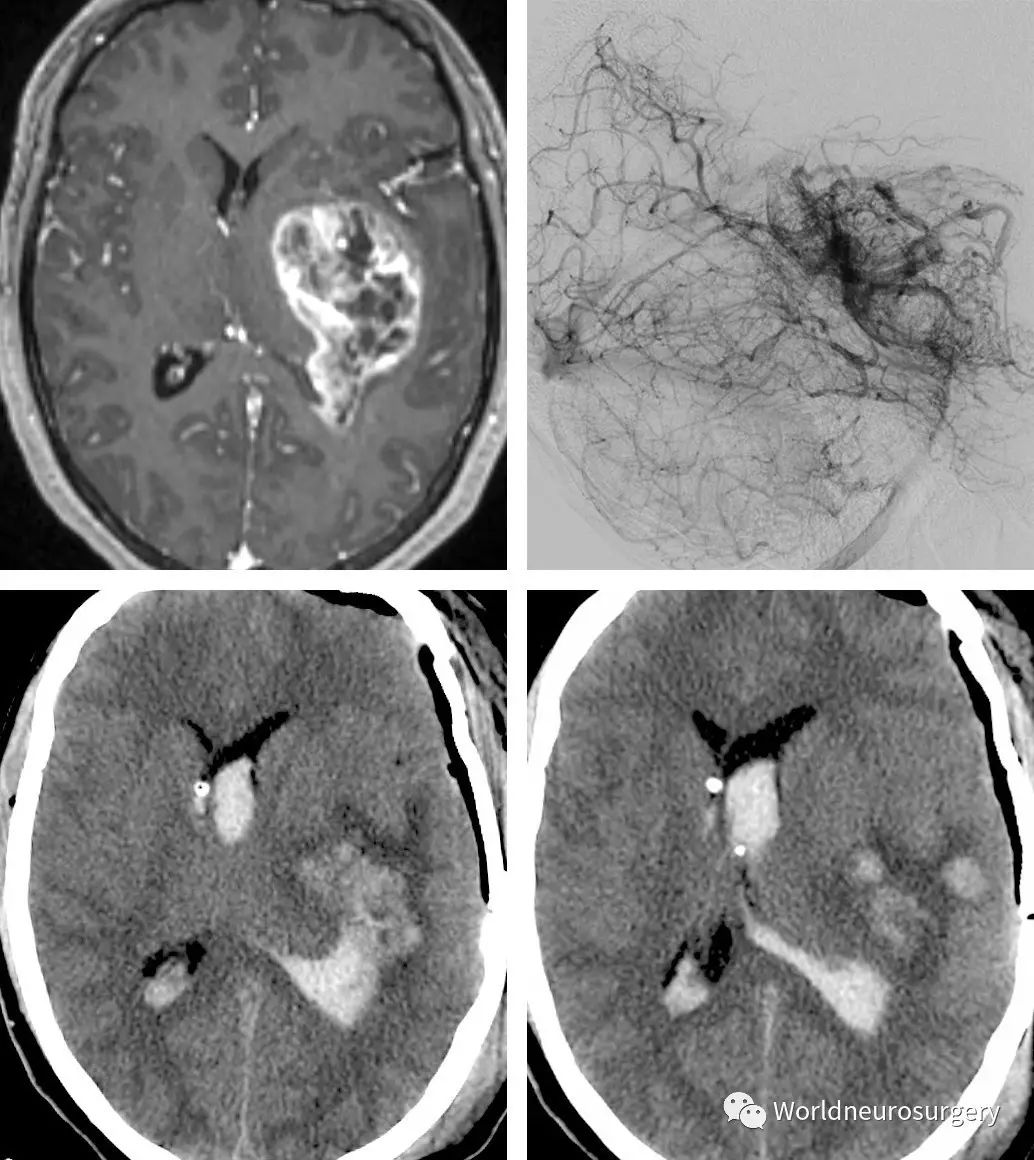
图4:血供丰富的高级别胶质瘤是高度恶性肿瘤。次全切除也有很大的风险。上图是一位26岁表现为头痛的左颞叶胶质母细胞瘤患者,采取肿瘤次全切除。(上图,侧位血管造影显示该肿瘤丰富的血供和早期的动静脉分流)。术后CT扫描(下图) 显示了瘤腔内大量出血。虽然她比较年轻,支持手术切除,但是如果肿瘤位置较深难以全切,活检也许是更加合理的选择。
术前注意事项
强烈建议术前举办专门的神经肿瘤会诊,保证独立坦诚的讨论手术益处,这对于患者及家属来讲,也是一个讨论术后辅助治疗选择的机会。要把患者本人考虑在各种治疗协议中,因为有些术前准备需要其参与 (如疫苗试验)。
术前、术中和术后应用类固醇激素减轻水肿,术前也应该预防应用抗癫痫药物,如果术后没有癫痫发作,可在术后7天停用。
神经导航技术和荧光技术可作为提高肿瘤增强部分切除率的辅助工具。我术中不使用MRI,因为利用神经导航和荧光技术相结合,已经提供了必要的帮助,它们可确保在术中彻底有效的切除肿瘤强化部分。
高级别胶质瘤的切除
根据肿瘤位置和神经导航数据开颅,最需要显露额颞叶,因为高级别胶质瘤好发于这些脑叶,更多细节请参考Cranial Approaches卷。
不幸的是,几乎所有的高级别胶质瘤患者,都会经历肿瘤复发,而其中一些需要再次手术。因此最初设计头皮切口时,要考虑到将来肿瘤可能复发的部位,包括肿瘤残腔边缘复发,需要二次开颅。通常,肿瘤常复发在最初手术时,医生难以到达的解剖位置上。
线性切口可使带蒂血管皮瓣较为宽大,这最适合再次手术时,扩大延长切口,肿瘤切口可以有效愈合,同时,放化疗后皮瓣死亡的风险最小。
虽然,小切口似乎有吸引力,但一些患者需要大切口,以便有足够手术空间最大化的切除肿瘤。肿瘤引起的水肿需要大骨窗进行手术,以免造成颅骨缘的脑皮层嵌顿和脑梗塞,它们会模糊术者视野。
硬膜内的步骤
胶质瘤手术在技术上并没有太多挑战性。下面回顾一下基本的手术原则和技术。

图5:弧形或放射状切开硬脑膜,切口要暴露病变四周正常脑组织。借助导航定位,确定肿瘤位置后,开颅骨窗要更大,以便显露肿瘤周围皮层功能区。易见增粗的肿瘤引流静脉。在特定脑区,胶质瘤边界与脑回一致。正常皮质成为一薄层,覆盖在白质内的肿瘤假膜上。右下图中,以“X”标记定位肿瘤表面,黑色缝合线标记肿瘤的皮质下界面。
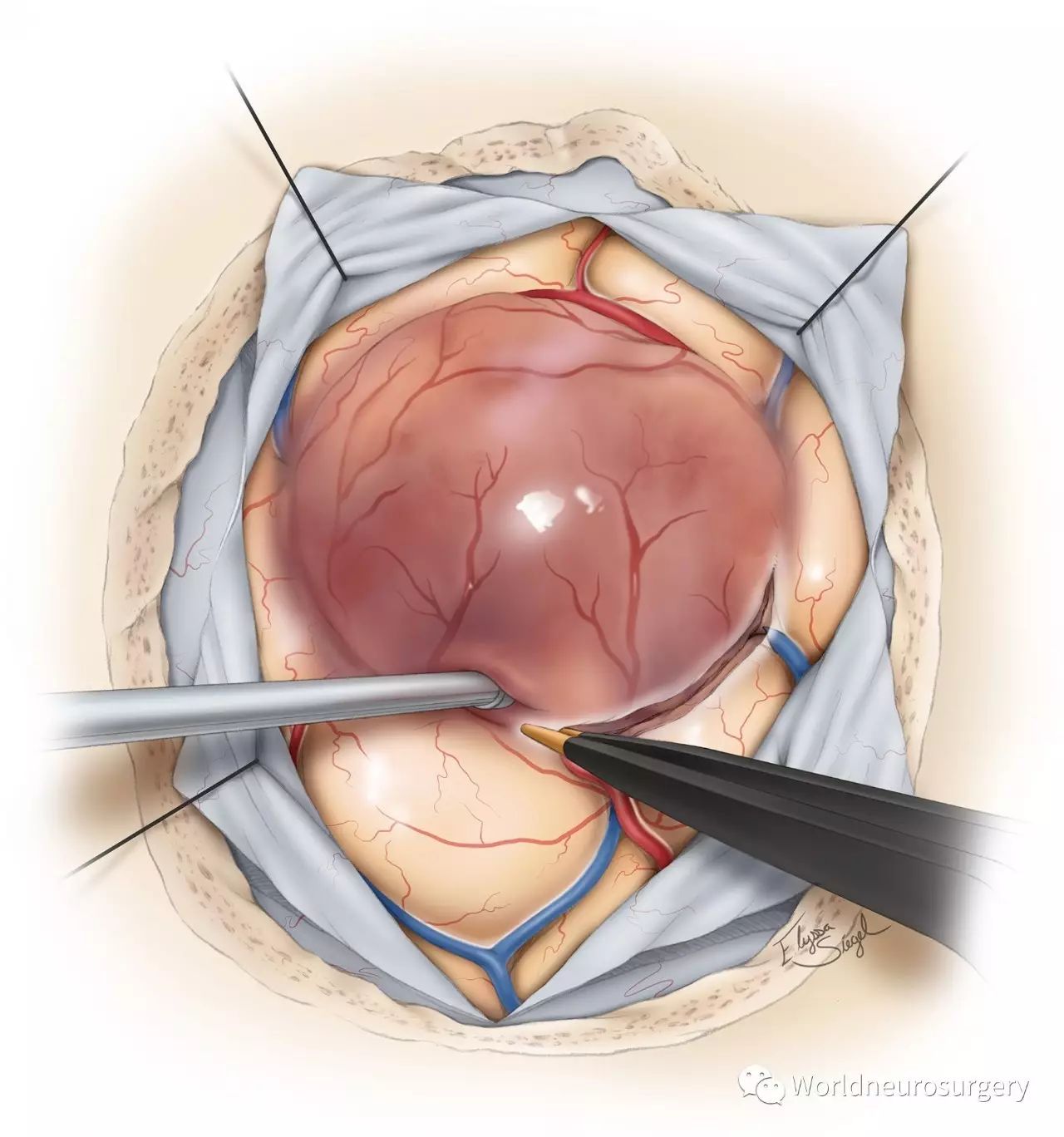
图6:受肿瘤浸润的脑回肿胀变色,血供比正常脑组织丰富。有些肿瘤的软脑膜边界明显。软脑膜下电凝解剖,可以把肿瘤从周围皮质中分离。必须小心保护肿瘤周围的过路血管。肿瘤减压前,我用双极电凝标记皮层上肿瘤的边界。肿瘤减压后脑组织移位,会导致导航精确性下降。
小块肿瘤组织病理送检后,证实术前诊断。
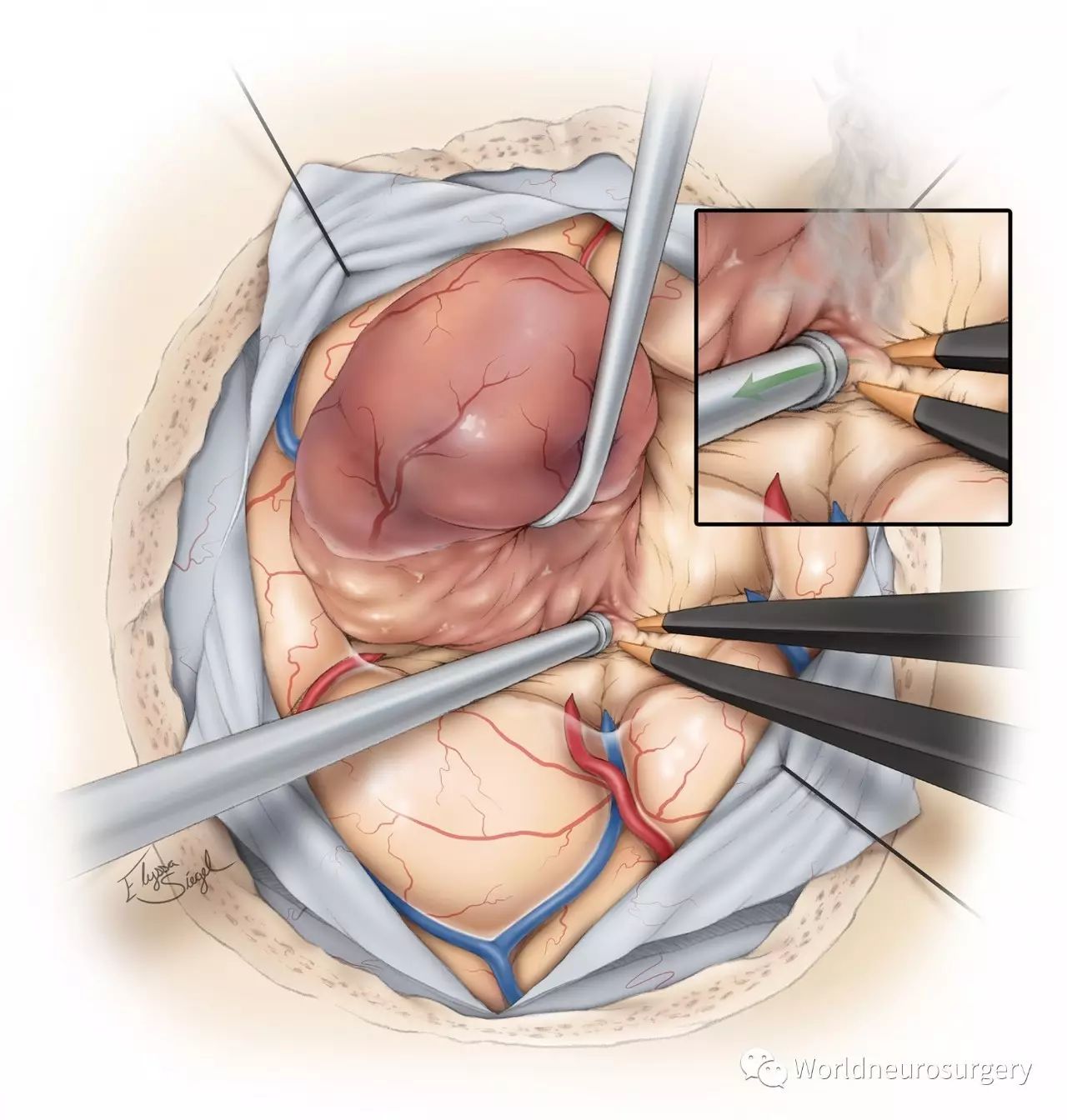
图7:高级别胶质瘤生长较为弥散,尤其当肿瘤穿过白质纤维束,其边界就很难完全从邻近瘤周组织中标记出来。肿瘤的坏死灶很容易辨别,然而对比增强的增生带看起来和瘤周组织很相似,这一特点会误导外科医生切除了坏死灶,而遗漏一些对比增强带。
有时,在对比增强带和周围组织之间会形成一个假的界面。
神经导航和荧光技术可以有效帮助医生彻底切除肿瘤的强化部分。当肿瘤残腔坍塌,瘤壁折叠起来时,残余的肿瘤易于隐藏在瘤壁里,这种情况下荧光技术就特别有用。
如果可能,我倾向从四周分离肿瘤,而后全切之。这种策略提高了手术效率,最大程度减少了出血,并且,能使术者沿着肿瘤边缘和周围正常组织之间的方向,去切除肿瘤。在肿瘤的内部和周边同时操作,会导致出血增多,分辨不清肿瘤的边界。
吸引器不仅可以吸引,还可以用做剥离子和牵开器,作为牵开器时,可以动态的阻止肿瘤残腔坍塌。
要特别强调切开白质和分离神经胶质肿瘤的技巧,用双极电凝反复夹闭和电凝假包膜,这种逐步电凝的策略可以乳化肿瘤的假包膜,使它从瘤周水肿组织分离下来。接下来,吸出乳化的肿瘤实质,暴露下一层假包膜,做进一步的电凝和分离。
同时进行上述的分离和电凝技术。换句话说,双极电凝的有效工作,就像反复张合的肿瘤剪一样切除肿瘤(上图,图6中,插图)。
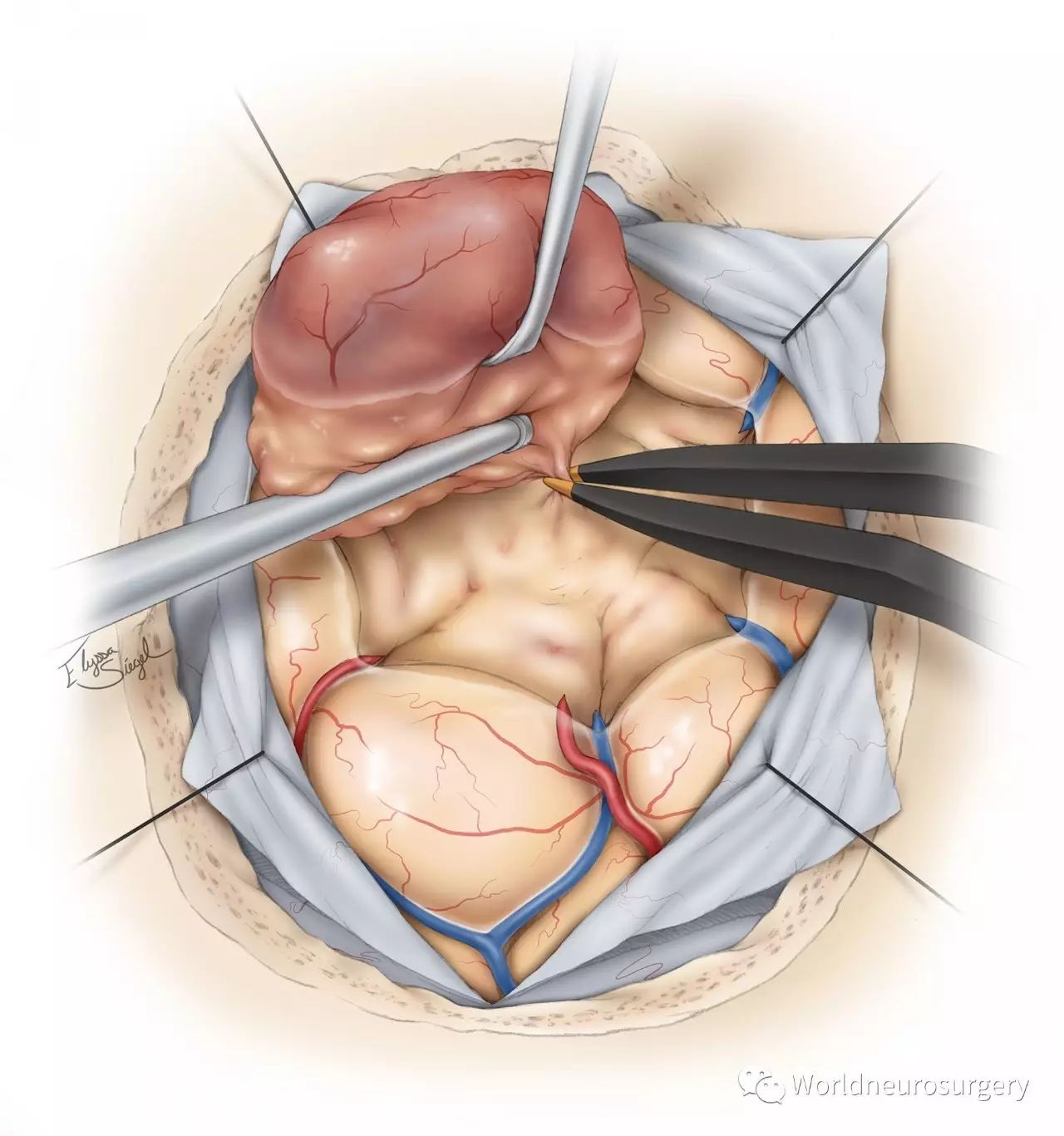
图8:使用双极电凝沿着肿瘤的周边电灼和分离,我先切除肿瘤大部,而后沿瘤腔皱壁查找残留肿瘤。要保留肿瘤深部脑沟内小的过路血管。如果肿瘤侵及脑室,应充分显露脑室内的肿瘤,予以切除。
止血特别重要。术后血肿形成的最常见原因为肿瘤残余。因此,全切肿瘤就是最好的止血方法。基于此,我并不热衷于部分切除高度侵犯功能区的高级别胶质瘤。
我通常不在肿瘤残腔铺垫速即纱(美国爱惜康公司 辛辛那提市,俄亥俄州),因为这可能会掩盖出血点,并给术者造成手术止血已经安全的假象。而且,速即纱也会导致术后MRI增强延迟,造成与潜在肿瘤复发相混淆。
关颅
对于幕上开颅,我并不坚持硬脑膜的水密缝合。硬膜悬吊可防止硬膜外血肿或积液形成,切口皮缘应对位良好。
术后注意事项
术后48小时内应复查MRI,以评估肿瘤残余。激素逐渐减量,以便患者耐受。术后预防性使用抗癫痫药物,如果无癫痫发作,7天内逐渐停用。我鼓励神经肿瘤医师在患者出院前,预期做一短暂的临床探视,讨论病理结果并制定进一步治疗策略。
如果切口愈合良好,患者可在术后2周接受放射治疗。
经验与教训
Contributor: Gina Monaco, MD
DOI: https://doi.org/10.18791/nsatlas.v4.ch02.5
原著作者: Aaron Cohen
编译者:安徽省阜阳市人民医院神经外科,孙鹏举,硕士,主治医师。 审校:安徽省阜阳市人民医院神经外科,高志波,博士,副主任医师,副教授,科室副主任。
终审:沈阳军区总医院神经外科,董玉书
,博士后,副主任医师,副教授。
【视频】荧光引导的高级别胶质瘤切除:新进展

【视频】经颞下回后部入路切除左侧海马旁胶质母细胞瘤

【视频】胶质母细胞瘤切除

The Neurosurgical Atlas
系列---肿瘤部分
为了让大家之作全文原汁原味再现,平台集聚了
百位
神外临床一线专业医
师,译稿经过反复推敲斟酌出炉,
欢迎大家阅读。添加微信
149321040
即可加入平台(
点击下方链接就可以查阅全文翻译
)
垂体腺瘤的诊断及其手术治疗
镰旁脑膜瘤手术操作技巧
侧脑室肿瘤手术技巧
内镜下颅底外科手术彩绘
感觉运动功能定位图在胶质瘤术中的应用
嗅沟脑膜瘤手术策略
脑转移瘤的诊断及其手术治疗
经鼻内窥镜辅助下的蝶窦入路方法
鞍结节脑膜瘤手术技巧及策略
脑室内肿瘤手术概论
大脑凸面脑膜瘤手术技巧
脑肿瘤手术切除的基本原则
矢状窦旁脑膜瘤
上皮样囊肿和皮样囊肿的手术策略
经皮质入路胶样囊肿切除手术策略
脑室内手术的基本原则
低级别胶质瘤手术治疗策略
下丘脑错构瘤
经小脑幕入路处理海马旁病变手术技巧

















