▎药明
康德/报道
2014年初,劳拉·布雷尔利(Laura Brealey)在女儿家的大理石地板上摔了一跤。后续的检查中,她意外发现自己患有肺癌。医生快速为她进行手术,切掉了
她
的一部分右肺,并给她进行放疗和化疗。治疗后,肿瘤细胞消失了,她看起来很有希望康复。但是第二年夏天,Brealey女士开始感到肋骨疼痛。癌症回来了。2016年4月,Brealey女士即将开始她的第三种药物——一种叫做
Opdivo
的药物,她的医生是年轻的肿瘤学家Charlie Swanton博士。
Brealey女士的故事是癌症患者常见的抗癌经历。最初的治疗方式似乎击退了肿瘤,但是手术刀,放射线和药物轮番上场之后,肿瘤依旧复发,而且似乎比以前更具弹性。肿瘤细胞是个顽固的敌人。即使是针对肿瘤背后特定遗传缺陷的最新药物,也不能永久抵抗肿瘤的反攻。
我们一直忽视癌症
最根本的一个特征
——
它是一种不断进化的疾病
。这听起来很奇怪。我们习惯于动物、植物或微生物会进化,但癌症不是独立的生命体,而是我们的一部分。然而,它也会随着时间而进化,适应新的生存压力。
在经典的癌症观点中,细胞不断积累突变,直到它摆脱抑制其生长的制衡,不受控制地分裂成为肿瘤。这种对癌症发生的理解就像那幅著名的进化图。

▲
著名的智人进化图(图片来源:spigotmc.org)
然而,这种线性理解并不准确。实际上,肿瘤很快就变化成为各种各样的细胞,所有这些细胞都携带有
独立的突变
。一些细胞可能变得增生更快,一些细胞可能变得能够逃避脱免疫系统攻击。随着时间的推移,最适合生存的癌细胞才能产生更多的后代,并逐渐占据主导地位——这正是达尔文自然选择的本质。
进化并非线性的过程,
而更像是一棵树,从树干长到枝繁叶茂。1837年,查尔斯·达尔文(Charles Darwin)在他的一本笔记本中画了一棵树,表示物种如何从一个共同的祖先进化。根据他的理论,可以很容易地画出肿瘤的进化树。

▲
肿瘤的遗传多样性(左)回应了达尔文画的进化树(右)(图片来源:Cancer Research UK)
这种认识可以部分解释抗击癌症的持久战为何意外地困难重重。临床医生通常对肿瘤进行活检(biopsy)来诊断这些疾病,但
单次活检可能会错过重要的突变
,因为相隔几厘米的活检样本可能意味着非常不同的预后效果。当我们用药物或放射线治疗肿瘤时,其实是
创造了有力的人工选择过程
,选择了更顽固的肿瘤细胞能够生存。癌症患者最初受益于化疗。但随着时间的推移,他们会出现对多种药物的抗性。这就是复发和耐药性产生的原因。
唯一可以真正理解肿瘤在任何时候都比临床医生领先一步的只有达尔文选择。传奇生物学家Theodosius Dobzhansky博士曾说过,“除了进化之外,生物学中没有什么是有意义的。”
癌症研究人员正在学习这一课。
通过了解癌症如何进化,他们希望能想得比癌症更快。
Charlie Swanton博士带领的研究团队设在克里克研究所(Crick Institute)和伦敦大学学院(University College London),获得英国癌症研究(Cancer Research UK )慈善项目资助。从2013年开始,Swanton博士开展了一项名为TRACERx(TRAcking Cancer Evolution through therapy Rx)的重大研究项目,
通过治疗追踪癌症进化
。这项数百万美元的研究由超过200名医师参与,招募850名肺癌患者。项目在同一名患者诊断、治疗、治愈或复发几个时间点获取其肿瘤样本,使用这些样本信息来了解癌症随着时间的推移如何变化,如何影响患者的病情,并研究如何检测和控制进化趋势。
本文开头提到的Brealey女士就是第39位参加TRACERx项目的患者。
癌症的世界里,进化时刻在发生
认为癌症在不断进化的观点并不是新的。
1976年,癌症研究员Peter Nowell博士在著名的《科学》杂志上发表了一篇名为“肿瘤细胞群体克隆演化”的文章。这是一篇预言性质的论文,概述了研究人员以后确认的许多内容。他认为:“更多的研究应该是在肿瘤进入到临床晚期阶段之前,理解和控制癌症进化过程。
由于过于领先时代,Nowell博士的观点在当时没有被重视。在20世纪70年代,分子生物学是热门的新兴领域,各种新技术的出现使得科学家们可以在不可思议的细节上研究细胞。生物学发展出许多独立的细分领域,出现了研究微观细胞和分子以及研究整个生物体的两个阵营。通常,
癌症研究人员加入前者,进化生物学家加入后者。
Mel Greaves博士是个例外。现在已是
英国癌症研究所
进化研究中心(Center for Evolution at The Institute of Cancer Research)主任的Greaves博士,1960年代还在伦敦大学学院学习,专注于进化原理研究。他的导师给他灌输的观念是,身体内的细胞也受到自然选择影响,就像物种内的个体一样。所以当他读到Novell博士的文章的时候,眼前一亮。他说:“我当时想‘这就是癌症问题的根本!’这篇文章让人嗅到正确的味道,让我想起了我正在做的一切。”
但是直到世纪之交,能够针对单个癌细胞的基因组测序新技术出现时,Greaves博士才在儿童白血病的工作中实践了这一理论。2010年,Greaves博士和他的团队通过基因测序研究了30名白血病患者。在每一个患者中,他们确定了200个癌细胞内的突变,并比较了这些细胞之间的关系。“马上,我们看到了树木,”他说:“你可以找到最初突变的细胞,找出它的后代及后代的后代。”在之后两年,
学术界兴起了一波癌症进化的研究热点。

▲
肿瘤进化示意图,从正常细胞变成
肿瘤细胞通常要经过许多驱动突变
(图片来源:《自然》)
通过TRACERx项目分析肿瘤异质性,并追踪其从诊断到复发的进化轨迹,Swanton博士发现了癌症进化的机制。2012年,Swanton博士和他的同事们从一个肾癌患者样本中发现了进化树。团队成员Marco Gerlinger博士回忆说:“即使是用肉眼,就能看到显而易见的变化。肿瘤样本有不同颜色,有些地方含血更多;有些地方是淡黄色半透明的外观,因为它们正在储存脂肪;还其些地方是棕色的,非常致密,表明缺乏血管。”
癌症本身就是一个世界。
一端的肿瘤细胞与另一端的肿瘤细胞,以及转移的继发性肿瘤细胞,都含不同的基因突变。Swanton博士在肾癌样本中检测到了128个突变,大约只有三分之一的突变类型中各个肿瘤部位中存在,四分之一的突变类型是独一无二的。另外三例肾癌患者的样本分析结果也有这样的特点。其他研究人员在食道癌、肠癌、脑癌、乳腺癌、
胰腺癌
等多种癌症中都发现了相同的分布规律。Greaves博士说:“可以认为每个患者都同时有几种独立的癌症。例如白血病患者会有3到20种。天知道肺癌有多少种。”

▲
Swanton博士团队发现的肾癌进化树,蓝色-普遍共有突变,红色-特有的突变,黄色-原位癌共有突变,绿色-转移癌共有突变(图片来源:参考资料[14])
在这些发现的推动下,
癌症研究也开始“进化”
。到目前为止,我们还没有明白癌症这种怪兽的本质。
“我不感到退缩,”Greaves博士微笑着说:“现在我们知道为什么癌症治疗失败,为什么我们在消除这种疾病方面如此困难。这就像细菌的耐药性。这是一场进化式的军备竞赛。”
洞察力意味着战斗胜利了一半,剩下的一半就是努力解决这个问题。
抗癌就像下棋,而不是打地鼠
第一代的抗癌药物主要是打击癌症的快速增殖。但是在人类基因组完成测序后,研究人员期待开发出更精确的武器,通过寻找促进癌症发展的基因突变,针对这些基因设计药物。Udai Banerji博士任职于
伦敦的英国癌症研究所,是这家
世界上最有影响力的癌症研究所中的一名医学肿瘤学家,他认为,在“靶向治疗”进入个体化医学的新时代,这些药物“虽然在人体上有惊人的反应,但药物不能治愈”。除了罕见的病例外,“靶向药会在一段时间内有效,然后大约在用药后九个月至两年之间,患者会产生抗药性。
Greaves博士和Swanton博士等人发现的肿瘤多样性解释了靶向药耐药的原因。一种药物可能会成功地消除绝大多数肿瘤细胞,但即便只有几个幸存细胞含有可以抵抗这些药物的突变,它们就会重新生长。
癌症围绕着药物进化,然后肿瘤复发
。更糟糕的是,肿瘤具有多样性,所以靶向治疗只会打击整个肿瘤的一部分,而带有跟靶向药机理不同的遗传信息的癌细胞病灶会活下来,它们会重新生长成新的肿瘤。靶向治疗是强大的,
但
癌症有很多靶心,在受攻击的任何时候都会移动位置
。
▲
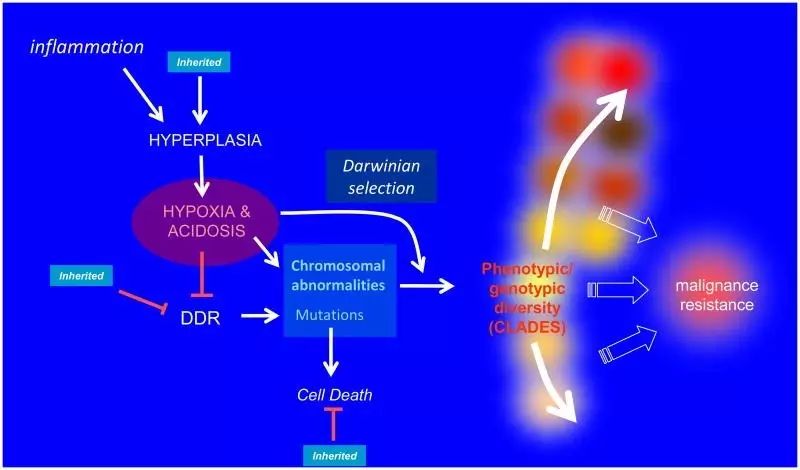
炎性导致的增生环境下,缺氧(Hypoxia),酸中毒(Acidosis)提供有力的进化选择,增加基因组不稳定性。基因组不稳定性与达尔文选择的结合加速了进化速率,导致肿瘤内不同进化分支的生长,产生的新生肿瘤的基因型/表型多样性导致恶性肿瘤,并且在治疗压力下产生抗性(图片来源:参考资料[7])
意大利都灵大学(University of Torino)肿瘤学家Alberto Bardelli博士说:“这种认识使我改变了观念。”不要追踪特定的癌症基因,“我们需要
追踪肿瘤的发展
——它们随着时间的推移如何变化,才能够抢占先机。”
首先,了解癌症的进化过程可以帮助研究人员选择正确的目标。一些突变在肿瘤的生命早期发生,并且在肿瘤的所有细胞中存在——称为
主干突变
(trunk mutation),另外的突变发生在后期,只在某些肿瘤部位存在——称为
分支突变
(branch mutation)。“
如果你要瞄准突变,就应该对准主干突变
,”Greaves博士说:“否则就像修剪树枝——只会刺激树木生长。”
格列卫
(Gleevec)是最成功的靶向疗法之一并非巧合,它针对的就是白血病的主干突变,这一突变几乎总是白血病的初期发生。格列卫能够攻击每个癌细胞,这就是为什么它疗效显著。

▲
靶向药物格列卫(Imatinib)治疗费城染色体阳性的
慢性粒细胞白血病(CML),
融合基因
Bcr-Abl
是病发的诱因
(图片来源:
National Cancer Institute
)
科学家们已经开始识别其他癌症类型中常见的主干突变。攻击这些突变肯定是一个更好的策略,而不是在分支突变中无效地进行攻击,但这依然没有改变肿瘤可以适应环境和重新生长的事实。更好的方法可能是
使用组合靶向药物
——一些药物攻击已经存在的突变,另一些则攻击那些有可能发生的突变。
比如,许多癌症都存在
EGFR
基因突变
,cetuximab(西妥昔单抗)药物就专门阻断该基因。但很多经过西妥昔单抗治疗后缩小的肿瘤总是反弹,原因是发生了第二个称为
MEK
的基因突变
。通过西妥昔单抗和MEK阻断药物联合用药,Alberto Bardelli博士设法成功地治疗了小鼠的肠癌(参考资料[6]),没有任何复发。他通过切断肿瘤通常的进化逃生路线阻止了复发,而不是简单的对付肿瘤。正如美国著名癌症中心H. Lee Moffitt Cancer Center的Robert Gatenby博士和他的同事们曾经说过的,“
抗癌就像是下棋,而不是打地鼠
。”(参考资料[7])我们需要考虑全局走势。
但是Banerji博士也承认,他在小鼠中使用的方法在实践中不太可能发挥作用,因为联合用药的化学疗法毒副作用太大。可能会杀死肿瘤,但也会连累患者。他说:“我们已经研究了多种联合用药方法,试过了所有的组合。但这不能改变游戏规则。”
我们的对手是进化本身
——癌症进化是最危险的敌人,对人类每个进攻都有防守策略。”就像英国化学家Leslie Orgel博士就曾经说过的,“进化比人更聪明”。因此,与其阻止癌症不可避免的进化过程,改变它的进化方向也许更有效。
Banerji博士的同事Andrea Sottoriva博士说:“任何进化都要付出代价。人类通过直立行走解放了双手,代价是跑不过狮子。”同样,癌细胞抵抗药物的突变也可能会减慢其增生。
这意味着耐药细胞只能在药物存在下才会比对药物敏感的细胞更有生存优势
,而正常情况下它们的竞争力较弱。医生可以通过多次反复治疗来潜在地利用这个弱点。用一种药物攻击肿瘤,敏感细胞死亡,而耐药细胞开始生长。然后停止用药,让敏感细胞反弹。通过重复这个策略清除癌细胞。这种“
自适应疗法
”(adaptive therapy)的目标不是消灭肿瘤,而是让它保持平衡(参考资料[8])。Gatenby博士在小鼠乳腺癌中测试了这种疗法。通过不同的剂量方案,他设法控制小鼠肿瘤的生长,尽管经常在一次数周内都没有用药。
我们甚至有可能引诱癌症进入陷阱。当肿瘤适应于药物时,通常是少数细胞发展出耐药性并重新生长为癌症。
这意味着在某个时间点肿瘤会经历一个瓶颈
,从一个具有基因多样性的聚合物转变成一个具有单一基因的小球。如果这些癌细胞克隆都对第二种药物敏感,并且研究人员可以预测到这种敏感性,
那么他们就能找到药物提前布好陷阱,给肿瘤致命一击
。Banerji博士和Sottoriva博士都在测试这一策略,给癌细胞接连使用不同的药物,看看能否将多样性的肿瘤转变为对同一种药物敏感的单纯肿瘤。Sottoriva博士说:“如果我们能治好癌症,那简直太棒了。但是,
如果我们能使癌症控制成为一种慢性疾病,像艾滋病一样,这也能接受
。”
其他科学家正在研究进化过程本身。Swanton博士已经发现肾癌中存在
SETD2
主干基因突变,该基因有助于修复DNA损伤(参考资料[9])。“这样的基因有助于保持基因组的完整性,”他解释说。突变本身不直接导致癌症,但它会使细胞失去修复自身DNA错误的能力,导致更多的突变发生。换句话说,这些突变促进细胞更快进化。针对这类型突变研究疗法,可能会减慢癌症的进展。
即使像阿司匹林这样简单的药物也会这一招。我们已知
阿司匹林
可以降低结肠癌、食管癌和胰腺癌的风险。部分原因这可能是因为
它能对肿瘤的早期进化起到刹车作用
。亚利桑那州州立大学(Arizona State University)的Carlo Maley博士在巴雷斯特食道症(Barrett’s esophagus)患者进行了一项研究(这种疾病经常导致食管癌),发现没有服用阿司匹林的患者体内基因突变速度
增加13倍
。
“这项研究很小,只有13名患者,理想情况是在一大群人中确认,其中一半人随机给予阿司匹林,”Maley博士承认。但他补充说,在耐药性发生之前避免癌症有机会进化——这种预防癌症的观念是正确的。他说:“我们并不是想打败进化,而是要
管理进化
。癌症领域仍然以治疗为主,但我们应该着重于
预防癌症
。我们应该在问题变得棘手之前进行干预。”
肿瘤基因组越混乱,癌症就越有可能回来
不幸的是,Laura Brealey女士去年11月份离世。“她是个非常坚强的女性,也是TRACERx项目最热心的支持者之一。我们都很想念她。“Swanton博士说:“癌症仍然是一种可怕的疾病。尽管进行了所有这些研究,但是我们还没有得到想要的生存率。“作为一个医生,Swanton博士会为每一次对患者的治疗失败而流泪,但是他仍然心存希望。
患者贡献的疾病信息十分宝贵
,使医生在面对不断变化的对手(癌症)时获得更好的对策。
TRACERx项目研究终于迎来了第一个结果,最近同时发表了
两篇重量级研究结果
。在《New England Journal of Medicine》发表的论文针对842名入组患者的前100名(包括Brealey女士在内)进行研究,结果显示
每个肿瘤本身就是一个世界。
总共有
三分之一的突变属于分支突变
,仅限于肿瘤的特定部位。有些患者只有这些分支突变中的少数几个。一名患者携带了最多突变——2310个(参考资料[10])。
这些分支突变就像一本书中的单字拼写错误,但是该小组发现了更复杂的突变类型——染色体重排,相当于整个段落被重复,删除或重新排列。平均而言,这些大规模重排占了肿瘤基因组的一半,高突变率患者的复发率比低突变率患者
高出五倍
。曾在TRACERx工作多年的医学肿瘤学家Mariam Jamal-Hanjani博士说:“我们没有预料到,仅在前100名患者中我们就看到了跟临床有关的发现。”
肿瘤的基因组越混乱,癌症就越有可能回来。
Swanton博士说:“肺癌是一个非常复杂的疾病。它比我们在肾癌中看到的还有更多的不稳定性。”更糟糕的是,
这种不稳定性可能会改变肺癌的进化史
,使原本在癌症进化过程中保持稳定的
主干突变也会变化
。换句话说,随着肺癌的发展,主干突变可能会变成分支突变,这意味着对付主干突变也不能打倒肺癌。
仍然,Swanton博士还是看到了希望。他的团队发现,许多这些大规模重排是一系列称为APOBEC的酶引起的(参考资料[11])。这些酶通常参与免疫反应,但似乎在肺癌等几种类型的癌症中扮演流氓角色,提供了“癌症进化所需的致癌燃料”(参考资料[12])。即使在重度吸烟者中,APOBEC酶也比烟草烟雾中的化学物质导致更多的DNA突变。
全球正在开展多项靶向APOBEC酶来阻止癌症进化的研究
。
这样的努力可能需要很长时间才能结出结果,但接受癌症的进化观点
已经影响了临床医生的治疗决策。
医生通常在诊断肿瘤时对患者进行一次活检,然后根据该样本做出治疗决定,即便是复发也依赖诊断时的样本检测结果。
这就像使用过去十年的股票信息来指导明天的投资
。我们现在试图获得最新的和最能代表患者病情的信息。
但活检显然没法办到。因为随着时间的推移,多次获取患者肿瘤组织是不切实际的,而且需要从不同的肿瘤部位进行取样,才能确定肿瘤的多样性。
幸运的是,还有另一种选择
当癌细胞死亡时,它们的DNA片段会释放到宿主的血液中。这种DNA被称为循环肿瘤DNA(ctDNA)。作为一种“
液体活检
”手段,ctDNA能够全面反应肿瘤的实时状态,而不需要侵入性活检。针对许多癌种的研究已经显示,死亡癌细胞的这些自由漂浮的幽灵可以预示肿瘤大小、复发和耐药性等信息。
TRACERx项目发表的第二篇论文(参考资料[12])显示,
ctDNA也为肺癌提供了一种有益的看法
。在某些情况下,患者术后的ctDNA水平很快升高,表明尽管正在接受化疗,其肿瘤仍然在反弹。在其他情况下,ctDNA里会出现新的分支突变,表明肿瘤在CT扫描可见之前几个月就已经复发。ctDNA可以作为癌症实时演化的生物标志物,也可以用来评估治疗方案的效果。
但是,目前用于ctDNA测序的技术仍然太昂贵,不能在临床中普遍使用,而且检测
早期癌症
的灵敏度还不够高。ctDNA在多大程度上能代表肿瘤的整体情况也还不太清楚。但Swanton博士认为这些障碍可以克服。他说:“十年后,我们可以期待使用循环DNA持续监测肿瘤进展,并相应地调整治疗策略。”
五年前,Swanton博士患上的肾癌也曾让他感到悲观和不安。但是像他研究的疾病一样,他也挺过来了。“当我们第一次选择这条路时,我感到十分沮丧,但是也让我
看到了问题的另一面
。在过去的几年里,我变得很乐观。通过理解和拥抱复杂性,我们可以对付癌症。“
六年前,Swanton博士失去了他的祖父,因为一种发生于肺部或腹部组织的癌症——间皮瘤。Swanton博士说:“我没有一天不想念他(祖父)的时候。希望像我这样不得不面对自己父母或兄弟姐妹死于癌症的人,有一天会被医生告知‘这是一种40年前的疾病,现在我们可以治愈它。’
这就是我想看到的未来。
”

▲
45岁的Swanton教授领导团队发表了146篇有关癌症进化与遗传学的论文。最近两篇发表于《自然》和《NEJM》杂志上。(图片来源:Crick Institute)
参考资料:
[1] how to fight cancer when cancer fights back
[2] http://www.cruklungcentre.org/Research/TRACER]
[3] Genetic variegation of clonal architecture and propagating cells in leukemia
[4] Cancer therapy: an evolved approach
[5] How close are we to curing cancer?
[6] Vertical suppression of the EGFR pathway prevents onset of resistance in colorectal cancers
[7] Evolutionary dynamics of carcinogenesis and why targeted therapy does not work.
[8] Exploiting evolutionary principles to prolong tumor control in preclinical models of breast cancer.
[9] SETD2 loss-of-function promotes renal cancer branched evolution through replication stress and impaired DNA repair
[10] Tracking the Evolution of Non–Small-Cell Lung Cancer
[11] An APOBEC cytidine deaminase mutagenesis pattern is widespread in human cancers
[12] APOBEC enzymes: mutagenic fuel for cancer evolution and heterogeneity
[13] Phylogenetic ctDNA analysis depicts early stage lung cancer evolution
[14] Intratumor Heterogeneity and Branched Evolution Revealed by Multiregion Sequencing







