FDA 20210303培训-9:原料药设施--隐藏设施和关键中间体设施


原料药设施
-
建议在NDA/ANDA 356h表中包括DMF中的以下设施:
―
商业化产品处理过程中涉及的最终原料药生产、微粉、灭菌和检测场所(参见幻灯片12)
―
ICH Q7认定为中间体的场所
―
用于保存或储存原料药等待最终处置决策的场所,包括仅存放稳定性样品的场所
-
在DMF中需要但未放在NDA/ANDA356h表中的场所被称为隐藏设施



API的GMP要求
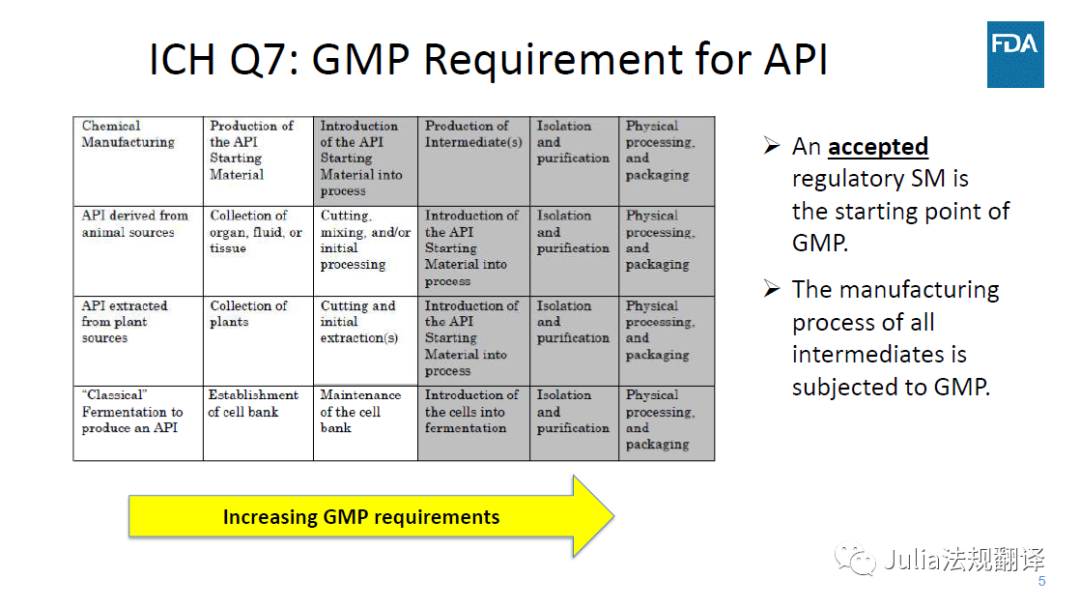
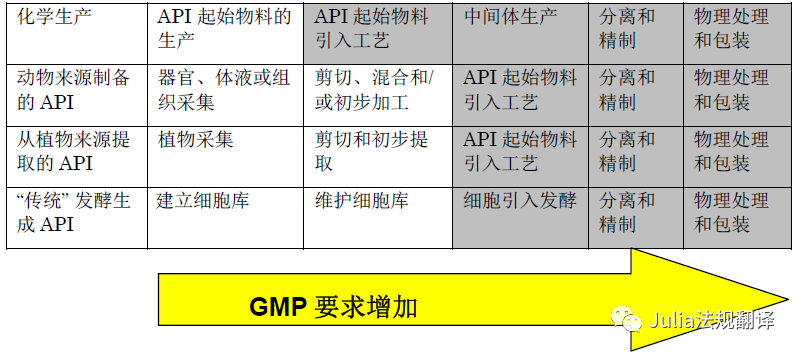
ICH Q7代表了FDA当前对API的GMP观点
ICH Q7:API的GMP要求
-
可接受
的注册起始物料(RSM)是GMP的起始点
-
所有中间体的生产均应符合GMP要求



如果发现隐藏设施,则会向A/NDA申报人发送以下建议:
有一个(多个)场所(例如原料药生产、中间体或放行/稳定性测试场所),列在DMF【一级DMF号】中
或
被DMF【一级DMF号】引用的DMF中,但未列在你们的申报资料中(例如FDA 356h表和/或3.2.S.2.1章节中)。
请注意FDA不能向你提供未列在你申报资料中的场所的状态。
请联系你的DMF持有人识别并解决此问题,并澄清哪个(些)DMF相关场所支持你的申报。我们建议将支持你们申报的DMF相关场所添加至你们的FDA 356h表格中和3.2.S.2.1章节中。
如果在你的申报资料中只引用DMF里面所列场所的一部分支持商业化生产和/或检测,则你的LOA应写明这些场所。
如果没有这些说明,则FDA会默认DMF中所列的所有场所均支持你的申报。请注意,如果在最后一轮申报审评中向DMF中添加任何场所,则可能会延迟目标日期。如果是单独提交增补,要求在申报资料中增加任何新场所,则要求提交新的增补和修订过的356h表。

如果发现隐藏设施,则会向A/NDA申报人发送以下建议(续)
有
一
个
(
多
个
)
场
所
(
例
如
原
料
药
生
产
、
中
间
体
或
放
行
/
稳
定
性
测
试
场
所
)
,
列
在
D
M
F
【
一
级
D
M
F
号
】
中
或
被
D
M
F
【
一
级
D
M
F
号
】
引
用
的
D
M
F
中
,
但
未
列
在
你
们
的
申
报
资
料
中
(
例
如
F
D
A
3
5
6
h
表
和
/
或
3
.
2
.
S
.
2
.
1
章
节
中
)
。
请注意FDA不能向你提供未列在你申报资料中的场所的状态。

如果发现隐藏设施,则会向
A/N
DA申报人发送以下建议(续)
有一个场所(例如原料药生产、中间体或放行/稳定性测试场所)……
请注意FDA不能向你提供未列在你申报资料中的场所的状态
……
如果在你的申报资料中只引用DMF里面所列场所的一部分支持商业化生产和/或检测,则你的LOA应写明这些场所。
-
在A/NDA 356h表中列出所有所需DMF设施。这样有助于:
―
申报审评流程
―
FDA与申报人之间对申报状态的沟通
-
如果DMF中的设施只有一部分被制剂申报资料引用,则应在LOA中写明是哪些设施
-
DMF设施是否列在制剂申报资料中不会改变一个设施是否需要全面评估的决定和/或可能导致申报资料批准的潜在障碍


企业要如何改进?
-
在DMF第S.2.1节中列出所有所需场所:
―
最终API生产和检测场所(见下一张幻灯)
―
执行ICH Q7中所述操作的中间体场所
―
用于存放或储存API等待处置决策的设施,包括仅存放稳定性样品的地方
-
在DMF中清楚写明各场所的职责
―
如果是中间体工厂,写明是哪个中间体
―
如果是检测场所,写明是哪项检测
-
早点
与NDA/ANDA申报人应所有需要的场所及其职责进行沟通
―
如果不在DMF LOA中清楚声明只使用特定的场所,FDA会认为DMF中列出的所有设施均适用于引用该DMF的NDA/ANDA

企业要如何改进?
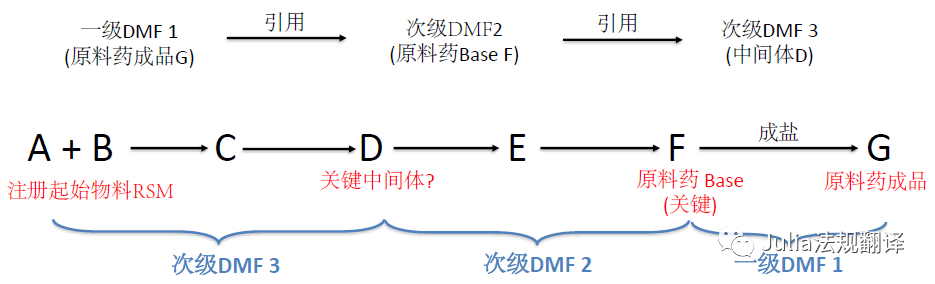
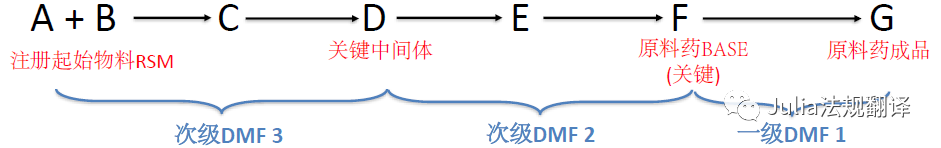
在DMF中的所需设施:

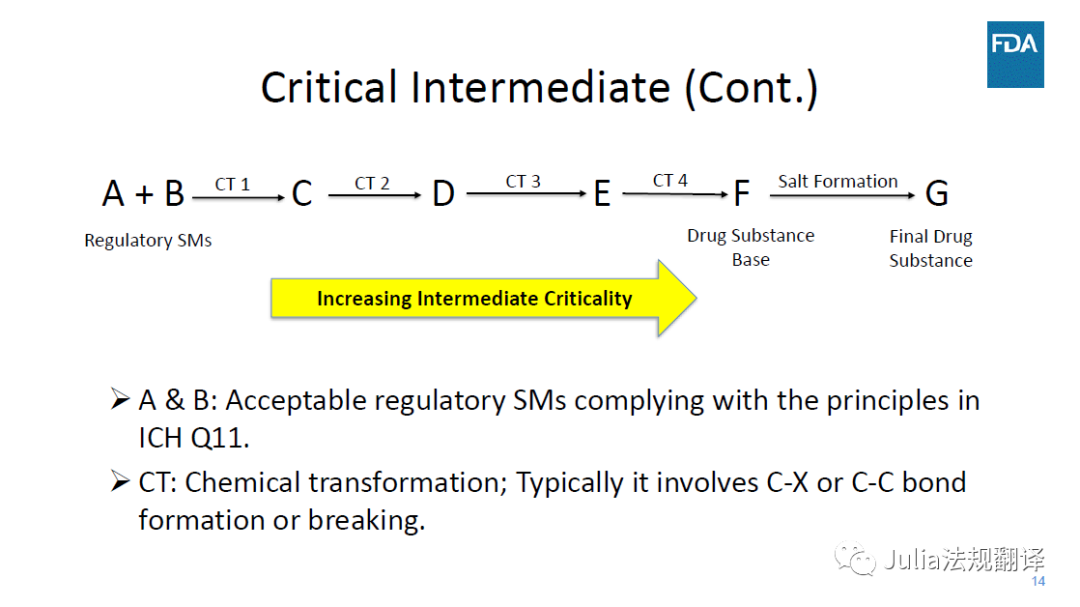
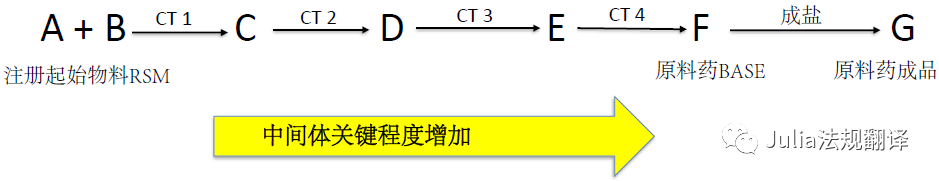
关键中间体
-
关键中间体的生产工艺对API成品质量特别重要,因此其生产场所需要成为引用该DMF的场所评估的一部分
-
此类决定是应用ICH Q11中所列原则及支持性数据各案做出的
-
DMF审评人员会基于API的生产工艺对中间体的关键程度给出建议,药品生产审评办公室则会决定是否需要对中间体场所进行综合评估
关键中间体(续)

关键中间体(续)

关键中间体(续)
关键中间体(续)
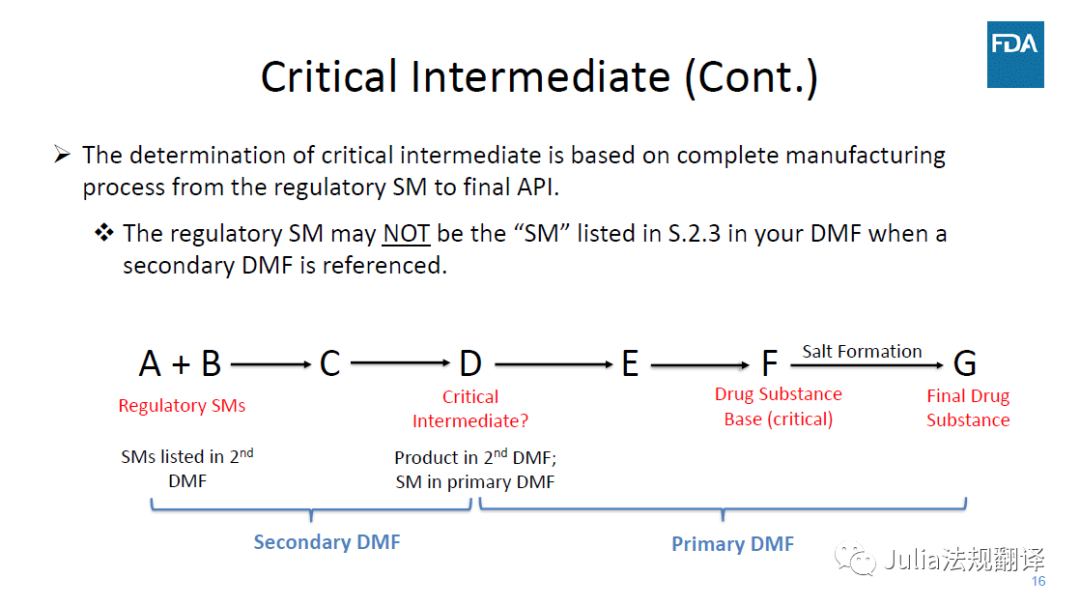
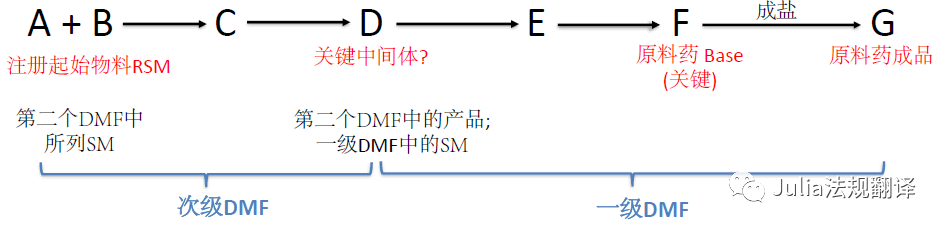
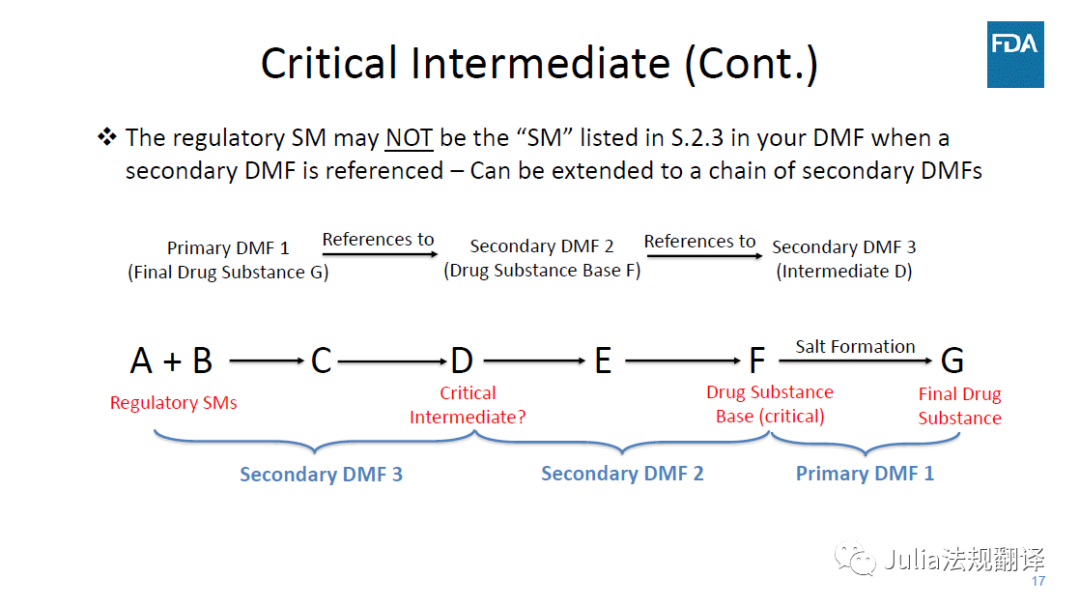
―
如果引用了次级DMF,
注册起始物料(RSM)可能
并不是
你DMF的S.2.3中所列的起始物料(SM)
―
―
可能会延伸至一个次级DMF链