继5月份上海科创中心张江核心区G蛋白偶联受体(GPCR)研究集群的多项重大科研成果集中亮相后,上海科技大学iHuman研究所的科研团队再获重大突破,成功解析了人源大麻素受体CB1(human Cannabinoid Receptor 1, CB1)与激动剂——四氢大麻酚(THC)类似物复合物的三维精细结构,揭示了大麻素受体在激动剂调控下的结构特征和激活机制。北京时间7月6日凌晨,该项成果以“Crystal structuresof agonist-bound human cannabinoid receptor CB1”为题在国际顶尖学术期刊《Nature》上发表,并作为重点文章推介。该研究是iHuman研究所继去年10月首次发表大麻素受体CB1与拮抗剂复合物的高分辨率三维结构之后的又一重大突破,是GPCR结构功能研究领域的又一项高水平、系统性的研究成果。
该项研究由iHuman研究所副所长、教授刘志杰课题组,创始所长、特聘教授Raymond Stevens课题组,iHuman研究所PI、生命学院助理教授赵素文课题组及其它合作单位共同完成。刘志杰、赵素文是论文的共同通讯作者,刘志杰课题组博士研究生华甜(与中科院生物物理研究所联合培养)是论文第一作者,上科大是第一完成单位。
GPCR是人体内最大的细胞膜表面受体家族,在细胞信号转导过程中发挥核心作用。GPCR也是药物研发领域的“宠儿”,目前有近40%的上市药物以GPCR为作用靶点。GPCR家族成员具有非常保守的七次跨膜螺旋结构,配体与受体结合后,通过跨膜区的构象变化,将信息传递到细胞内。配体的性质决定GPCR的状态:起激活作用的配体(激动剂)使受体活化,而起抑制作用的配体(拮抗剂)则抑制受体活性的发挥,受体与这两类配体结合后呈现的三维结构可以说是这个受体的“阴阳双面”。针对不同的GPCR,激动剂或拮抗剂配体具有不同的药物开发价值。
大麻素受体CB1是人体中枢神经系统表达量最高的GPCR之一,它对人的精神和情绪调节至关重要。去年10月,iHuman研究所团队率先在《Cell》上发表了人源大麻素受体CB1与拮抗剂小分子AM6538复合物的高分辨率三维结构,该结构揭示了CB1在非活化状态下的构象以及拮抗剂小分子与受体之间的作用模式,对设计更加特异、副作用更小的拮抗剂类药物,比如肥胖、及肥胖引起的代谢类疾病,肝纤维化及尼古丁成瘾等疾病,具有极大的促进作用。
大麻素受体CB1的激动剂在疼痛、炎症、多发性硬化症及神经退行性疾病等的治疗中有非常大的潜力,但激动剂小分子,例如大麻里的主要精神类成分THC,是如何与CB1相互作用以及受体的活化机制等尚不清楚。
目前已解析的GPCR三维结构中大部分是与拮抗剂配体的复合物,与激动剂结合的活化状态的GPCR构象非常活跃且不稳定,解析其复合物结构的难度相对较大。为获得大麻素受体CB1与激动剂复合物的三维结构,iHuman研究团队与美国东北大学的Makriyannis实验室合作,基于THC设计并筛选了一系列特异性高,结合力强的激动剂小分子。经过多轮蛋白纯化及结晶条件的筛选和优化后,成功解析了CB1与两种新型激动剂小分子AM11542和AM841的三维精细结构。该结构不仅揭示了激动剂小分子与CB1的相互作用模式,更重要的是,研究者发现,这与之前解析的CB1-拮抗剂小分子复合物结构相比,发生了很大的构象变化。其中结合口袋体积发生了53%的变化(激动剂的结合口袋体积:383埃3,拮抗剂的结合口袋体积:821埃3,1埃= 10-10米),受体的整体结构变化包括蛋白的N端以及七次跨膜螺旋的构象的显著变化(均方根偏差为3.5埃)是在以往解析的GPCR结构中变化最大的。这些结构特征也从分子水平解释了为什么大麻素受体CB1可以与多种不同类型的配体相互作用,参与和调控人体中多种非常重要的生理活动,同时也为今后针对GPCR的药物设计提供了新的思路。
该研究的另一重要发现是,首次从三维结构上观测到两个氨基酸(Phe2003.36/ Trp3566.48)在受体激活过程中的协同构象变化,相当于“双耦合开关”(twin toggle switch),这一协同变化效应可能与CB1的活化机制密切相关。此外,通过与iHuman研究所赵素文课题组及北京计算科学研究中心刘海广教授课题组合作,基于该晶体结构对不同类型CB1激动剂进行分子对接及动力学模拟分析,得到了不同配体的结合模式并进行了功能性实验验证。为设计针对CB1的激动剂类药物分子以及探究CB1受体的活化机制提供了非常重要的结构基础。
“掌握了CB1与激动剂和拮抗剂复合物的三维结构信息,或者说看清了这个受体的‘阴阳双面’,不仅对于内源性大麻素系统的功能机制研究极其重要,对一系列疾病,如炎症、疼痛和多发性硬化症等的药物研发有重要的指导意义。同时,由于大麻滥用及合法化等问题,该研究也有非常重要的社会价值。我们很高兴能取得了这个历史性突破”,刘志杰教授说。
值得一提的是,这也是博士研究生华甜继去年10月发表在《Cell》后,作为第一作者取得的第二项重大科研成果,“其实这项研究在去年向《Cell》投稿前后就开始了,是同步进行的,为了及时攻克CB1与激动剂复合物的晶体结构,我主动把博士毕业的时间延后了一年。”华甜说。华甜的导师、刘志杰教授表示,华甜的成功并不意外,她十分刻苦,几乎每天在实验室工作17个小时,春节只回家几天就匆匆赶回上海的实验室。
华甜表示,机遇和努力同样重要。“非常幸运来到上科大,”华甜说,“刘志杰老师和Stevens教授都非常关心鼓励我,在这里,我们经常和来自世界各地的专家学者分享交流,和国际一流的科研无缝衔接,我相信iHuman研究所是世界上最好的GPCR研究平台之一”。据悉,iHuman研究所每年举行人体细胞信号转导领域的学术年会,每周和中科院上海药物研究所、南加州大学等国内外合作单位一起召开远程国际组会,在该领域的学术影响力持续提升。
当被问及博士毕业后的打算时,华甜说:“我的志向是沿着从结构解析到药物研发的路径往前探索,研发基于GPCR的新型药物,为人类造福。毕业后我将留在iHuman研究所,借助上科大的优势研究资源和前期研究成果,立即启动药物研发课题,希望在最短的时间内获得具有高度专一性和无副作用的候选药物分子”。为抓住目前的良好发展势头,iHuman研究所与上科大免疫化学研究所等单位合作,已启动了多个针对重要疾病相关GPCR的药物研发项目。“iHuman研究所的愿景就是通过对人体细胞信号转导的基础和转化研究,发现治疗疾病的创新药物从而促进人类健康;同时通过高水平的科技创新,培养新一代的科技创业者。我们全力支持华甜启动基础科研成果的转化研究,帮助她实现用创新型药物回馈社会的志向”,刘志杰教授说。
该项研究由iHuman研究所联合美国东北大学、美国斯克利普斯研究所、美国南加州大学、北京计算科学研究中心和GPCR联盟等单位科研人员合作完成,同时获得了国家自然科学基金委、科技部及上海市政府的经费支持。
2016年4月15日,国务院发布上海科创中心建设方案,明确指出上科大在上海张江综合性国家科学中心建设中承担重要任务。目前,学校正与中科院上海分院科研院所等单位合作,负责或参与建设软X射线自由电子激光用户装置、活细胞结构和功能成像等线站工程、超强超短激光实验装置、上海光源二期线站工程,牵头硬X射线自由电子激光装置的规划和建设,并承担多项科创中心建设重点工作。截至2017年5月,学校的四个学院、两个研究所(包括iHuman研究所)已经建立了133个研究组,科研工作全面开展,人源大麻素受体三维结构解析这样的高水平科研成果正在不断涌现,这些科研突破也正是上海科创中心建设的重要成果之一。
论文链接:http://dx.doi.org/10.1038/nature23272
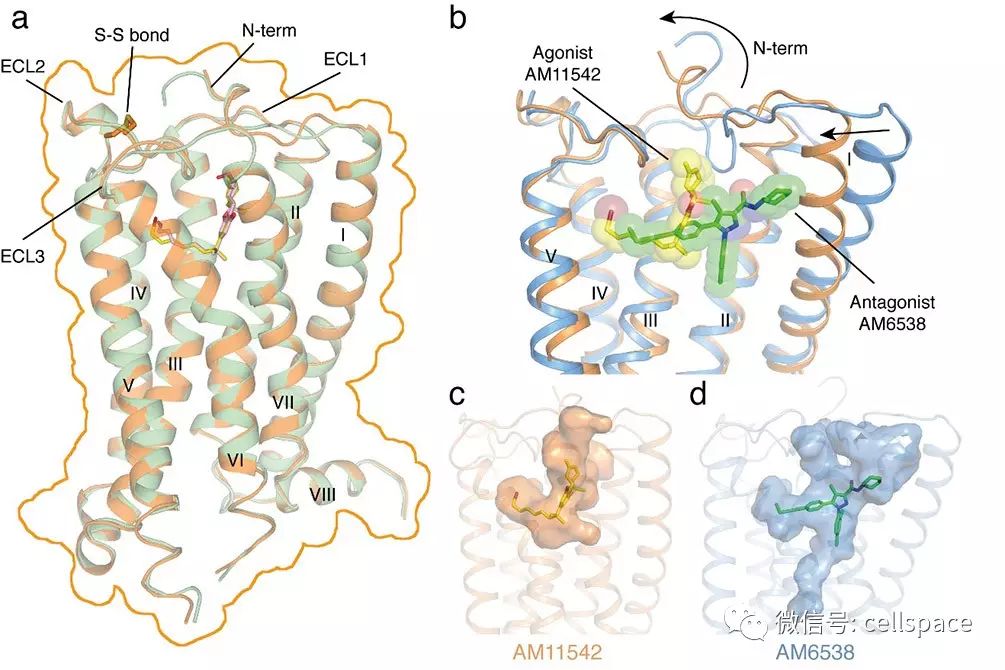
CB1与激动剂复合物的三维结构(a);激动剂与拮抗剂小分子结合方式及结合口袋比较
(b-d, 蓝色: 与拮抗剂AM6538结合的受体;橙色: 与激动剂AM11542结合的受体)

iHuman研究团队部分成员合影。从左至右:濮梦辰,吴屹然,刘志杰,华甜,Raymond Stevens,曲露,丁康

Cell:细胞治疗领域观察者
长按识别二维码,轻松关注















