▎药明康德/报道
昨晚,一条重磅新闻引起了医药圈内外的热烈关注——中共中央办公厅、国务院办公厅印发了《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,并发出通知,要求各地区各部门结合实际认真贯彻落实。

▲《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》是引发行业热议的重磅新闻(图片来源:央视)
《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》共计三十六条,分为六大板块:改革临床试验管理、加快上市审评审批、促进药品创新和仿制药发展、加强药品医疗器械全生命周期管理、提升技术支撑能力、以及加强组织实施。这些具体意见旨在“促进药品医疗器械产业结构调整和技术创新,提高产业竞争力,满足公众临床需要”。
最新出台的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》特别强调,要“加快临床急需药品医疗器械审评审批”,“鼓励新药和创新医疗器械研发,对国家科技重大专项和国家重点研发计划支持以及由国家临床医学研究中心开展临床试验并经中心管理部门认可的新药和创新医疗器械,给予优先审评审批”。同时,在新药的审评审批过程中,境外的临床试验数据也能被用于申报注册申请。
这些利国利民,务实与前瞻并举的重大国策有望进一步加快新药上市流程,满足中国广大老百姓的用药需求。众所周知,缺医少药是中国老百姓面临的严峻事实。2004-2014年内的数据表明,全球创新药物进入中国面临了严重的滞后问题。这段时间内,美国获批的291个新分子实体(NME)只有79个成功进入中国,比例不到30%。即便获批,这些新药也往往需要经历漫长的审批过程。以抗癌新药为例,中国患者往往需要等待超过5年,才能用上这些疗法。
▲创新药进入中国曾是一大难题(药明康德译自《Nature Reviews Drug Discovery》)
中国老百姓“用药难”的困境有望彻底成为过去。近年来,国家政策与国家食药监总局不断鼓励创新,并以一系列大刀阔斧的改革新政,加快新药从实验室走向临床,再走向获批上市。尽管这些新政可能还需要一段时间才能看到全面的成果,但短短两年内,我们已经看到了一些非常令人振奋的改变。
一项报告指出,自国家食药监总局在去年启动改革以来,积压的临床申请和注册申请数量已经从22000个锐减到8000个左右。高效之下,迎来的是诸多创新药物的加速上市。最近,诺华(Novartis)治疗心衰的创新药诺欣妥(Entresto)与Gilead的重磅丙肝新药索磷布韦片(Sovaldi)进入中国,将世界一流的创新药带到了患者身边。值得一提的是,前者距离欧美上市仅隔两年,一改重大新药滞后进入中国的面貌;后者更是被誉为“这一代人在公共卫生领域取得的最重要成就之一”,彻底改变了丙肝治疗的面貌,有望消灭这种传染病。2017年至今,我们还看到了Tagrisso以及Imbruvica等重磅新药获批上市的喜讯。一款款进入中国的新药,承载了无数患者家庭的希望!它们获批上市的速度,是改革之前所无法想象的。
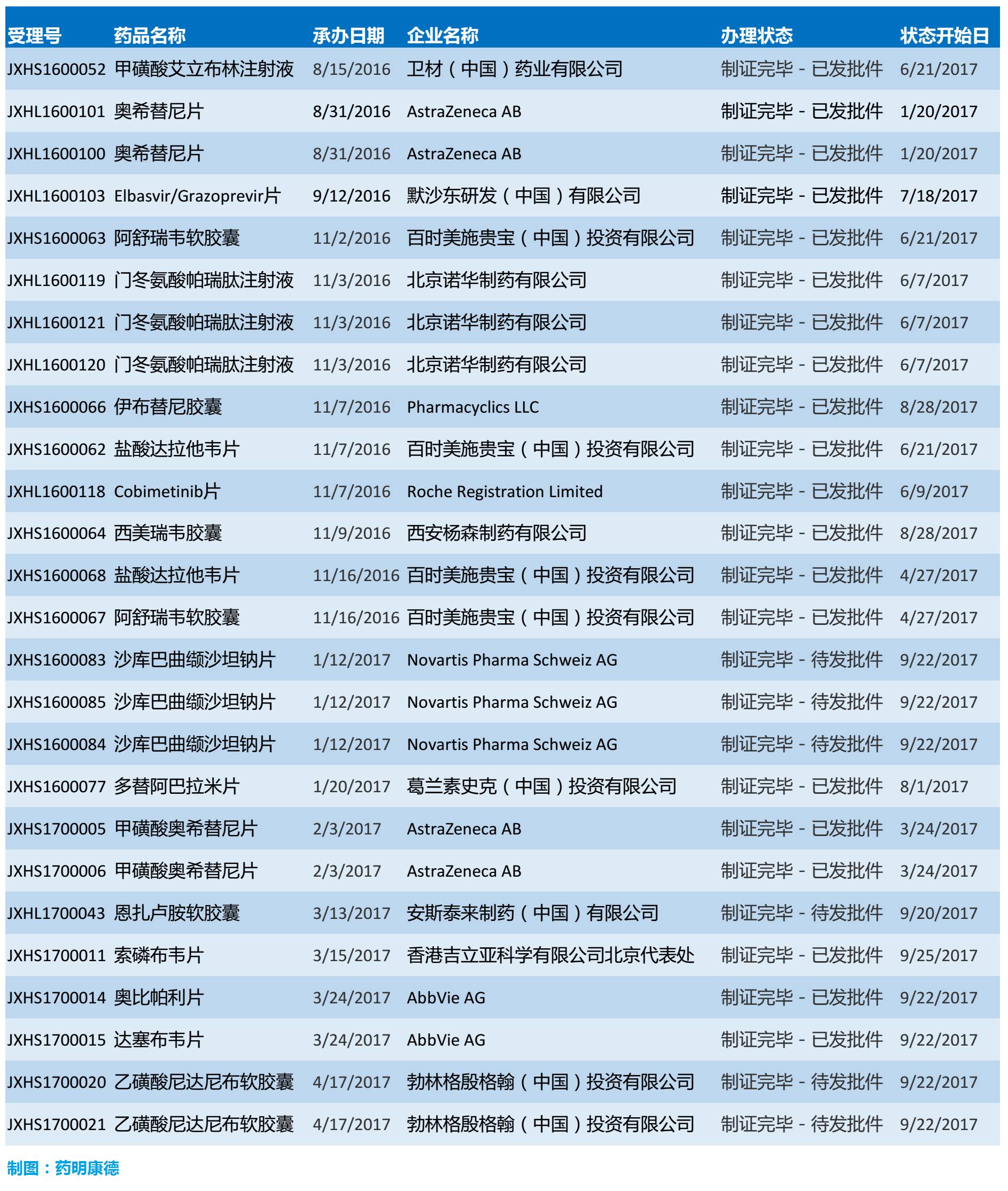
▲据不完全统计,2017年的短短几个月内已有诸多创新药进入中国
毫无疑问,中国医药行业正迎来又一个春天,一个生机勃勃的创新生态系统正在形成,中国创新正自信地走向世界舞台。对每一名医药人来说,这是最好的时代。
点击“阅读原文”,即可阅读《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》全文。

















