一看题目,言简意赅,外泌体是交通工具,EGFR是特务,他的任务是改变肝内的微环境,目标是促进胃癌肝转移,相信研究外泌体的各位一定跟小编一样有兴趣往下看吧。
值得提一句的是,文章以Stephen Paget的种子土壤学说为出发点,引入了定向转移的基本概念。我们不妨先来一波意识流,回顾一下这跨世纪的学说吧:近代西医病理学之父Paget过分析乳腺癌患者的尸解数据,在1889年提出了著名的关于肿瘤生长的“种子与土壤”学说,特定的肿瘤细胞(种子)倾向于转移到特定的器官(土壤),只有土壤适合种子时才会生长,成功发生转移。1928年 James Ewing指出转移是一些物理机制影响的,比如解剖位置和血液循环。这些无疑会影响转移,但是许多转移与靶器官的解剖位置、血流量并无明显关系(乳腺癌的骨转移,肾癌的甲状腺转移等),而血流丰富的脾、肾、肌肉却少有转移;有两项经典的实验也与此学说相悖:(1)B16 黑色素瘤转移实验:在注射了标记的黑色素瘤细胞的小鼠体内,能观察到细胞进入了肺和肾,但仅肺中形成了转移灶;(2)用于减轻卵巢癌恶性腹水的腹腔-静脉转流术:尽管数百万个肿瘤细胞进入循环,并没有发现肺转移(腹水回流经肺血管)率的升高。这说明对于转移,肿瘤细胞到达某个器官组织是远远不够的,还需要肿瘤细胞(种子)和器官微环境(土壤)协调,在合适的环境(土壤)下才能种植生长,成为转移灶(部分内容引自马齐襄等《肿瘤转移的种子与土壤学说新认识》)。
在进入正文以前,让我们先来熟悉一下文中经常出现的缩写单词吧:
1.EGFR:表皮生长因子
2.HGF:肝细胞生长因子
3.C-MET:HGF受体
4.GC:胃癌
5.sr-exosomes:血清中的外泌体
图一、临床分析胃癌血清外泌体中的EGFR和HGF-cMET
这里作者选择从临床入手,向摆事实,讲现象,然后在向基础方向入手研究其中的机制,也是讲故事一个经典的叙事方法。
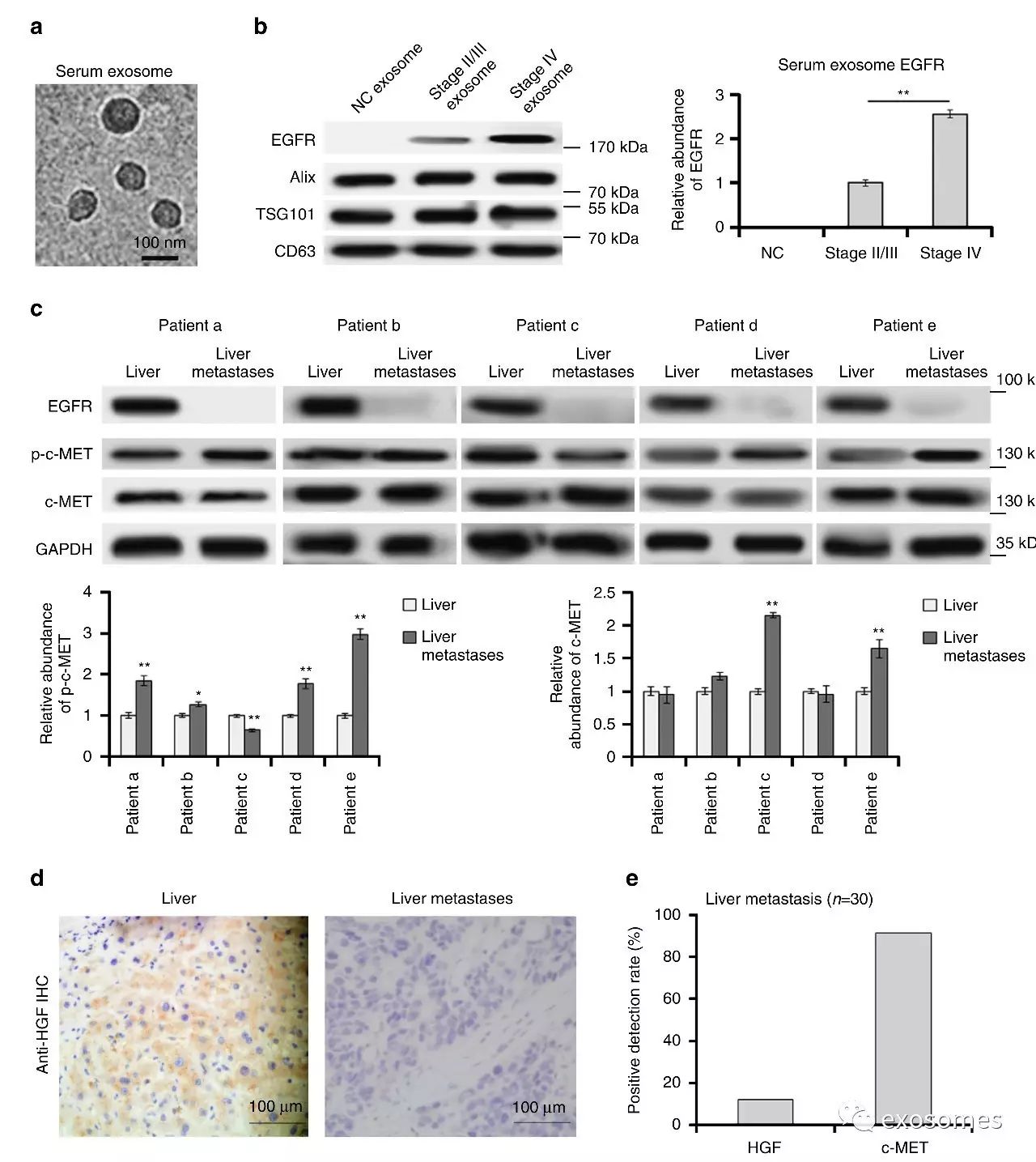
a.扫描电镜照片证实人血清中外泌体的存在。
b.随胃癌进展,外泌体中的EGFR含量也明显增加了。
c&d&e.收集临床5例患者标本,通过免疫组化(IHC)和WB证实转移癌中HGF-cMET表达增加。
图二、胃癌细胞的外泌体能传递EGFR给肝细胞
用临床数据引入故事,接下来就在细胞水平上先小试一波,也算是再次验证一下临床上的结论吧。
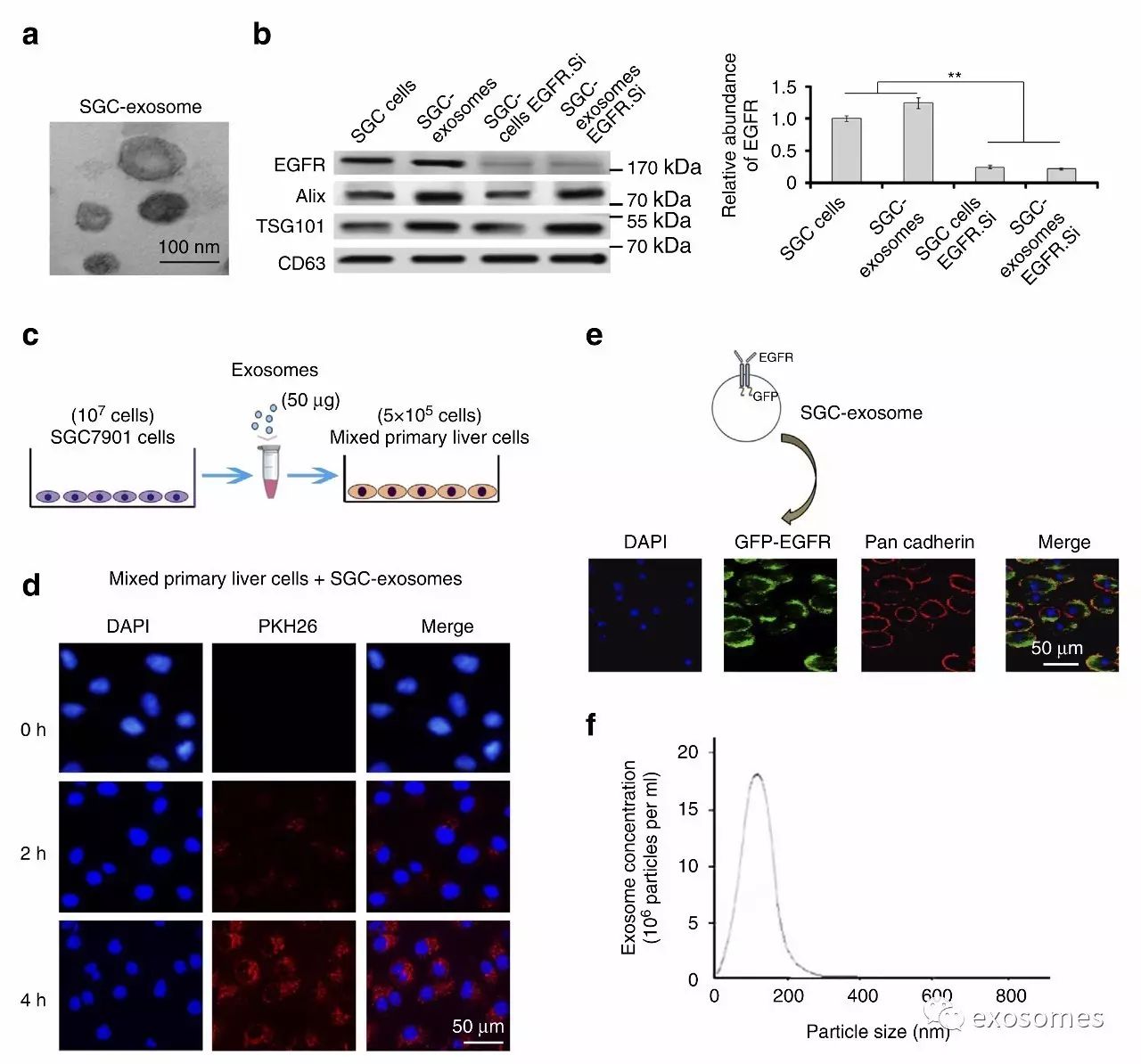
a&b.首先证实胃癌细胞SGC能分泌外泌体,而且其中含有EGFR。
c.作者设计了一个简单的实验,把SGC细胞培养液中的外泌体移到肝细胞培养基中,看看外泌体能不能跟肝细胞结合。
d&e.这里应用了荧光图,可以看到外泌体确实跟肝细胞结合了,猜想得到验证。
f.最后作者还不忘用一下纳米粒子定位系统(NTA)再秀一下分离出的外泌体的大小和浓度。
图三、原代肝细胞中基质细胞的变化
都说了外泌体会和肝细胞结合,那结合了以后有什么效果?
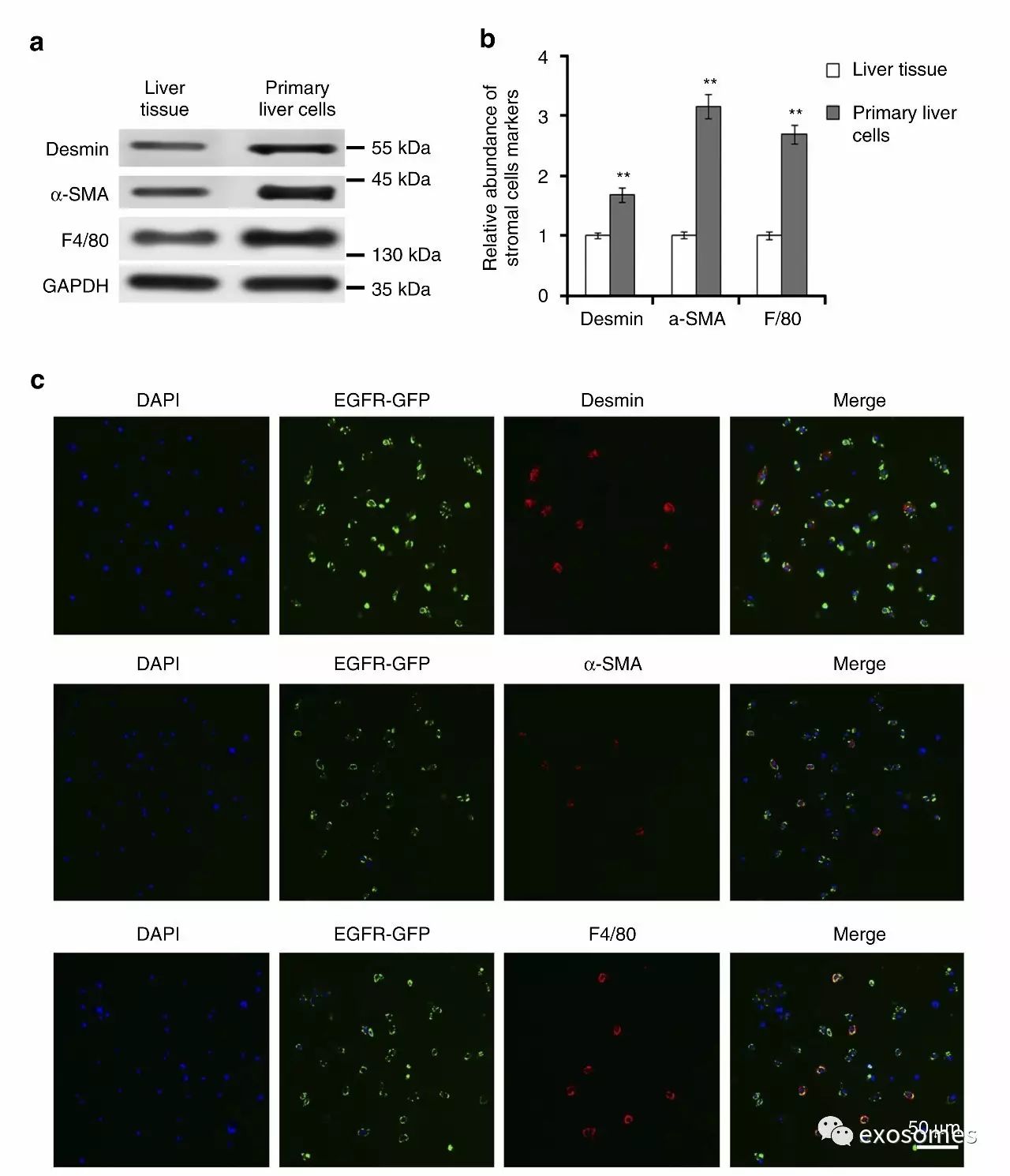
a&b.针对基质细胞表达位点的WB证实转移灶内的肝基质细胞增加了。
c.作者用荧光成像再次验证一下WB的结论。
接着作者就要进入正题,探究其中的机制了。
图四、胃癌外泌体的EGFR通过抑制miR-26a/b促进了肝HGF的表达
不得不说microRNA是个万精油,迄今为止关于某某microRNA与肿瘤关系的文章真的是太多太多了。

a&b.作者把胃癌细胞分泌的外泌体与肝细胞共培养,结果发现外泌体中的EGFR果然与肝细胞的HGF表达有关。
c&d.EGFR能够促进HGF的表达。
e.图示miR与HGF的结合位点
f&g&h.这里作者分两步走,先说miR-26a/b与HGF表达有关,再说EGFR与miR-26a/b有关,就把通路给说通了。
图五、明确HGF是miR-26a/b的直接靶点
图4是提到了miR-26a/b作用于HGF,为了论证的严瑾还是应该拎出一幅图专门讨论它们的关系。
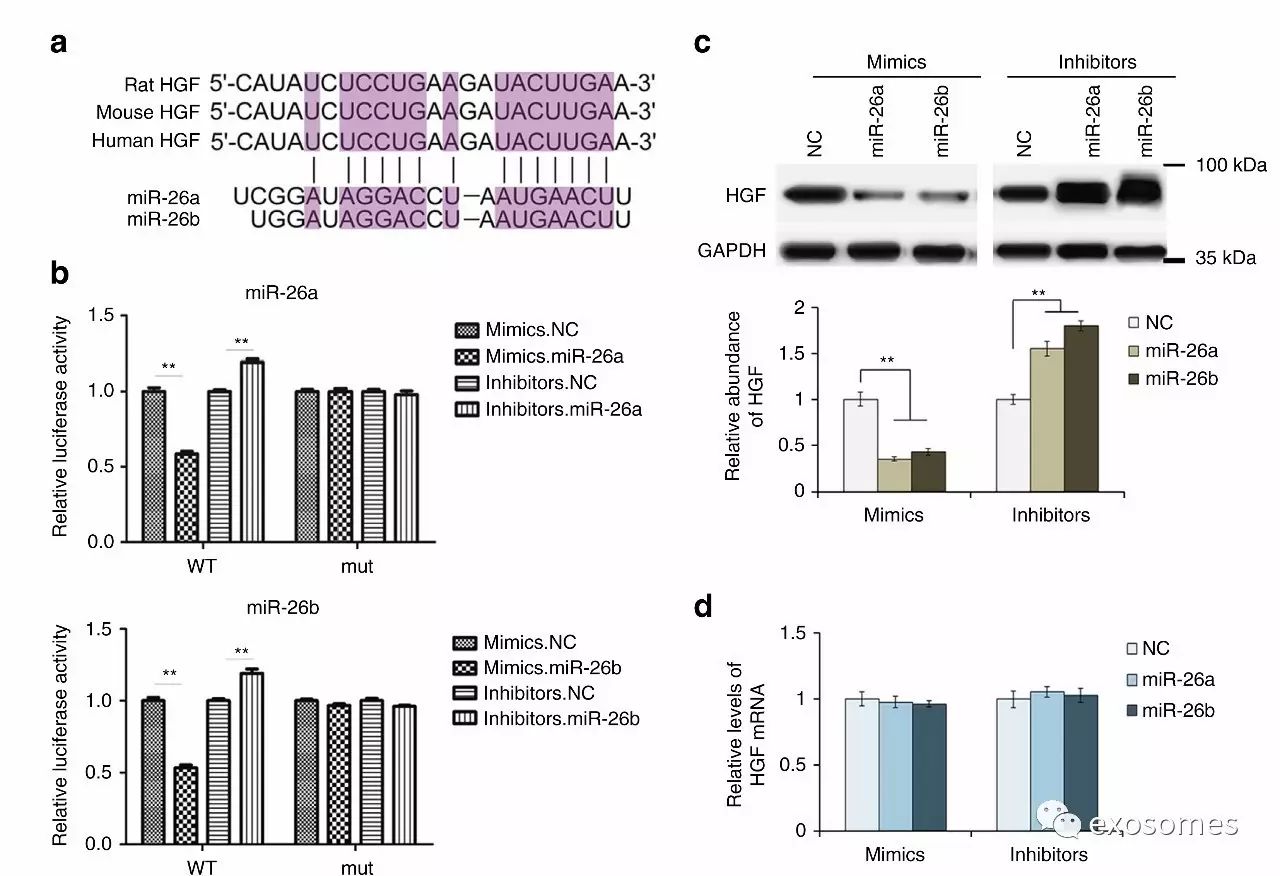
a.先比对一下基因,说明有相互结合的理论基础。
b&c&d.通过检测荧光强度(qRT-PCR)和蛋白浓度(WB),可以得出miR-26a/b对HGF其抑制作用,而且作用位点在mRNA修饰水平。
图六、来自肝细胞高水平旁分泌的HGF促进了SGC细胞的活性和侵袭性
既然HGF都高表达了,那它到底有什么用呢?
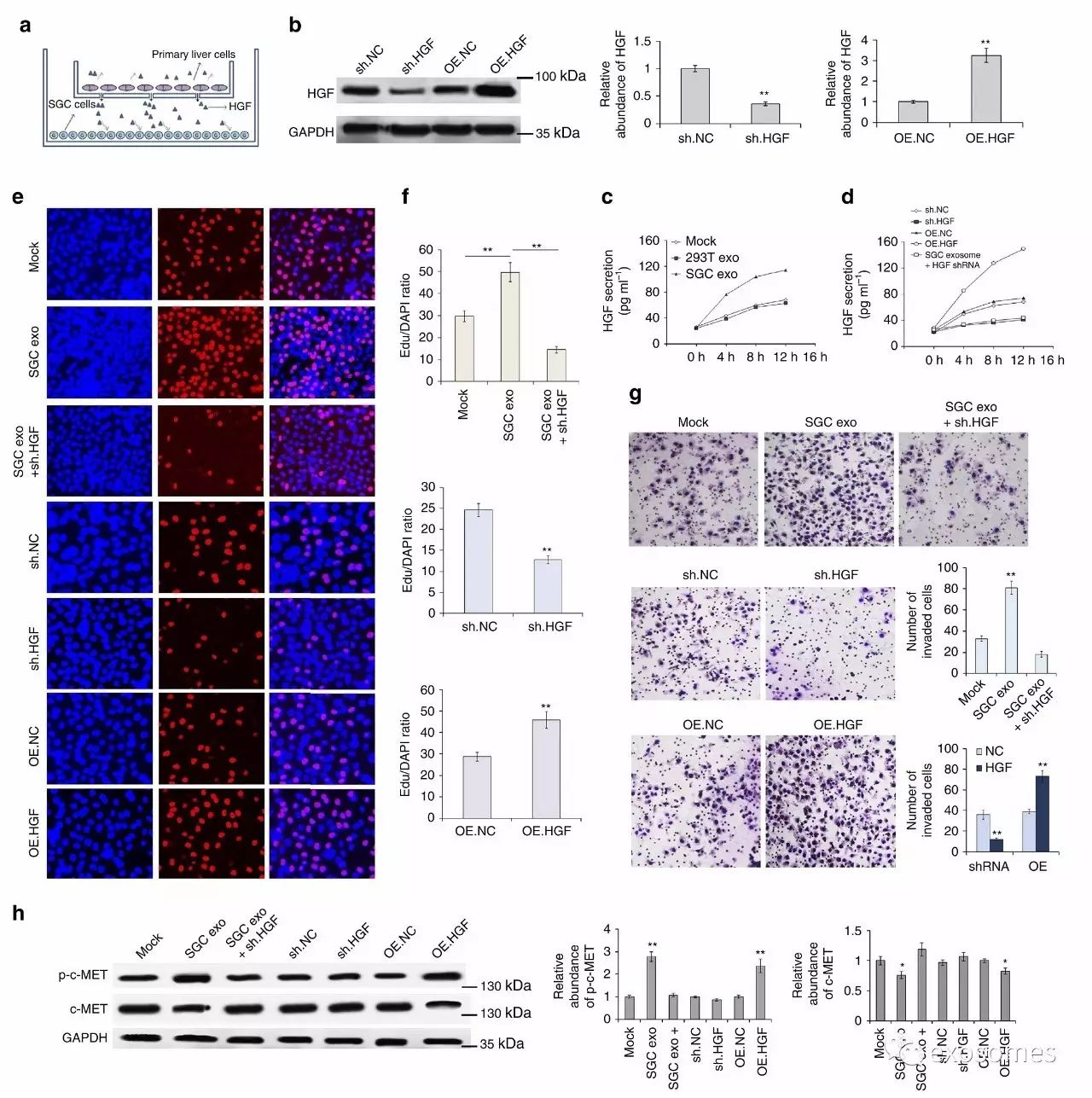
a.作者利用Tranwell小室模型构建了肝细胞和SGC共培养的环境。
b&c&d.利用shRNA和OERNA构建HGF低表达和高表达模型。
e&f&g.然后就可以正大光明的验证HGF会使SGC细胞活性和侵袭能力增强了。
h.因为能然c-MET磷酸化(有功能)增加嘛。
图七、体内实验证明外泌体分泌EGFR通过抑制miR-26a/b使得肝HGF增加
做完细胞(体外)做动物(体内)呗,提高论证水平,这下临床、细胞、动物可算是集齐了。
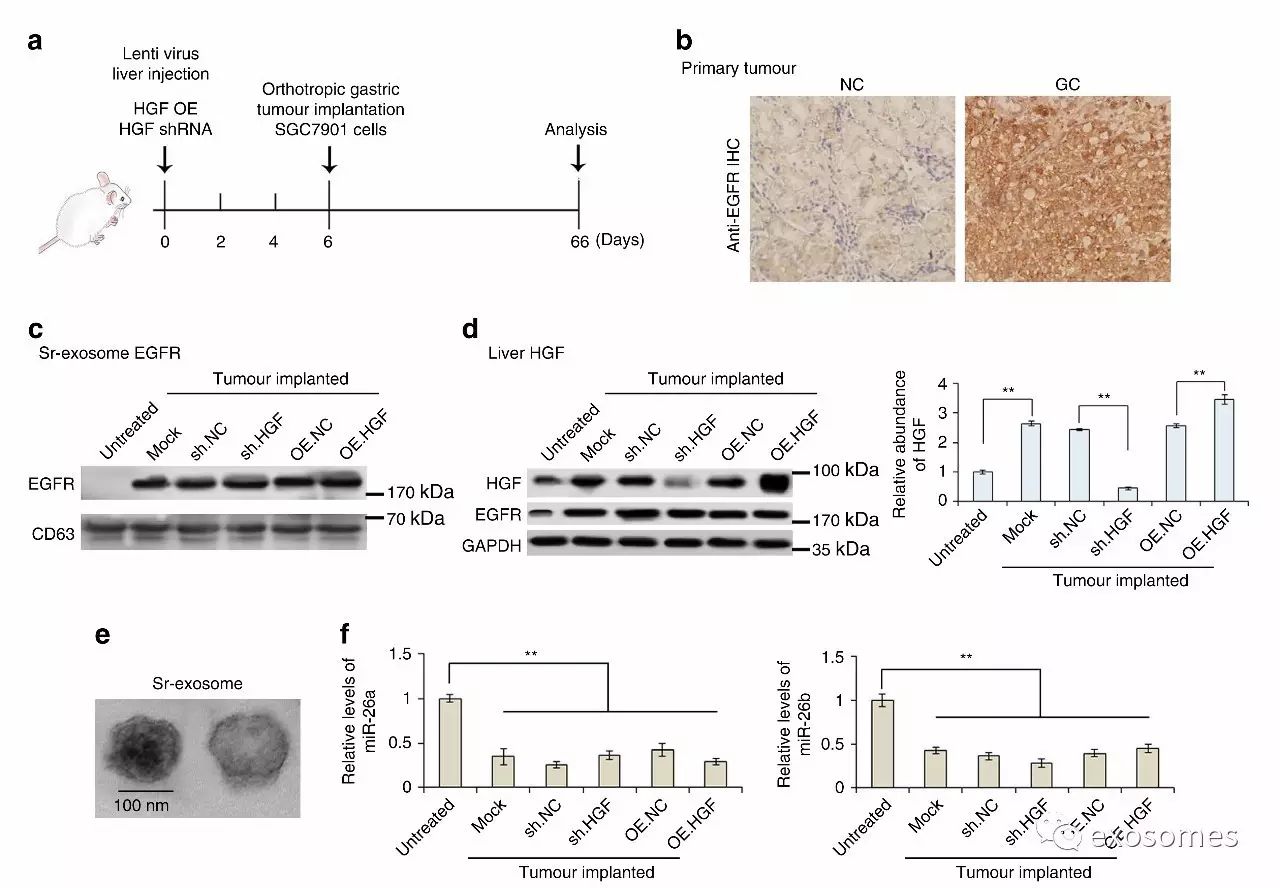
a.作者是这么做的:先向小鼠肝内注射慢病毒包装的shRNA或者OERNA使HGF表达异常,再注射SGC肿瘤细胞,两个月后分析结果。
e.首先把血清外泌体提取出来。
b&c&d&f.然后证明肿瘤组织中EGFR高表达;因为肿瘤种植所以外泌体中EGFR含量上升;肝内HGF也随之高表达了,慢病毒sh-HGF可以抑制其表达;EGFR跟着肝内高表达;也使得miR-26a/b表达明显受到抑制。
图八、高表达的HGF对于肿瘤肝转移的作用
讲到这一点,故事也算是接近尾声了。
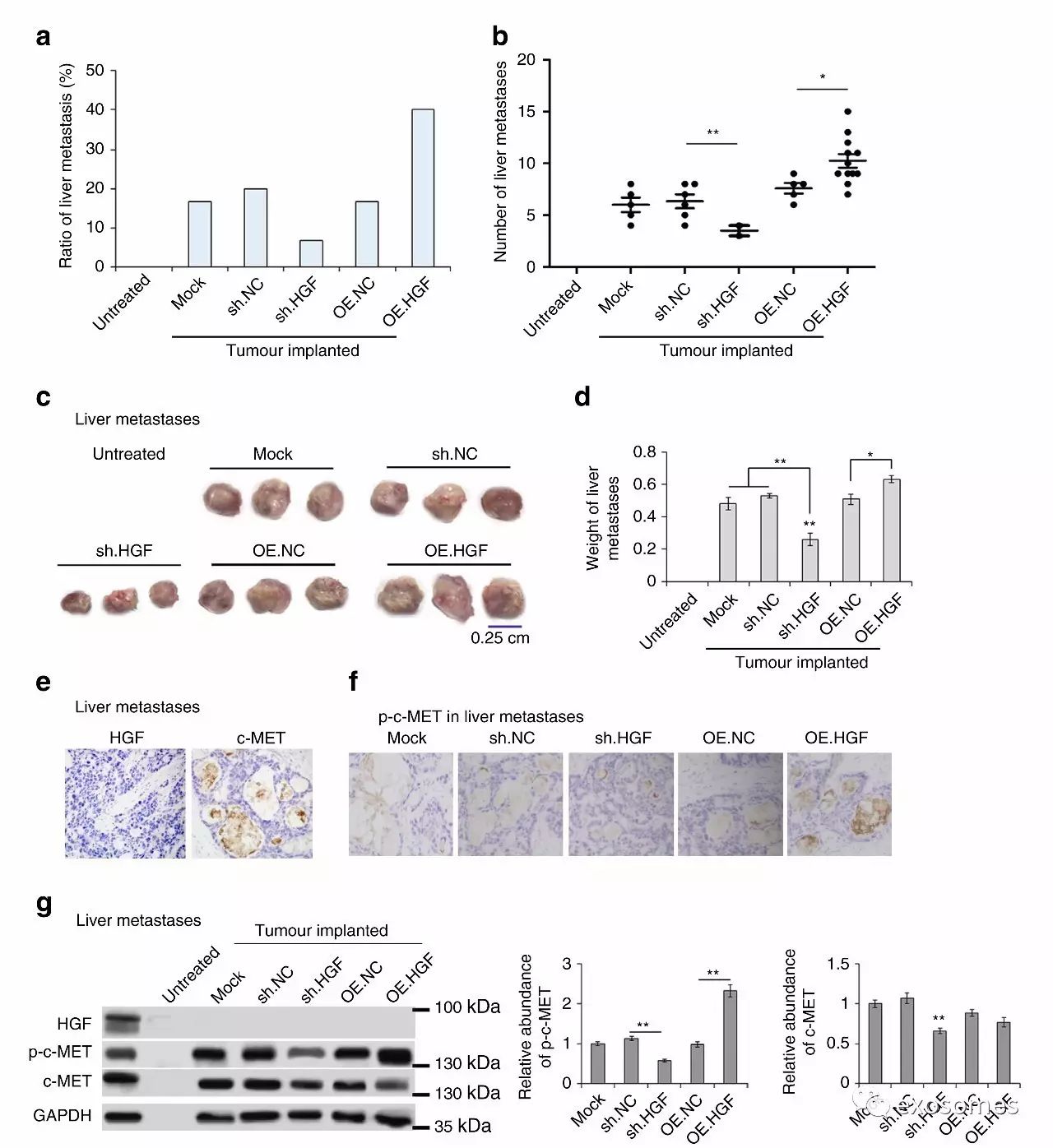
a&b&c&d.高表达HGF使得肿瘤肝内转移灶比例增加、数量增加、体积增大、重量增加。
e.&f&g一波免疫组化和WB说明下游c-MET磷酸化增加,肿瘤的微环境可算是形成了。

-----全剧终,上影评-----
看完文章,小编印象最深的还是作者这极其实用也很平民化的实验设计思路啊。
都说高分文章的实验思路高大上,看着实验模拟图里弯来弯去的箭头就觉得作者好厉害,但是这篇文章向我们证明,只要故事新、只要讲得好,老三样(临床-细胞-动物)照样能发高分文章。整篇文章里哪个实验你实验室里做不了,应该没有吧。这样一篇堪称教材的文章,就值得我们好好研究,对着自己的实验看看还有啥可以借鉴一下的。