做PCR,可以通过增加引物长度、提高退火温度与添加甜菜碱等方法来增加特异扩增的比例。然而这些都是在 PCR 反应管儿里面做文章。其实还有一种方法——可以通过调整PCR程序,来实现特异扩增比例增加,将非特异扩增比例降低甚至不可检测。
变性温度降温至退火温度时,大家一般都能听见 PCR 仪呼呼呼的风扇降温的声音。我想大部分小伙伴使用的都是默认降温速度,温度迅速下降。
诚然,一般 PCR 反应,使用默认降温速度是可以满足需求的。然而,对于序列复杂,相似程度高,GC 含量高,乃至三核苷酸串联重复多,此种类型的模板,本胖儿的建议是,将变性到退火这一段的降温速度,调整到5秒一度,乃至更慢。
为啥这么做?
引物与模板的结合,是错配以恒定概率发生的事件,并且,结合与解离过程是同时发生的。温度降低的快,引物与模板结合的就快,解离的慢,因此发生的错配就容易被固定下来。温度降低的慢,引物与模板结合的慢,解离也在慢慢发生,引物与模板就能够“逐渐磨合”到一个空间位阻最低的相互结合的位置,就是最佳的匹配结合位置。
打个比方:拉拉链比作延伸过程的话,慢慢拉一定比快快拉出错卡齿几率小,对不对!
当然,此法有一弊端,时间过久,例如,从98℃退火至65℃,降温速度为0.1℃/s,那么30个循环内,光是降温的时间就是30×(98-65)×10=9900秒=165分钟=2小时45分钟。
本胖儿热(年)情(幼)高(无)涨(知)的时候,就这么干瞪眼在实验室等过夜。。。

TouchDown 又称为降落 PCR。
原理是温度高时发生的特异性扩增多,温度低是发生的非特异扩增逐步增加。因此退火温度从高温到低温,随循环数逐步降低,最初循环中发生的主要是特异性扩增。后面随温度降低,即使非特异扩增与特异扩增以相同概率发生,但是由于起始循环中特异性扩增产物较多,后续扩增中,特异性扩增产物的积累速度也是远大于非特异扩增的。
例如一个 PCR 程序为30个循环,最初第一个循环中退火温度为65℃,每个循环降低0.5℃,那么程序后面循环的退火温度为64.5℃、64℃、63.5℃、…………52℃、51.5℃、51℃、50.5℃。
理想的扩增曲线如下图所示:
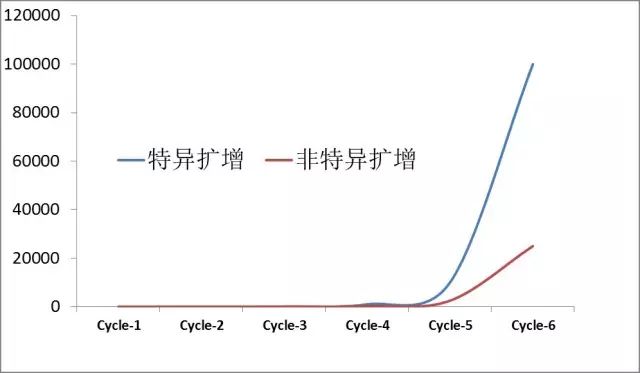
小技巧:退火温度设定范围建议是从(TM+5)℃ 逐步降温至(TM-5)℃。
不同厂家的 PCR 仪修改设置的界面不同,但都是可以进行修改的!
想实践的小伙伴,请开动脑筋,运用灵活的双手,自己去尝试一下!
这些内容,至今为止,我只传授给我的亲师妹王小博和亲师弟朱小博。
泥萌还怀疑我博士狗的身份吗?下面给泥萌看真身!
3……
2……
1……

不走寻常路,不P寻常R。
然而,
吉凯 cDNA 现货库的出现,基本让各位科研临床小伙伴告别了自己动手装载体的阶段。
扫描下方的二维码了,去吉凯基因手机端现货查询系统搜搜看,也许就有您直接可用的质粒。

又一个然而,
当然更有不花钱的办法:扫下面这个二维码,进入抽奖页面,9月5日前提交兴趣基因,有机会免费获得所需产品,包邮到天涯,包邮到海角!


















