小编今天为大家介绍一篇发表在
Phytomedicine(IF 7.9)
上的文章,该研究旨在通过网络药理学分析探讨中药积雪草苷(AS)对帕金森病(PD)的影响机制。
思路简单易懂,方法巧妙,仅仅5张图就可以冲7+!
在本研究中,作者首先通过使用Swiss靶点预测法、相似性组合法以及PharmMapper 数据库共预测了95个AS的潜在靶点,并成功通过Venny软件确定了17个与PD治疗相关的靶点。随后,作者基于网络药理学数据和体内外研究结果得出,
AS与NLRP3蛋白的NACHT结构域相互作用,从而阻碍NLRP3的组装,进而达到减少PD神经炎症的目的。

背景
帕金森病(PD)是一种神经退行性疾病,其特征是黑质(SN)和纹状体(STR)内多巴胺能神经元进行性变性,并伴有脑内路易小体积聚,导致运动功能障碍。越来越多的临床和实验研究证据表明,小胶质细胞介导的神经炎症在PD的发病机制中起着重要作用。积雪草苷(AS)是一种五环三萜皂甙,研究发现
AS可能通过突触重塑、恢复神经递质平衡、抑制细胞凋亡和减少炎症等机制来防止神经疾病造成的神经损伤。
然而,AS影响炎症相关性PD的具体机制尚不清楚。
随着高效液相色谱-质谱(UHPLC-MS/MS)技术的进步,以及提取和纯化系统和生物信息学的改进,越来越多的活性化合物已经从各种食品和传统草药中被鉴定和分离出来,同时,它们的药理活性和机制越来越多地被阐明。因此,在本研究中
作者通过网络药理学、体内外实验、分子对接、分子动力学模拟等研究方法对AS影响PD的作用机制进行了深入的探讨。
结果
1.
网络药理学预测AS对PD的作用靶点
AS的化学结构如图1A所示,作者通过Swiss靶点预测法、相似性组合法以及PharmMapper 数据库预测出AS的95个潜在靶点(图1B),将其与PD的1147个潜在靶点(图1C)
进行交叉确定出17个治疗靶点(图1D)。
为了分析这些靶点之间的相互作用,作者基于数据构建了一个由17个节点和49个边组成的PPI网络(图1E),发现主要靶标为NF-κB、TLR4、MAPK1以及NLRP3等。
随后作者通过GO以及KEGG富集分析发现AS可能通过多种信号通路影响PD,包括
NOD样受体、C型凝集素受体和IL-17信号通路(图1G)。
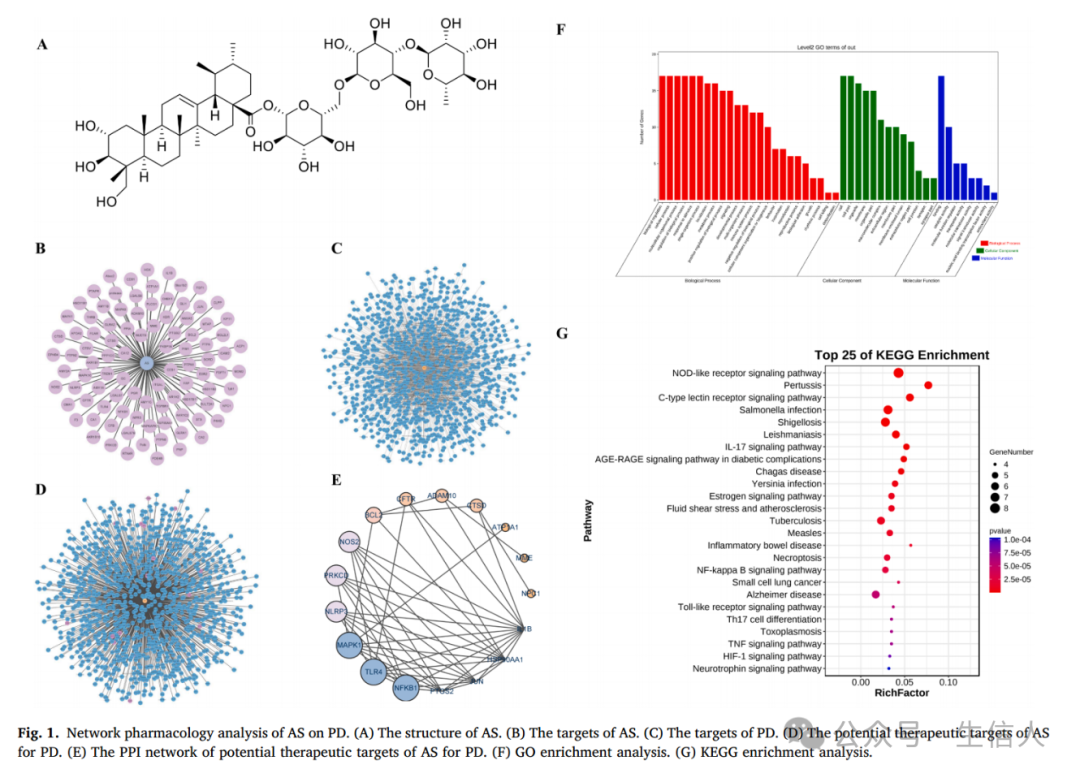
图1:AS对PD的网络药理学分析。
2.
AS可以改善MPTP诱发的PD小鼠的运动功能障碍
为评价AS对PD模型小鼠的神经保护作用,作者使用MPTP诱导的PD小鼠模型,采用旷场试验评价其运动功能(图2A)。结果显示,不同剂量的AS(10mg/kg; 60mg/kg)均可显著增加小鼠的运动距离和速度(图2B-C)。此外,经过AS处理的小鼠运动范围明显更大(图2D)。
总之,这些结果表明AS能有效逆转MPTP诱导的小鼠运动功能障碍。
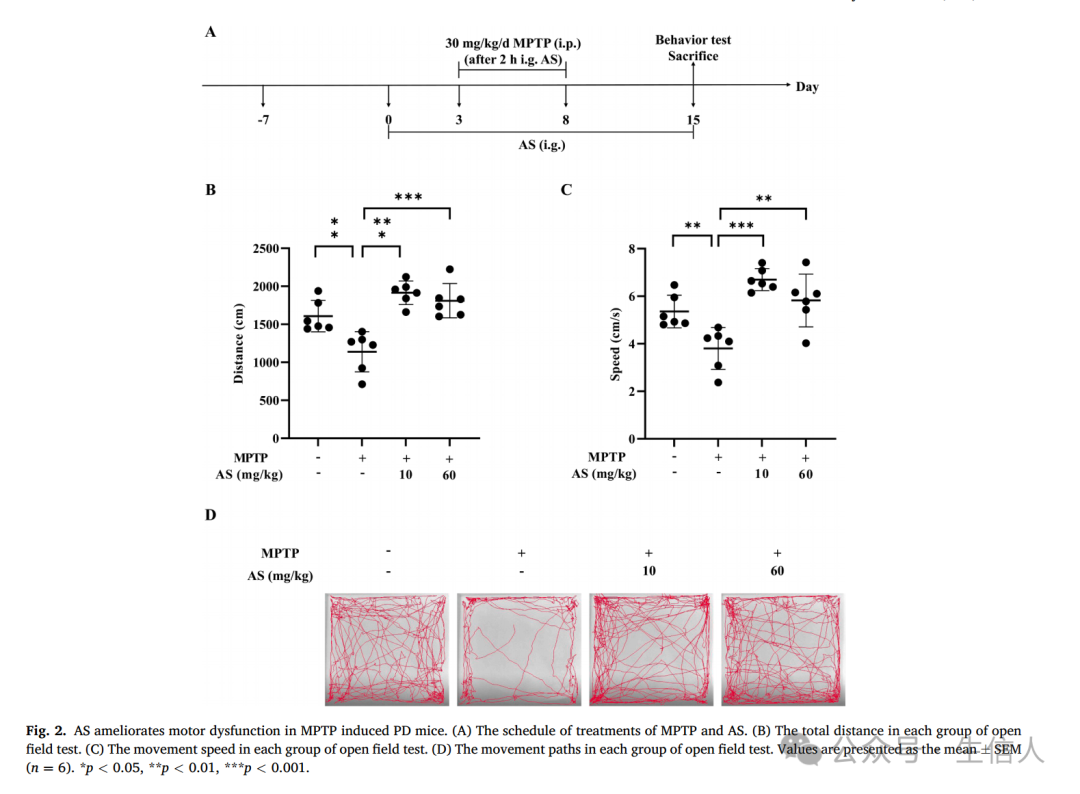
图2:AS可改善MPTP诱导的PD小鼠的运动功能障碍。
3.
AS减轻MPTP诱导的PD小鼠多巴胺能神经元的丧失以及体内炎性小体的激活
随后的分析显示,MPTP给药后,SN和STR的多巴胺能神经元数量显著减少,并且这种效应的特点是TH阳性神经元的损失,表明多巴胺能神经元损伤。而AS治疗可以减轻这些作用,主要表现在增加TH在STR和SN脑区中的表达(图3A,3B),增加TH阳性神经元的数量(图3D,3E)。此外,AS治疗还显著降低了SN的小胶质细胞激活和Iba1表达(图3C和F),突出了其在缓解PD神经炎症中的潜在作用。
随后,作者结合网络药理学分析,发现NOD样受体信号通路可能是AS治疗PD的关键靶点。为了验证这一假设,作者在体内研究了AS对NLRP3炎性体激活的调节作用。与对照组相比,MPTP给药显著上调了NLRP3、pro-IL-1β、p20和p17的表达,相反,AS处理明显抑制了p17和p20的表达(图3G)。此外,作者使用ELISA检测发现AS治疗显著降低了MPTP引起的SN中IL-1β水平升高(图3H)。
总之这些发现表明,AS对PD小鼠具有神经保护作用,并且主要是通过抑制NLRP3炎性体激活介导的神经炎症。
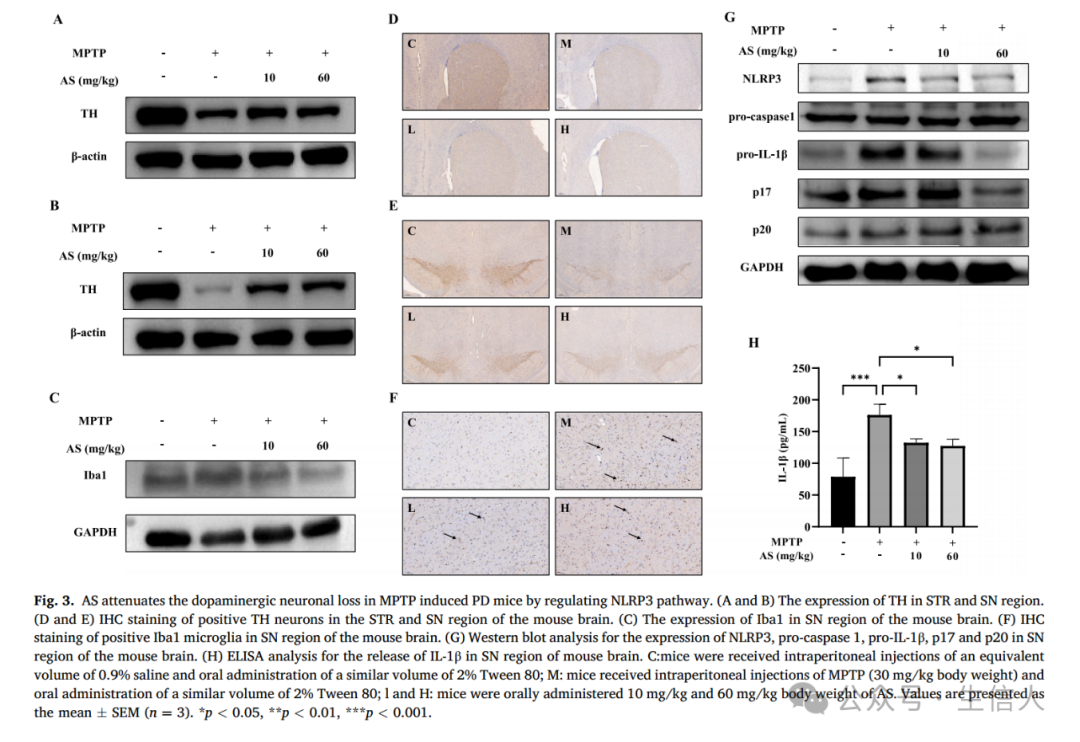
图3:AS通过调节NLRP3通路减轻MPTP诱导的PD小鼠多巴胺能神经元损失。
4.
AS可抑制小胶质细胞中NLRP3炎症体的激活
随后,作者为了验证AS对NLRP3炎症小体有直接活化作用,采用LPS结合ATP体外模型。BV2细胞用1 μg/ml LPS孵育3小时,随后用2.5 mM ATP孵育1小时,表现出明显的NLRP3炎性体活化,其特征是细胞中NLRP3和pro-IL-1β表达增加,上清中p17和p20水平升高(图4B)。值得注意的是,在LPS暴露前,用不同浓度的AS预处理BV2细胞1小时,可显著降低上清液中p17和p20的水平(图4B),
这表明AS抑制NLRP3炎性体的激活,减少细胞因子IL-1β的释放。
此外,作者发现AS治疗并没有降低NLRP3、前caspase 1和前IL-1β的表达(图4B)。因此,作者后续进行了RT-qPCR分析,结果显示AS不影响LPS诱导的
NLRP3
和
IL-1β
mRNA水平升高(图4C-D)。基于这些发现,作者假设AS可能通过直接结合NLRP3蛋白来抑制NLRP3炎性体的组装。这一假设得到了CETSA结果的支持,该结果表明,虽然温度升高会促进NLRP3蛋白的分解,但AS的存在减轻了这种降解(图4E)。
因此,作者得出结论,AS通过与NLRP3蛋白的直接相互作用阻碍NLRP3炎性体的激活。
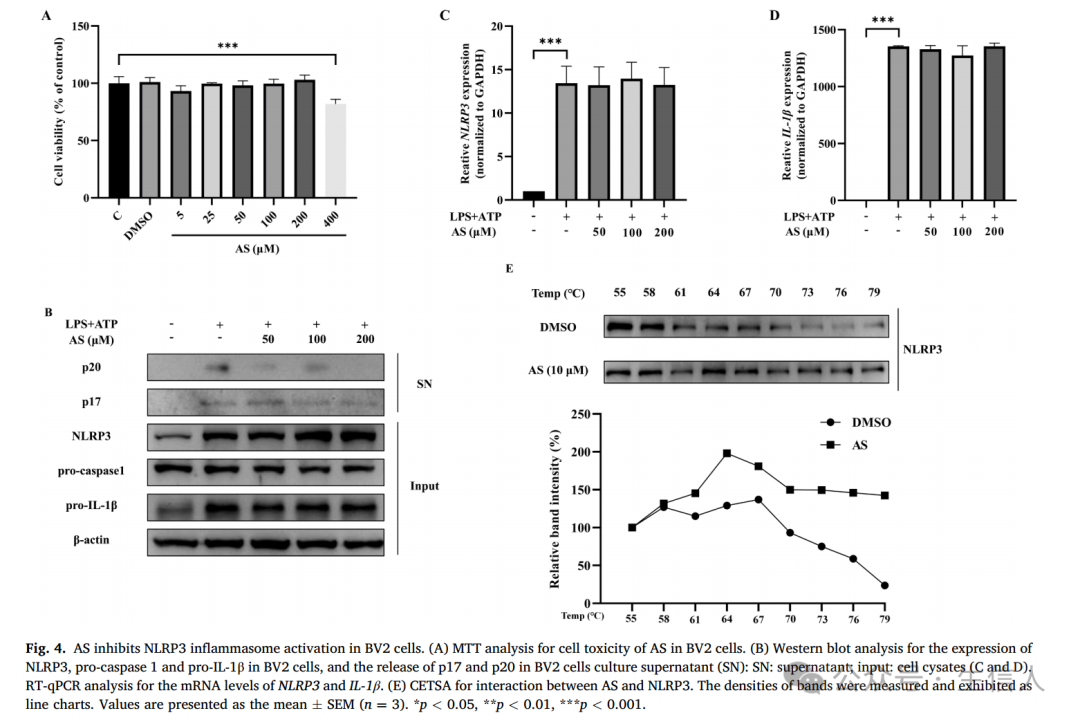 图4:AS抑制BV2细胞NLRP3炎性体活化
图4:AS抑制BV2细胞NLRP3炎性体活化
5.
分子对接和分子动力学研究
最后,为了进一步确认AS与NLRP3可能结合的模式,作者通过MOE软件分析可知,AS的Score值为-10.71Kcal/mol,最低RMSD值为1.75Å,
表明该化合物具有较高的亲和力
(理想值:Score≤-7Kcal/mol,RMSD值接近2Å,这两个数值常用作验证分子对接结果的标准)
。随后,作者利用整体对接图和三维相互作用图对综合体的对接图进行了详细分析。结果表明,
AD与NLRP3活性位点结合,氢键和疏水相互作用在结合过程中起主要作用
(图5A和B)。
为了探索蛋白质-配体复合物的稳定性和动态相互作用,作者通过MDs验证了对接模拟结果,并分析NLRP3在配体结合后的分子运动。对对接复合体进行100 ns模拟,
在此过程中温度、动能和势能保持稳定(图5E和F)。
从图5D可以看出,AS的RMSD在1.50 ~ 2.00 Å之间波动,而蛋白质的RMSD在2.50 ~ 3.00 Å之间波动,
在MD模拟过程中RMSD值波动较小,说明对接姿态是可靠的。
此外,为了确定参与NLRP3蛋白结合的关键氨基酸残基,作者随后对氨基酸残基进行了能量分解。图5C显示了能量贡献值低于-1 kcal/mol的氨基酸残基,
表明ARG578、PRO352和ALA228是结合自由能的主要贡献者。
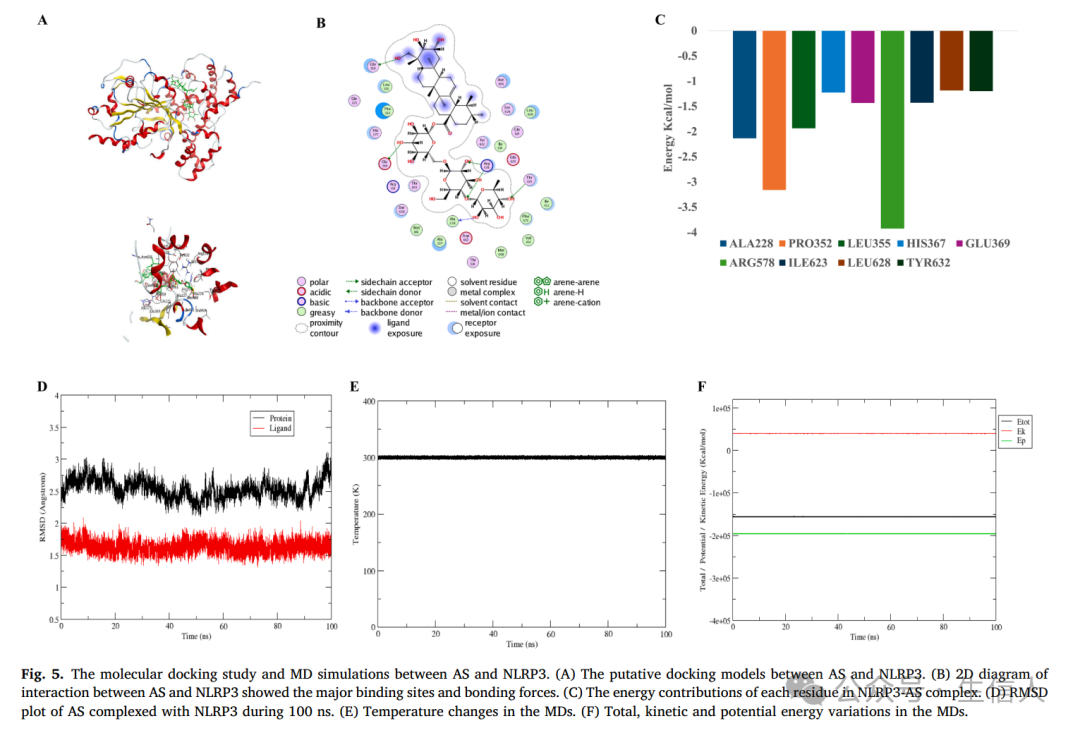
图5:AS与NLRP3的分子对接研究及MD模拟。
讨论
本研究通过网络药理学分析筛选出17个靶点作为AS对PD影响的潜在靶点,生物信息学分析发现了149条通路,其中NOD样受体信号通路在AS的潜在机制中最为重要。随后的体内和体外实验证实,AS与NLRP3蛋白的NACHT结构域相互作用,从而阻碍NLRP3的组装。此外,作者通过对接分析和MD模拟表明,
AS可能在ARG578、PRO352和ALA228位点与NLRP3的NACHT结构域结合发挥作用。与以往的研究相比,这是首次证明AS在PD中的神经保护机制,主要是通过抑制NLRP3炎性小体。
因此,靶向NLRP3蛋白的药物设计和发现将成为治疗帕金森病的有效策略。
在方法学上,本研究除了通过网络药理学对AS的作用靶点和相关通路进行锚定外,还巧妙地结合了分子对接、分子动力学研究。
分子对接与分子动力学技术可以深入地阐述分子间的相互作用,并可以形象地解释相互作用的机理,
特别是在药物开发中有着重要的应用,目前已经成为阐述生物学机理的重要研究方法。此外,上述两种方法还可以为
预测生物大分子复合物结合类型与相互作用模式提供重要的工具,
并为进一步试验提供有益的参考依据和理论支撑。
更多个性化方案设计
扫码领取

适合临床医生的科研方案





