作者 l
放翁是水货
编辑
l
细胞房间
Yuhan
和Sorrento公司联合开发的抗PD-L1新药IMC-001已完成I期临床研究
3月11日,韩国,ImmuneOncia公司今日对外宣布其已经完成IMC-001(全人源化抗PD-L1单克隆抗体)的I期临床研究。这项在首尔国立大学医院和三星医疗中心开展的研究主要招募了患有局部晚期或转移性实体肿瘤的受试者,旨在评估该药的安全性和最大耐受剂量,为后续的II期临床确定合适的给药剂量。根据该药的I期临床试验结果,IMC-001在受试者体内安全耐受,无剂量限制性毒性,也基于此积极结果,ImmuneOncia公司计划在II期临床中,评估其对于罕见癌症的疗效。
辉瑞的Herceptin生物类似药在美国获批
3月13日,美国,辉瑞公司今日宣布FDA已经批准TRAZIMERA™(曲妥珠单抗生物仿制药)上市,用于HER2阳性乳腺癌和HER2过表达转移性胃或胃食管连接腺癌的治疗。FDA的批准是基于对此前临床数据的审查,该数据证明了TRAZIMERA与原研产品之间有高度相似性,对于同类型患者的治疗无显著临床差异。
Alvotech公司的HUMIRA生物仿制药已开展III期临床对照研究
3月13日,以色列,Alvotech今天宣布其正在开展的HUMIRA生物仿制药AVT02的头对头III期临床研究已经有第一位患者入组接受治疗。该研究按计划将在欧洲30个中心招募400名受试者,目的是比较AVT02和HUMIRA®在中度至重度慢性斑块状银屑病成人患者的安全性,有效性,耐受性和免疫原性方面的作用。
小编点评:
HUMIRA®是治疗多种自身免疫性疾病的主要药物,其在2018年的销售额约为200亿美元,成为全球销量最大的重磅炸弹药。不同于其他仿制药,AVT02制剂含有高浓度(100mg / ml)的阿达木单抗,可以减少患者单词给药时的注射剂量,对患者更方便。

强生制药寻求DARZALEX®(daratumumab)组合疗法治疗新发多发性骨髓瘤患者
3月13日,美国,Janssen制药公司今天宣布已经向FDA提交了DARZALEX®(daratumumab)与来那度胺和地塞米松联合使用治疗新诊断的多发性骨髓瘤患者的补充申请。此次适应症的拓展基于III期临床MMY3008研究的数据,目前该研究的数据正在接受FDA肿瘤学实时评估小组的审查。MMY3008研究评估了抗CD38疗法作为新发多发性骨髓瘤患者的组合方案的有效性和安全性,该研究的结果显示,在中位随访28个月后,与单药治疗相比组合疗法使得患者的疾病进展或死亡风险降低了44%,受试患者的完全反应率也显著增加。
Dupixent®(dupilumab)在美国获批青少年特应性皮炎适应症
3月13日,美国,Regeneron和赛诺菲今天联合宣布FDA已经批准Dupixent®(dupilumab)用于12至17岁的中度至重度特应性皮炎的青少年患者的治疗。根据此前的III期临床试验显示,Dupixent单药治疗中度至重度特应性皮炎青少年患者,其安全性和疗效与成人研究中所见的一致。与安慰剂相比,使用Dupixent的患者瘙痒显着减少7倍以上,患者湿疹面积和严重程度指数(EASI)相较于基线水平改善率约66%,使用Dupixent的患者总体疾病改善率至少达到75%,24%的患者其皮肤状况恢复正常。
小编点评:
Dupixent是靶向IL-4和IL-13的信号传导的生物疗法,其在特应性皮炎和其他几种过敏性2型炎症中有良好的临床疗效。此次Dupixent适用人群的进一步扩大将惠及更多成人和青少年特应性皮炎或中重度哮喘患者。鉴于Dupixent对2型炎症的良好疗效,公司也将计划进一步推进其在嗜酸性粒细胞性食管炎,慢性鼻窦炎和鼻息肉等方面的研究。
CYRAMZA®(ramucirumab)联合厄洛替尼治疗NSCLC获得积极进展
3月13日,美国,礼来今天宣布其CYRAMZA®(ramucirumab)的III期临床RELAY研究达到无进展生存期的主要终点,CYRAMZA加厄洛替尼显着延缓了该患者群体的疾病进展。这是一项全球随机,双盲,安慰剂对照的III期研究,着重评估了CYRAMZA®(ramucirumab)联合厄洛替尼作为先前未治疗的转移性NSCLC患者(EGFR突变)的一线治疗的疗效。该研究在北美,欧洲和亚洲的各中心招募了449名患者,主要终点是无进展生存期,关键的次要终点包括安全性,反应率,总体生存率等。在RELAY研究中观察到的安全性与先前研究中的安全性特征一致,与安慰剂加厄洛替尼组相比,CYRAMZA加厄洛替尼组最常见3级不良事件为高血压,痤疮皮炎和腹泻。公司打算在2019年中期在全球多地提交上市申请。
在美国,CYRAMZA(ramucirumab)已经被被批准用作单一药物或与紫杉醇联合用作治疗晚期或转移性胃或胃食管交界腺癌的治疗,此外,大肠癌的化疗方案也将该疗法纳入了转移性结直肠癌(mCRC)的患者的治疗。Ramucirumab是一种抗血管生成疗法,其通过阻断VEGF受体配体VEGF-A,VEGF-C和VEGF-D的结合而特异性阻断VEGF受体2的活化。
帕金森病靶向药物ABBV-0805开始I期临床研究
3月14日,BioArctic AB公司今天宣布由其和AbbVie联合开发的帕金森病新疗法ABBV-0805已经在美国开展第一阶段的临床研究,该研究主要在健康志愿者中进行安全性和耐受性的评估。帕金森病是一种神经系统疾病,与大脑中多巴胺水平降低有关,震颤和运动障碍是该疾病的病理标志,患有帕金森病的患者运动相关大量神经细胞受损。ABBV-0805是一种靶向α-突触核蛋白抗体药物,错误折叠的α-突触核蛋白与细胞损伤有关, α-突触核蛋白聚集体也可以从细胞中释放出来并传播到邻近细胞,从而将疾病从大脑的一个区域扩散到另一个区域。
Hemlibra®(emicizumab)在欧洲获批血友病A的治疗
3月14日,日本,Chugai制药今天宣布已经收到欧盟委员会的决定,批准Hemlibra®(emicizumab)用于血友病A患者出血的预防治疗,并且其针对所有血友病A患者多种剂量用药选择(每周一次,每两周一次或每四周一次)也同步获得批准。该批准是基于两项III期研究HAVEN 3和HAVEN 4的结果,这两项研究结果均支持对于不同类型患者进行多剂量用药选择能够降低患者的出血概率。
默克公司的肺癌免疫联合疗法在欧洲获批
3月4日,美国,默克公司今天宣布欧盟委员会批准KEYTRUDA与卡铂和紫杉醇联合使用一线治疗成人转移性鳞状非小细胞肺癌(NSCLC)。该批准基于III期临床KEYNOTE-407试验的数据,该试验证明KEYTRUDA联合化疗显着改善了转移性鳞状NSCLC成人的总生存期,无论患者PD-L1表达状态如何,均能够降低患者36%的死亡风险。
罗氏的利妥昔单抗获批用于罕见病寻常型天疱疮的治疗
3月15日,瑞士,罗氏今天宣布欧洲委员会已批准MabThera®(利妥昔单抗)用于治疗患有中度至重度寻常型天疱疮(PV)。这是一种罕见病症,属于自身免疫性疾病,它在病损处可以测到抗体,在血液中也可测出抗表皮细胞棘的抗体,其特征是进行性疼痛性水疱。天疱疮的病因不明,目前对自身免疫病因的研究较多,认为与病毒感染、紫外线照射、某些药物(如青霉胺等)的刺激有关,使棘细胞层间的粘合物质成为自身抗原而诱发自身免疫反应。
新适应症的批准是基于III期临床Ritux 3试验的数据,该试验评估了MabThera加低剂量口服皮质类固醇方案,与标准剂量的单独CS相比,对于中重度天疱疮的临床疗效,该研究的主要终点是在时的24个月完全缓解率。该研究表明,89.5%接受MabThera治疗的PV患者,结合短期口服CS治疗,能够获得更长时间的完全缓解率。最近国际大疱性疾病专家小组,在美国皮肤病学会期刊上发表了关于天疱疮诊断和治疗的新建议,并建议使用抗CD20单克隆抗体作为中度至重度天疱疮的一线治疗选择。
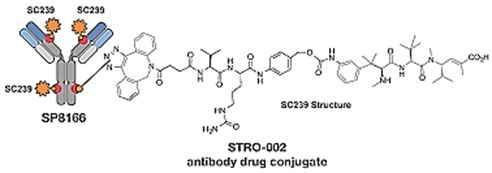
Sutro Biopharma的抗癌新药已开始1期临床研究
3月15日,Sutro Biopharma今天宣布在卵巢和子宫内膜癌患者中开展的STRO-002一期临床研究已经有第一位受试者入组接受治疗。这项多中心,开放标签,剂量递增,剂量扩展I期试验主要评估STRO-002的安全性、耐受性和初步抗肿瘤活性,计划招募多达160名患有晚期复发和/或进展性卵巢,输卵管,原发性腹膜或子宫内膜癌的女性。STRO-002是一种抗叶酸受体α抗体偶联药物,由Sutro的XpressCF技术平台开发,是该公司目前进入临床阶段的第二个候选产品。
STRO-002能够高效靶向FoIRα,这是一种在卵巢癌中高表达的细胞表面蛋白。在临床前研究中,STRO-002在卵巢癌细胞系中显示出有效的体外细胞毒性,并在多种卵巢癌异种移植模型中显着抑制肿瘤生长。在非人类灵长类动物的安全性研究中,STRO-002在临床相关剂量下耐受良好。
降脂疗法Praluent®(alirocumab)的新适应症在欧盟获批
3月17日,法国,欧盟委员会批准了Praluent®(alirocumab)的新适应症,用于降低成人动脉粥样硬化性心脏病(ASCVD)患者的心血管(CV)风险。许多患有动脉粥样硬化性心血管疾病的患者尽管生活方式改变且持续接受他汀类药物治疗,但其胆固醇水平仍难以控制。欧盟委员会的批准是基于ODYSSEY OUTCOMES的数据,这是一项前瞻性III期试验,该试验评估了18924例患者在入组前的1-12个月内加入接受Praluent治疗的临床疗效。试验符合其主要终点,结果显示接受Praluent治疗的患者严重不良心血管事件的相对风险显着降低了15%。
Praluent®(alirocumab)抑制PCSK9与LDL受体的结合,从而增加肝细胞表面可利用的LDL受体数量以清除LDL,从而降低LDL-C水平。
欢迎加入小编团队成为小编一员
请加小编微信号:wuwenjun7237
如有技术解读、行业洞见愿意分享
欢迎投稿到小编邮箱:
[email protected]













