美国得克萨斯大学医学院、休斯敦纪念赫尔曼医疗中心、神经科学重症监护治疗病房、麻醉科George Williams博士以“卒中患者围术期脑血管意外的预防”为题进行了报告。
背景
世界卫生组织(WHO)将卒中定义为脑血管原因所致的局灶性或全脑性神经功能缺损,持续时间可超过24 h或患者在24 h内死亡。围术期卒中可进一步分为缺血性或出血性卒中,一般发生于术中或术后30 d内。近1/3的围术期卒中发生于术后第一个48 h内,其余2/3的病例可能发生于术后常规随访过程中,容易被忽略。此外,对于围术期卒中患者,上述定义一般成立,但也不具有普遍性。
约1/3的围术期卒中发生在术后48 h内
蛛网膜下腔出血(SAH)是卒中的另一主要病因。根据出血严重程度,SAH患者可出现缺血性和出血性特征,缺血症状可在脑动脉瘤出血之后14 d 发生,此时可能需要在发作后几天使用血管升压类药物维持血压。
短暂性脑缺血发作可导致急性局灶性脑功能丧失,症状持续时间一般不超过24 h,原因通常为栓塞或血栓形成,多发生于全身麻醉之后。
除外上述这两种常见的卒中类型,还包括隐匿性卒中(也称为无症状卒中),但对该类卒中的关注程度则较少。虽然隐匿性卒中可明确预示潜在疾病的严重程度或正在发生的炎症,但是已经报告的卒中发生率并不能可靠反映隐匿性卒中的发生风险。总之,卒中可分为出血性或缺血性卒中,出血性卒中又可分为颅内出血或脑室内出血。当然也有一些罕见原因导致的卒中样症状,但是该项报告不予讨论。
评分系统
对于已明确诊断为卒中的患者,评估其临床状况的措施多种多样,其中最常见的是格拉斯哥昏迷评分(Glasgow Coma Scale,GCS)。值得注意的是,GCS仅能反映患者总体临床状况,并不能反映功能状态。GCS结果可分为以下五个水平:
1级-死亡;
2级-植物状态(患者无反应,但仍然活着,俗称“植物人”);
3级-重度残疾(有意识,但患者需要别人的日常支持);
4级-中度残疾(患者可独立生活但仍然残疾);
5级-恢复良好(患者已恢复大多数正常活动,但可能有轻微残留问题)。
此外,改良Rankin量表是一种常见的用于患者转归分类的方法,且已经在卒中患者的分类中得到了很好的验证:
0-没有症状;
1-虽然合并一些症状,但没有明显残疾:能进行所有的日常工作和活动;
2-轻度残疾:无法开展之前的所有活动,但在没有帮助的情况下可以处理自己的事务;
3-中度残疾:需要一些帮助,在没有帮助的情况下可以行走;
4-中重度残疾:在没有帮助的情况下不能行走、不能满足自己身体需要;
5-重度残疾:卧床不起、大小便失禁,需要持续的日常护理和照顾;
6-死亡。
发病率和死亡率
围术期卒中发病率的差异取决于手术的类型。卒中发病率相关的回顾性和前瞻性分析可追溯至1967年。报告显示,心血管外科手术患者卒中发病率最高(0.8%~9.7%),相比之下,头颈部肿瘤手术患者发病率为4.8%、普外科的发病率0.08%~0.7%。此外,上述发病率和死亡率不局限于时间延长手术或三级手术。全国普通外科数据库(NSQIP)统计结果显示,卒中总发生率为0.1%,这表明,大约1/1000或更多的患者发生卒中可能与手术、麻醉相关。相比之下,丙泊酚输注综合征发病率为1.1%,维生素K相关过敏反应的发病率为0.033%,输注相关肺损伤的发病率为0.02%。
大约6%的围术期卒中发生在手术过程中,这显示了围术期麻醉管理的重要性。大多数心脏外科手术患者发生卒中的主要原因是栓塞(60%)、低血压和灌注不足占15%~20%、而脑出血仅占1%。与非心脏手术患者不同,68%的卒中患者继发于脑血管血栓栓塞、其他原因包括栓子形成(6%)和脑出血(5%)。上述观察性临床研究模式反映了非心源性卒中患者的卒中类型,提示卒中发生过程中内皮机制的作用。这就需要以不同的方式减轻出血性或缺血性现象(即应用他汀类药物、内分泌调节机制)。
卒中患者死亡原因可分为早期和晚期原因。早期原因与卒中急性表现相关,如脑水肿、脑出血和延迟诊断等。脑水肿和脑出血患者特征相似,均表现为占位性病变,这一点与肿瘤或硬膜下血肿不同。肿瘤是一种生长缓慢的病变,通常的治疗方案包括使用类固醇药物和择期手术治疗。硬膜下血肿一般为实质外血液聚集的表现形式,可快速吸收,可能不会导致周围水肿。虽然脑出血、脑水肿在很多方面不同于硬膜下血肿或肿瘤,但是,它们在增加患者死亡率方面的机制是相似的。延迟诊断会明显增加死亡率,因为随着时间的推移,占位效应或细胞破坏程度均会加重,从而导致疾病恶化。通过积极的医师教育和全面的术后检查有助于早期诊断。
晚期原因包括肺炎、代谢紊乱、脓毒症和急性心肌梗死。肺炎可能是由于误吸,也可能表现为卒中所致的肺不张。卒中患者往往营养状况较差,除非积极补充营养,常见的代谢紊乱可能会延长患者住院时间,从而增加病死率。
卒中发病率与手术
总体来看,卒中相关死亡率为13%。而对于围术期卒中患者,卒中相关死亡率变化范围较大,可以从26%(手术患者)至高达87%(既往卒中史患者)。
危险因素
卒中危险因素包括手术后6个月内急性心肌梗死史、急性肾功能衰竭或长期血液透析、心房颤动、高血压、既往卒中史、慢性阻塞性肺疾病、吸烟、年龄超过70岁等。有趣的是,年龄的增加不大可能影响大脑自动调节功能,事实上,对于占位效应较明显的患者,考虑到年龄增加所致的机体萎缩,高龄反而可以改善患者颅顶对肿胀的耐受程度。高龄患者术后谵妄发生率也较高,围术期卒中史则会增加术后谵妄的可能性。
病理生理学
卒中发病机制比较复杂,且与潜在的疾病进程直接相关。脑出血的发生与高血压或淀粉样蛋白病相关,而出血部位往往位于较大的脑动脉分叉附近。脑室扩张可能发生于脑出血患者,在某些情况下,血液仅在脑室系统中观察到。由于脑室内血液可导致蛛网膜颗粒功能障碍,从而可能引起脑内压升高(继发于脑脊液流出和吸收障碍)。严格控制血压以预防再出血是十分必要的,可将输注血管扩张剂(如拉贝洛尔、尼卡地平)作为其中一项临床管理方案,直到患者可以通过长期口服药物控制疾病。出血性卒中的面积可使用ABC/2规则进行简单计算,并适用于任何具有资质的医师。这种方法是借助于简单的几何学来计算卒中病灶面积,并假设卒中病灶的形状是一个椭圆形球。 A和B代表长度和宽度(X轴和Y轴),而C代表深度(Z轴),单位是cm。标准卡尺可用于测量计算机体层摄影(CT)扫描片所示卒中范围(长度和宽度)。在深度方面,许多断层扫描片厚度为5 mm,所以观察到深度为1 cm的卒中病灶需要借助于2个扫描片。实际上,若卒中长度2 cm、宽度3 cm、深度1 cm,卒中病灶大小则为3 cm3(或3 mL)。
缺血是围术期卒中最常见的原因,通常是由于低流量状态、脑血管血栓形成或栓塞所致。脑血管血栓形成与血管内皮功能障碍相关,这被认为是大多数围术期卒中的发生机制。低流量状态(低灌注)可导致梗死形成以及栓塞,进一步加剧了卒中的临床进展。
蛛网膜下腔出血一般源于动脉瘤性疾病,尽管在不同的情况下,如外伤或非动脉瘤性蛛网膜下腔出血,并不能发现疾病存在。管理方案包括经典的3H治疗,即诱导高血压(hypertension)、血容量过多(hypervolemia)和血液稀释(hemodilution)。但是在一些医学中心,仅有条件开展双H治疗,即诱导高血压和血容量过多。若蛛网膜下腔出血患者耐受,尼莫地平可作为预防疗法的一部分以改善神经功能转归。
炎症介质
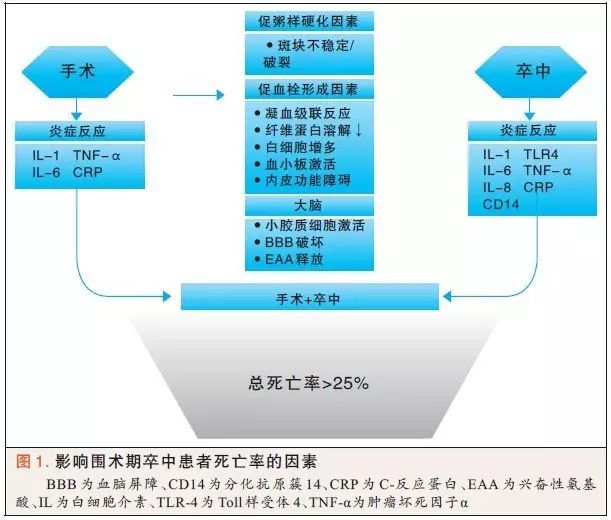
外科手术本身可能会引发或加重脑损伤,术后产生多种炎性细胞因子(见图1)。白细胞介素1(IL-1)、IL-6、肿瘤坏死因子-α(TNF-α)和C-反应蛋白(CRP)均是术后产生的。已经证明,IL-6水平与急性缺血性卒中发生后3个月的梗死面积和改良后Rankin评分相关。IL-6浓度每增加1U,患者死亡率增加18%。在梗死后第12个月,IL-6浓度超过30 pg/mL与患者较高的死亡率相关。尽管目前上述数据不能用于协助临床决策的制定,但是也清晰的提示了炎症程度对患者转归的影响。
Toll样受体4(TLR4)是模式识别受体家族的一员,在炎症反应中起到关键作用。有证据表明TLR-4信号通路在脑出血诱导的炎症性脑损伤中发挥重要作用。这似乎与小胶质细胞活化(神经免疫系统的一部分)、白细胞的浸润和细胞因子的产生有关。参与脑出血诱导的炎症损伤的TLR-4信号通路包括配体、TLR-4、下游通路如衔接蛋白和转录因子(如细胞核因子KB)。TLR-4与相关信号通路是未来治疗脑出血的潜在靶点。
积极组织医师培训和全面的术后检查可减少延迟诊断
基质金属蛋白酶是一组降解脑组织细胞外基质的蛋白酶,在缺血性卒中发生后,金属蛋白酶活性被激活,破坏细胞外基质的完整性,导致血脑屏障通透性增高和脑出血。
有学者认为金属蛋白酶通过促进缺血后卒中患者神经血管重塑,从而促进患者恢复,但是,他们的说法尚未完全达成一致。
临床应用
温度
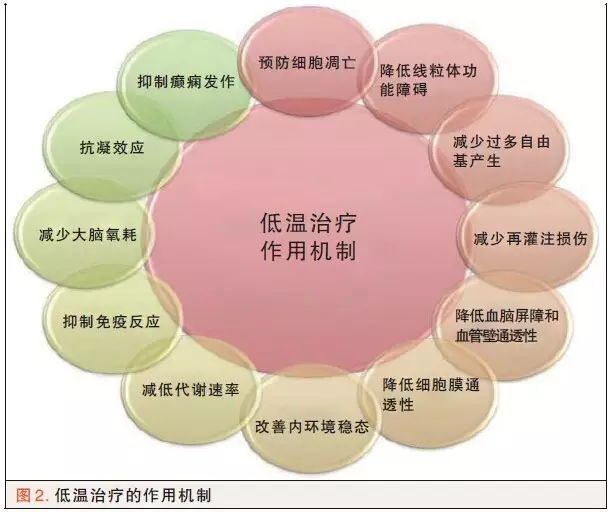
低温相关的信号通路机制需要进一步探讨,通常认为温度每降低1℃,脑代谢率降低7%。图2通过各种机制演示了体温过低对卒中患者可能是有益的。
体温过高可使急性卒中患者(包括蛛网膜下腔出血患者)转归发生恶化。高热(超过38℃)是卒中患者发病率和死亡率增加的独立危险因素。虽然手术护理改进项目指南中要求预防体温过低,但体温过高也可能对卒中患者产生不利影响。
他汀类药物
他汀类药物通过抗炎和稳定粥样斑块来降低脑血管事件的发生,见图3。对于接受颈动脉末端动脉内膜切除术的患者,长期规律摄入他汀类药物可降低围术期卒中和死亡风险。对于尚未服用他汀类药物的非心血管疾病患者,围术期应用他汀类药物可以降低心肌梗死的发生风险和缩短住院时间。
体温过高可导致急性卒中患者转归恶化
停用他汀类药物可能与缺血性卒中患者转归恶化相关。一项研究对正在使用他汀类药物的患者停药3 d与持续使用小剂量阿托伐他汀的患者进行了比较。分析发现,急性卒中发作前使用他汀类药物与改善转归相关(改良Rankin量表评估),尤其对于糖尿病患者。接受他汀类药物治疗的患者预后较好,而那些早期没有使用他汀类药物的患者神经功能恶化程度和梗死面积均增加。鉴于他汀类药物对围术期患者的有益作用,围术期不应停用他汀类药物。此外,若患者术前出现卒中、且无他汀类药物使用禁忌证,麻醉医师应将他汀类药物作为卒中患者术前常规用药之一,并推荐术中继续使用他汀类药物。在经认证的卒中康复中心,他汀类药物也为治疗卒中的一种常规药物。
抗凝治疗
心房颤动、高凝状态与血栓栓塞性卒中的发生相关。 CHADS2评分是用来评估心房颤动患者血栓栓塞事件的发生风险,见表1。CHADS2评分每增加1分,卒中发生风险也随之增加。CHADS2评分高于2通常是老年患者开始抗凝治疗的阈值(根据表2所示的卒中流行病学调查结果),尽管这一点目前仍存在争论。需要注意的是,这种风险不是每人每年的卒中发生率,而是每100人年的卒中发生率。术前是否停止抗凝治疗,是外科医师和内科医师都值得讨论的问题。
术中监测
脑电双频指数监测已经被用于评估接受颈动脉内膜切除术的患者。然而,关于上述观点的研究为小型研究且需要进一步验证。目前,没有充分证据表明脑电双频指数监测可以用于术中卒中的筛查。
考虑到将脑电图监测用于卒中患者,需要人力资源对其日常管理进行大力支持。目前,尽管仅有8%的脑出血患者发生癫痫,但是对于围术期卒中患者,仍然缺乏有效的预防措施。脑出血患者血液积聚在脑叶时发生癫痫的可能性最高,对于此类患者,围术期评估时应予以重视。 近红外光谱学已经作为评估卒中严重程度的监测指标。在应用上述设备时,由于制造商不同、技术存在差异,因此,可靠性也存在显著差异。
血流动力学参数
大脑发生卒中后就会丧失有效的大脑自身调节功能,此时的脑灌注生理机制从根本上来看就类似于一个妊娠的子宫。
心血管疾病患者卒中风险升高,但是最近一项纳入超过62000例患者的回顾性分析显示:对于具有既往卒中史的患者,延迟冠状动脉旁路移植术可使转归发生恶化。因此,该研究建议对于此类患者,不应延迟手术。
对于卒中患者脑灌注压,超过60 mm Hg仍然是患者普遍接受的目标。为了优化卒中患者转归,蛛网膜下腔出血患者脑灌注压阈值可能需要提高至70 mm Hg。
术中低血压与β-受体阻滞剂的使用可使患者卒中的发生风险增加一倍。与其他任何药物一样,不加选择的给予β-受体阻滞剂可对卒中患者造成不利影响。当卒中患者需氧增加时,可能会降低心血管系统的代偿能力,比如药物过量可能导致低血压。
麻醉方法
目前,仍缺乏文献来确定适用于所有卒中患者的麻醉技术。当然,还有一些不足。一项GALA试验显示,对于接受颈动脉内膜切除术的患者,进行局部神经阻滞与全身麻醉后患者转归没有显著差异。呼气末二氧化碳分压不应小于35 mm Hg(除非需要紧急手术),否则会引起血管收缩、脑血流量减少,甚至导致大脑发生缺血性改变。尽管患者体位与卒中发生没有普遍相关性,患者坐位时仍应提高警惕,因为脑灌注压的降低可能会增加卒中发生风险。
总的来说,许多基础实验和临床初步研究均提示,局部脑血流量的差异取决于麻醉方法,但目前没有在卒中人群中被正式评估。
总结
(此处内容略)
(湖北省襄阳市中心医院麻醉科李龙成)
(《麻醉学大查房》原创作品,未经书面授权,其他公众号及网站等禁止转载。任何投诉、建议、投稿等事宜,请申请加微信号EBC0003为好友进行沟通!)

请长按上面图片,选择“识别图中二维码”,即可直接关注麻醉学大查房微信公众号(mazuixuedachafang)。

请长按上面图片,选择“识别图中二维码”,申请加医生及出版人YU为好友,会有意外收获。





