

摘 要:目的
从肠道菌群角度,评价两亲性嵌段共聚物用于中药汤剂抑苦的适宜性和安全性。
方法
以苦味强烈的盐酸小檗碱(
berberine hydrochloride
,
BH
)溶液为模型药物,采用高通量测序技术,对比研究两亲性嵌段共聚物、天然甜味剂(蔗糖)与人工甜味剂(阿斯巴甜)连续给药
2
周后对大鼠肠道菌群的影响。
结果
BH
经过两亲性嵌段共聚物、蔗糖、阿斯巴甜掩味后,其物种总数有升高的趋势。两亲性嵌段共聚物不影响
BH
菌群的多样性与群落构成;蔗糖具有使
BH
菌群多样性升高的趋势,阿斯巴甜具有使
BH
菌群多样性降低的趋势。
结论
在长期服药条件下,两亲性嵌段共聚物作为汤剂抑苦辅料不干扰药物对肠道菌群的作用,对于儿童用药是一种更为安全的掩味剂。
中药汤剂普遍苦味重、口感差,严重影响服药的顺应性,尤其是儿童人群难以忍受。这与汤剂中苦味成分多以分子态形式存在、分散度大,能在极短时间内瞬时完成苦味信号传导密切相关
[1]
。目前,甜味剂是应用最为广泛的矫味剂,包括天然甜味剂与人工甜味剂。在普通家庭中,主要添加大量蔗糖干扰汤剂苦味,个别医院药房有小包装甜菊素提供,但蔗糖与甜菊素均为天然甜味剂,其矫味效果通常是苦味与甜味的复合,对小剂量且苦味不强的药物有效,但对大剂量或苦味强烈的药物效果并不理想。在部分中成药制剂处方中,有使用三氯蔗糖、阿斯巴甜、纽甜等人工甜味剂抑苦的用法
[2]
。人工甜味剂刺激的甜味感知通路与苦味感知通路相同,常作为抑苦的“特效”物质
[3]
。但最新研究表明,人工甜味剂可能会引发肠道菌群的紊乱,影响菌群的代谢通路,增加宿主对代谢疾病的易感性,尤其是降低肠道菌群葡萄糖耐受性
[4-5]
。纽甜还可降低菌群多样性,改变肠道微生物的代谢途径和粪便代谢物的分布,引起多种脂肪酸、脂质和胆固醇升高,苹果酸和甘油酸大量减少
[6]
。因此,人工甜味剂并不适合长期服用,尤其对于肠道菌群平衡脆弱的儿童群体,可能是威胁其健康的潜在因素
[7-8]
。
两亲性嵌段共聚物是指存在两种或两种以上结构不同的链段的单一线性分子,可根据需要合成具有特定化学结构、相对分子质量的共聚物,是一种广泛应用且安全性好的辅料
[9-10]
。课题组前期发现两亲性嵌段共聚物是一种液体制剂的新型苦味掩蔽剂,对于多种结构的苦味成分均有明确的抑苦效果,并可在水中自组装形成胶束,包裹苦味成分的疏水性苦味基团,阻断苦味基团与苦味受体的结合,达到掩蔽苦味的目的;同时,其口服后可在体内降解,对药物药效与体内吸收过程无显著影响
[11-12]
。但两亲性嵌段共聚物长期给药是否影响肠道菌群的平衡尚不明确,制约了其作为新型抑苦辅料的开发与应用。为此,本实验以苦味强烈的盐酸小檗碱(
berberine hydrochloride
,
BH
)溶液为模型药物,采用高通量测序技术,对比研究两亲性嵌段共聚物、天然甜味剂(蔗糖)与人工甜味剂(阿斯巴甜)连续给药
2
周后对大鼠肠道菌群的影响,以期为两亲性嵌段共聚物进一步的抑苦应用提供科学依据。
1
仪器与材料
1.1
仪器
Tc-Meter 4K-7.2K
离心机,美国
Topscience
公司;
Qubit 3.0
定量仪,美国
Life technologies
公司;
CF-F9677
型
PCR
扩增仪,美国
Coyote Bioscience
公司;涡旋振荡器,美国
Thermo Fisher
公司;
Agilent 4200 TapeStation
电泳仪,美国
Agilent Technology
公司;
QuantiFluor™-ST
蓝色荧光定量系统,美国
Promega
公司;
NovaSeq 6000
测序仪,美国
Illumina
公司;
AxyPrep DNA
凝胶回收试剂盒,
Axygen
公司;
AM10027
磁力架,美国
Invitrogen
公司;
FastPure Gel DNA Extraction MiniKit
,南京诺唯赞生物科技有限公司。
1.2
供试药品
BH
,购于中国食品药品检定研究院,批号
713- 9003
;单甲氧基聚乙二醇
-
左旋聚乳酸(
mPEG2000- PLLA2000
),批号
2019071415
,相对分子质量均为
2000
,购于济南岱罡生物科技有限公司;阿斯巴甜,批号
WMO327DY13
,购于上海源叶生物科技有限公司;蔗糖,批号
20081113
,购于成都科龙化工试剂厂;水为实验室自制超纯水,
Milli-Q
级别。
1.3
动物
SPF
级
KM
小鼠,雄性,体质量
18
~
22 g
,购于四川省中医药科学院实验动物中心,许可证号:
SCXK
(川)
2018-19
。实验环境为
SPF
洁净级屏障系统,室温
20
~
22
℃,相对湿度
40%
~
70%
,
12 h
明暗交替照明。实验过程中,动物自由饮水、饮食,使用实验动物标准饲料,购于成都达硕生物科技有限公司,许可证号:
SCXK
(川)
2014-0008
,实验遵循成都中医药大学附属医院有关实验动物管理和使用的规定,均符合
3R
原则。
2
方法
2.1
供试品溶液的制备
取
BH 0.13 g
,精密称定,各
4
份,分别加入
100 mL
超纯水超声溶解。按照前期试验结果
[10]
及甜味剂常用剂量,其中
3
份分别加入
0.16% mPEG 2000-PLLA2000
、
20%
蔗糖、
0.6%
阿斯巴甜,即得供试品溶液。
2.2
分组及样品采集
SPF
级
KM
雄性小鼠
30
只,分为
5
组,每组
6
只。按体质量随机分为
BH
组、
BH
+共聚物组、
BH
+蔗糖组、
BH
+阿斯巴甜组、对照组。
SPF
级动物房适应性饲养后,
ig
给药,
ig
容量
0.02 mL/g
,每天
1
次,连续
14 d
。末次给药后各组小鼠禁食不禁水,无菌条件下采集小鼠新鲜粪便
3
~
5
粒,立即放入灭菌后的离心管中,超低温保存,以备肠道菌群分析
[13]
。
2.3
基因组
DNA
抽提
、
PCR
扩增和测序
样品微生物多样性测序由上海元莘生物医药科技有限公司完成。利用
DNA
提取试剂盒提取大鼠粪便的基因组
DNA
,采用
1%
琼脂糖凝胶电泳检测抽提的基因组
DNA
。
PCR
扩增细菌
16S
核糖体
RNA
基因的
V3
~
V4
可变区。采用
338F5’-ACTCCTAC GGGAGGCAGCAG-3’
,
806R 5’-GGACTACHVGG GTWTCTAAT-3’
为引物,
TransStart Fastpfu DNA Polymerase
为扩增酶,在
20 μL
反应体系(
5
×
FastPfu Buffer 5 μL
,
2.5 mmol/L dNTPs 2.5 μL
,
Forward Primer (5 μmol/L) 1 μL
,
Reverse Primer (5 μmol/L) 1 μL
,
FastPfu Polymerase 0.5 μL
,
BSA 0.25 μL
,
Template DNA 10 ng
,
ddH
2
O
补至
20 μL
)中进行扩增,每个样品均进行
3
次重复扩增。将同一样本的
PCR
产物混合,采用
2%
琼脂糖凝胶电泳检测,使用
AxyPrep DNA
凝胶回收试剂盒切胶回收
PCR
产物,
Tris-HCl
洗脱,将
PCR
产物用
QuantiFluor™-ST
蓝色荧光定量系统(
Promega
公司)进行检测定量,之后按照每个样本的测序量要求,进行相应比例的混合。随后构建
Illumina PE250
文库,上机测序。
根据
overlap
关系,将
Illumina PE250
测序得到的
PE reads
进行拼接,同时对序列质量进行质控和滤过,区分样本后进行
OTU
(
operationaltaxonomic units
)聚类分析和物种分类学分析,相似度为
97%
。
2.4
菌群的多样性分析
利用
OTU
聚类结果与
R
语言工具绘制稀释曲线、
Shannon-Wiener
曲线、
Rank-Abundance
曲线与
Specaccum
物种累积曲线以检测测序深度。其中,随着测序量的增加,稀释曲线的平缓程度反映测序深度对样品中物种的覆盖度。
Shannon-Wiener
曲线是反映各样本在不同测序量时的微生物多样性。
Rank-Abundance
曲线表明,样品所含物种的丰富程度和均匀程度。物种的丰富程度呈现于曲线在横轴上的长度,曲线越宽,表示物种的组成越丰富;物种组成的均匀程度呈现于曲线的形状,曲线越平坦,表示物种组成的均匀程度越高。
Specaccum
物种累积曲线可以判断样本量是否充分,并可以预测样品的物种丰富度。曲线趋于平缓,表示在实验环境中的物种并不会随样本量的增加而显著增多,抽样充分,可以进行数据分析。采用
SPSS 20.0
统计软件进行
α
多样性分析,按照
0.97
的相似性阈值将序列划分为一个物种,比较试验组间
OTU
、
Ace
、
Chao
、
Coverage
、
Shannon
、
Simpson
指数的差异。
OTU
表示在样品中微生物物种的数量;
Ace
与
Chao
指数是对菌群物种的总数评估;
Shannon
指数主要用来估算样本中微生物多样性,
Shannon
越大,说明群落多样性越高。
Simpson
指数描述从一个群落种连续两次抽样所得到的个体数属于同一种的概率,
Simpson
越大,即种类越均一。
2.5 β
多样性分析
样本间的物种或功能的丰度分布差异程度可通过统计学中的距离进行量化分析,使用统计算法
Bray-Curtis
计算两两样本间距离,通过距离矩阵比较不同样本间物种差异,即
β
多样性分析,包括主成分分析(
principal components analysis
,
PCA
)、主坐标分析(
principal coordinate analysis
,
PCoA
)、非度量多维尺度分析(
nonmetric multidimensionalscaling
,
NMDS
)。
2.6
物种组成与差异菌群分析
基于分类学信息,对各个分类水平上进行群落结构的统计分析。采用
Usearch
软件和
Gold
数据库,利用
Donovo
和
Reference
结合的方式去除嵌合体,
Silva
(
SSU115
)
16S
细菌和古菌核糖体数据库进行分类学比对。采用
LEfSE
分析,找出对样本划分产生显著性差异影响的群落或物种。
3
结果
3.1
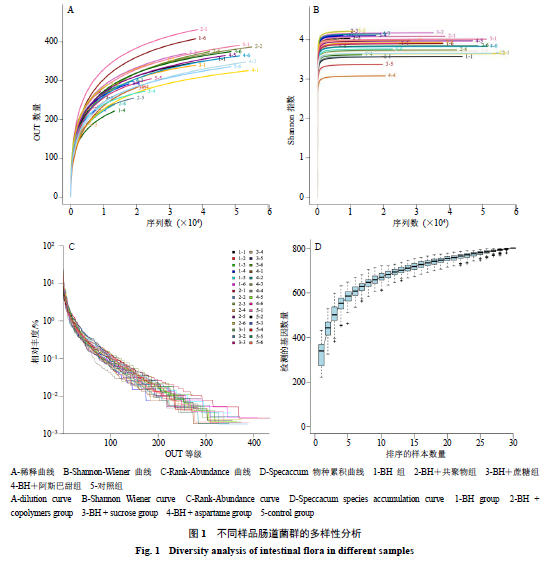
菌群的多样性分析
利用
OTU
聚类结果进行测序深度的检测与
α
多样性分析,如图
1
所示,
30
个样本的稀释曲线均趋于平缓,且大部分样品达到平台期,可以认为测序深度已经基本覆盖到样品中所有的物种。
Shannon-Wiener
曲线均趋向平坦,表明测序数据量足够大,可以反映样品中绝大多数的微生物物种信息。
Rank-Abundance
样本曲线的延伸终点的
OTU
值均大于
200
,物种数量较多,且曲线均平滑下降,表明样本的物种多样性较高。
Specaccum
物种累积曲线趋于平缓,表示在实验环境中的物种并不会随样本量的增加而显著增多,抽样充分,可以进行数据分析。
采用
SPSS 20.0
统计软件进行统计学分析,各组间
OTU
、
Ace
、
Chao
、
Coverage
、
Shannon
、
Simpson
差异均不显著,结果见表
1
。相比于
BH
组,
BH
+阿斯巴甜组、
BH
+共聚物组、
BH
+蔗糖组的
OTU
数量、
Ace
与
Chao
指数均有增大的趋势,且
3
种多样性评价指标变化趋势相同。增大趋势最明显的是
BH
+阿斯巴甜组,其次是
BH
+共聚物组,表明
BH
溶液经过蔗糖、共聚物、阿斯巴甜掩味后,其物种
总数有升高的趋势。相比于
BH
组,
BH
+共聚物组的菌群
Shannon
指数最为接近,即
2
组间菌群多样性基本不变,
BH
+蔗糖组菌群多样性有升高的趋势,
BH
+阿斯巴甜组有降低的趋势。因此,甜味剂可能会影响肠道菌群的多样性,而经共聚物掩味后,不影响肠道菌群的多样性。
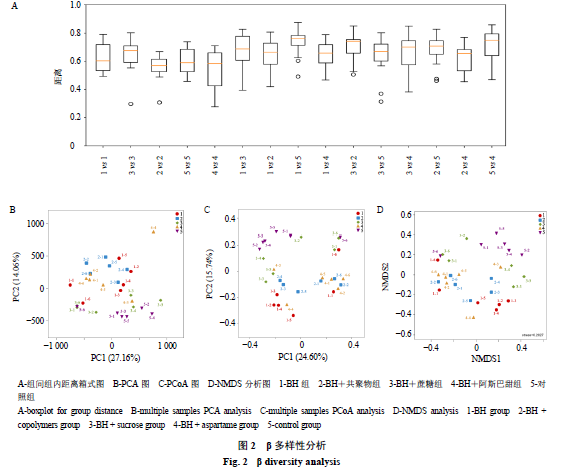
3.2 β
多样性分析
通过
β
多样性分析比较样本间的物种或功能的丰度分布差异程度,如图
2-A
所示,各组样品间组内差异与组间差异均较大。其中,各组间组内差异程度几乎一致,与
BH
组比较,对照组群落构成差异最大,与其余组之间的差异不大;与
BH
+共聚物组相比,
BH
+蔗糖与对照组群落构成差异最大;与对照组比较,
BH
组与
BH
+阿斯巴甜组群落构成差异最大。
PCA
、
PCoA
与
NMDS
结果显示,与
BH
组相比,
BH
+共聚物组群落构成最接近,其次是
BH
+阿斯巴甜组;与对照组比较,
BH
组群落构成差异最大,其次是
BH
+共聚物组与
BH
+阿斯巴甜组(图
2-B
~
D
)。样品间的群落构成无论是组内差异还是组间差异均具有明显的差异,可能是由于微生物的群落构成存在着很大的个体差异。
BH
组与
BH
+共聚物组微生物的群落构成最接近,且与对照组群落构成存在明显差异,表明
BH
与
BH
+共聚物组具有明显的抑菌药效,且共聚物不影响
BH
的抑菌药效。
BH
+蔗糖组微生物的群落构成最接近于正常肠道微生物群落构成,可能是由于利用蔗糖对药物进行矫味后,可引起肠道的细菌数与淀粉酶活性降低,大肠杆菌数与蛋白酶活性升高
[14]
,从而降低
BH
抑菌药效。
3.3
物种组成分析
样品各分类水平中的物种
Profiling
柱状图见图
3
。在门水平上,拟杆菌门(
Bacteroidetes
)、厚壁菌门(
Firmicutes
)、变形菌门(
Proteobacteria
)和放线菌门(
Actinobacteria
)占绝对优势,
BH
组与
BH
+共聚物组中变形菌门占比较其余
3
组小,
BH
+阿斯巴甜组中放线菌门占比较其余
4
组小。在属水平上,拟杆菌目
$24-7
组(
Bacteroidales S24-7 group_ norank
)占绝对优势;
BH
组与
BH
+共聚物组中拟杆菌属
Bacteroides
、毛螺菌科
Lachnospira
、
肠杆菌属
Enterobacter
为优势菌种;
BH
+蔗糖、
BH
+阿斯巴甜组与对照组螺杆菌属
Helicobacter
占比明显升高。因此,变形菌门数量增多、放线菌门数量减小与螺杆菌属升高很可能是甜味剂导致肠道菌群多样性升高的原因。

3.4
差异菌群分析
采用
LEfSE
分析,统计对样本划分产生显著性差异影响的群落或物种,结果见图
4
。
BH
组有
4
个显著差异菌群,分别是戈登氏杆菌属
Gordonibacter
、布劳特氏菌属
Blautia
、瘤胃球菌科
NK4A214
群(
Ruminococcaceae NK4A214 group
)、
Candidatus Soleaferrea
。
BH
+共聚物组有
4
个显著差异菌群,分别为拟杆菌目(
Bacteroidales
)、拟杆菌纲(
Bacteroidia
)、拟杆菌门(
Bacteroidetes
)、
Tyzzerella 3
。
BH
+蔗糖组有
6
个显著差异菌群,分别为嗜木聚糖真杆菌属(













