2017年,制药企业面临着非常严峻的监管形势,GMP附录《计算机化系统》生效、《药品数据管理规范》征求意见、数据可靠性缺陷泛滥、专项检查与飞行检查常态化、GMP证书不断被收、仿制药质量与疗效一致性评价、《药品生产工艺核查》征求意见、《药品生产质量管理规范生化药品附录》征求意见、《药包材、药用辅料与药品关联审评审批程序》试行、《关于药品再注册有关事项的公告》征求意见、2010版GMP第二轮认证也即将开始……
不断完善的行业法规让制药人应接不暇,如何正确面对、理解、落实、执行一系列法规?很多人困惑于此。
为了推动制药行业的发展,蒲公英联合:梅特勒-托利多、安徽华峰医药橡胶有限公司、创志机电科技发展(江苏)股份有限公司、深圳市中科圣杰净化设备有限公司、南京市恒标斯瑞冷冻机械制造有限公司,共同举办蒲公英2017系列制药技术交流会(全国中心城市巡讲,药企免费参加)。
主办单位:
蒲公英
三明高新区金沙园生物医药产业园
福建省药师协会
协办单位:
梅特勒-托利多
安徽华峰医药橡胶有限公司
深圳市中科圣杰净化设备有限公司
南京市恒标斯瑞冷冻机械制造有限公司
创志机电科技发展(江苏)股份有限公司
承办单位:凯博思、广州子路丰商务服务有限公司
会议时间:2017年9月16~17日
会议地点: 三明梅园国际大酒店(三楼多功能厅)
福建省三明市梅列区徐碧新城(沃尔玛购物广场对面)
会议报道:2017年9月16 7:30~9:00 三明梅园国际大酒店一楼大厅
参会人员:限额180人参加,(药企高层、设备/项目/质量/生产相关负责人), 每家企业限报2人,额满为止。
会议费用:免会议费,提供一天午餐和笔记本,交通住宿自理。
(温馨提示:点击图片放大查看)
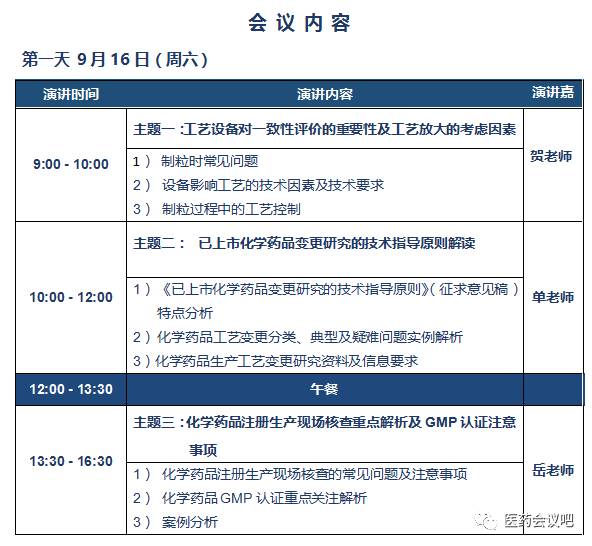
贺老师
二十多年综合药厂的工作经历,负责过设备、能源、计量和项目建设管理,负责过药品生产和委托加工,多次负责过从项目设计、施工到调试的全过程;与欧美专家一起合作过口服固体制剂、单克隆抗体、原料药等项目设计和施工;参与和负责过原料药、制剂的EMEA和FDA认证项目;带领团队做过很多药企的配液系统、水系统和血液制品系统。在设备对制粒和缓控释工艺的影响、产品质量的影响上有较深的研究。这几年先后在沈阳药科大学、中国药科大学、第三、四届亚洲制剂论坛、国际辅料会、2015和2016年ISPE年会等作过技术交流报告。
单老师
GMP认证检查专家
岳老师
资深GMP检查员
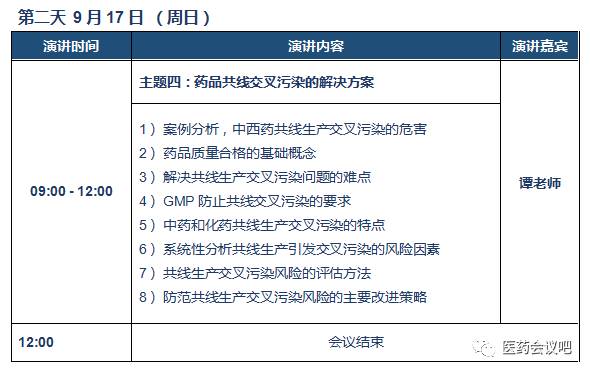
谭老师
中药学硕士;国内药品GMP专家,原CFDA飞行检查组长,参与并主持过多次飞检工作。从事药品生产监管工作长达15年,亲历组织了注射剂类药品、基本药物生产工艺和处方核查工作,掌握生产工艺变更的实际情况,熟悉药事管理的法律法规及各类药品及剂型的生产工艺;擅长药品质量体系构建、质量风险管理及厂房设施工艺布局。实践经验丰富,解决问题思路清晰、方法实用。参与编写了《新版GMP疑难问题解答》,参与起草了药品GMP《质量风险管理附录》
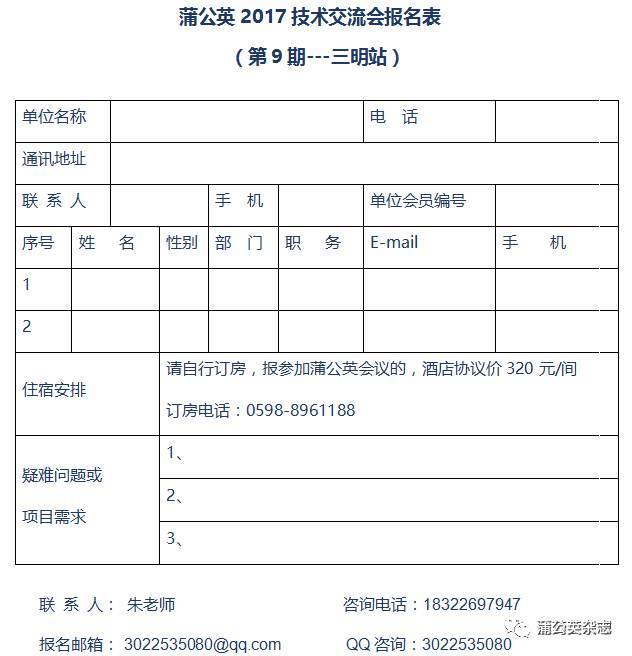
填写《报名回执表》发邮件至:[email protected]
联系人:朱老师
咨询电话:18322697947
QQ咨询:3022535080
1、参加IPPM个人会员,参加2017年微课,免费获得订制资料、专享电子杂志、有机会参加线下会员活动等资格。
2、企业会员将可以不限人次参加IPPM &凯博思一年内所有全国收费培训,并获得一次免费的现场企业内审、内训与咨询服务,同时获得其他权益。
3、更多会员权益,欢迎咨询[email protected]
咨询电话:18322697947 朱老师