
1.前言
申办者向美国食品药品监督管理局(FDA)药品审评和研究中心(CDER)递交药物生物等效性(BE)研究,以支持简化新药申请(ANDAs)和批准后补充申请。为了保证仿制药与相应的参比制剂(RLD)在治疗方面等效,仿制药必须与参比制剂药学等效和生物等效。
生物等效性定义为:在合理设计的研究中,药学等效制剂或可替换药物在相似条件下以相同摩尔剂量给药后,其活性成分或活性分子到达药物作用部位时的速度和程度没有显著性差异。有多种体内和体外的方法验证生物等效性。其中,体内药代动力学生物等效性研究是最常用的比较受试制剂与参比制剂的系统暴露特征的方法。ANDA生物等效性申报资料中,包含了四个主要的研究报告:生物分析方法、临床研究报告、统计分析和体外溶出试验。
在生物等效性研究结果的审评过程中,相关的缺陷会被指出并建议申办者更正。如果在生物等效性研究审评过程中发现有任何真实信息显示存在学术行为不端、严重违反受试者保护或者影响生物等效性数据的,FDA审评员将会要求FDA科学调查办公室(OSI)对生物等效性研究的溶出、分析和/或临床机构实施“有因”检查。应此要求,OSI将会安排日程对有违规嫌疑的机构进行检查。OSI实施检查是为了保证人类受试者的权利、安全及权益能够得到保护,并核查生物等效性研究是否符合美国联邦法规(CFR)第21章第320节生物利用度与生物等效性的要求。此程序有助于保证递交给FDA的生物等效性研究资料的完整性和可靠性。
本研究的目的是为了探讨FDA对仿制药生物等效性研究工作涉及的临床、分析及溶出研究单位实施“有因”检查的最常见原因,并且对此类检查的结果进行汇总。我们期望通过发表本研究中列出的问题,会有助于制药企业发现仿制药生物等效性研究不合规的根本原因,以避免此类问题再次发生,从而促进仅仅高质量的、安全的、有效的仿制药获得批准。
2.方法
通过对FDA内部数据库的检索,确定了从2003年1月至2011年12月(共9年)进行的与ANDA生物等效性研究相关的“有因”检查的原因。这些申请包含了包括固体口服制剂、药物透皮递释系统、咀嚼药物及口服混悬剂或肠外给药制剂等多种剂型的生物等效性试验。并按照以下方面对“有因”检查进行分析:(1)检查的原因分类;(2)被检查单位的类型,如临床、分析及溶出研究单位;(3)每年要求的检查次数,以及(4)检查结果。
要求实施“有因”检查的常见原因按下列标准进行分类(表1):
2.1数据可靠性和有效性问题
此类型问题可进一步细分为以下具体原因(表2):
a.要求实施检查以确保数据的准确性:怀疑研究结果存在偏倚,可能会导致生物等效性结论无效。
b.申办者递交的信息与FDA获得的其他信息存在分歧:FDA审评员发现公司递交的生物等效性研究结果与FDA获得的其他数据(如药代动力学参数或溶出结果)相比较时,存在显著性差异,并且此类差异并不合理。
c.研究方案偏离:公司没有保证研究按照研究计划执行。
d.方法验证不充分:研究缺乏足够的验证研究数据,例如没有进行交叉验证研究。
e.递交的信息不一致或相互矛盾:审评员发现公司报告中存在无法解释的不一致之处。
2.2再分析的样本量过多
在生物等效性研究中,样本进行再分析的比例很高,并且申请人无法提供令人信服的依据支持再分析的合理性。
2.3被检查单位此前有不良检查记录
此前对该单位检查时发现在该单位进行的研究存在数据可靠性方面的问题。要求此次检查的目的是确定正在审评的在该单位进行的研究是否也采用了类似的不规范研究操作。
2.4文件不完整
公司并没有保留足够的、准确的对确定生物等效性至关重要的文件。
2.5研究设计与实施不当
此类型的实例包括:再次给药研究中对照受试者样本量不足或者分析研究中质控浓度的选择不当。
2.6“其他”
不属于上述列出类型的其他缺陷。例如:与出现严重不良事件和/或研究验证方面的问题。
表1. FDA从2003到2011年要求实施“有因”检查的原因分类
|
原因分类
|
要求检查数
|
百分比
, %
|
|
1
|
数据可靠性与有效性问题
|
55
|
60.4
|
|
2
|
再分析的样本量过多
|
7
|
7.7
|
|
3
|
被检查单位此前有不良检查记录
|
11
|
12.1
|
|
4
|
文件不完整
|
9
|
9.9
|
|
5
|
研究设计与实施不当
|
4
|
4.4
|
|
6
|
“其他”
|
5
|
5.5
|
|
合计
|
91
|
100
|
表
2.
数据可靠性与有效性问题方面的具体原因
|
具体原因
|
要求检查数
|
百分比,
%
|
|
1.1
|
要求实施检查以确保数据的准确性
|
34
|
61.8
|
|
1.2
|
申办者递交的信息与
FDA
获得的其他信息存在分歧
|
2
|
3.6
|
|
1.3
|
研究方案偏离
|
5
|
9.1
|
|
1.4
|
方法验证不充分
|
8
|
14.5
|
|
1.5
|
递交的信息不一致
/
相互矛盾
|
6
|
10.9
|
|
合计
|
55
|
100
|
3.结果与讨论
检索到2003年1月到2011年12月 FDA 对ANDA实施了累计90项“有因”检查。这些检查涉及66个ANDA申请。在此期间,FDA共受理了7,207个ANDA申请。因此,2003年到2011年期间,被要求实施“有因”检查的比例占所有ANDA申请的0.9%。需要说明的是,除“有因”检查外,FDA还会实施“常规”检查,该检查可在没有发现行为不端的情况下启动或者作为投诉的跟踪。通常,“常规”检查用于对支持注册申请,如新药上市申请、ANDA及新药临床申请等开展研究的评估。对“常规”检查的评估不属于本文所探讨的范畴。
在通常情况下,一项典型的药代动力学生物等效性研究的参与者包含受试者服药和血样采集的临床研究单位和对血样进行分析以测定药物浓度的分析单位。
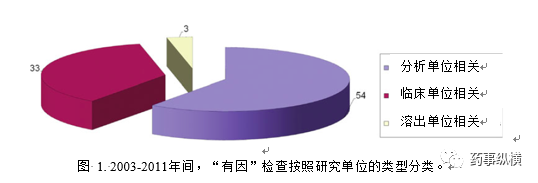
同时临床终点生物等效性研究可能会涉及多家临床研究单位。对于某些剂型,如片剂或胶囊,ANDA申办者也会进行比较溶出试验为生物等效性提供支持。在90项“有因”检查中,有54项涉及分析单位的检查(图1)。此类检查主要是针对所涉及的生物分析方法的准确性与可靠性。另有33项涉及临床研究单位的检查。此类检查旨在确定临床研究的开展是否合规,受试者的权利、安全及权益是否得到了保护。有3项检查涉及溶出研究单位。要求对溶出单位实施检查的原因是FDA审评员发现ANDA申办者递交的溶出结果与监管部门从其他申请资料掌握的参比制剂溶出的信息存在差异,甚至ANDA申办者的溶出试验报告本身就存在不一致。
我们随后对启动“有因”检查的常见原因进行了分析。通过研究发现,FDA要求实施“有因”检查最常见的原因与“数据可靠性和有效性问题”相关,占要求实施检查总数的60.4%(表1)。位列第二的要求实施“有因”检查的最常见原因是被检查单位此前有不良检查记录。这种情况下,FDA审评员要求检查的目的是为了核实以往对该单位检查时发现的数据可靠性类似不良问题在正在审评的研究中仍然存在。该原因占要求实施检查总数的12.1%。“文件不完整”也属于严重的问题,占检查总数的9.9%。
例如,如果申办者没有保留研究受试者充分且准确的病历,并且FDA审评员确认此类数据不完整可能影响研究的结果,审评员可能要求实施检查以便澄清及确认。除上述最常见的三种原因外,我们对其他导致“有因”检查的原因也进行了分析。此类原因与申请材料中发现的研究设计、研究实施、标准规程、数据报告及样本再分析缺陷有关(见表1)。对于无法明确归类的原因,我们将其列为“其他”类。属于此类型的“有因”检查包括一例受试者在空腹生物等效性研究中死亡的病例。FDA审评员对申办者的研究方案及医学记录进行检查,并未发现有严重疏忽或医疗管理不善的证据。但是审评员对于死亡事件及严重不良事件仍表示担忧。因此,为了进一步核实临床试验和医学记录、研究者的资质以及所用标准操作规程(SOPs)对评价和管理受试者安全问题和不良事件的适用性,审评员要求对其实施“有因”检查。
表
3.
FDA
要求实施“有因”检查的原因举例
|
“有因”检查的原因
|
实例
|
|
1
|
数据可靠性和有效性问题
|
见表
4
|
|
2
|
再分析的样本量过多
|
在空腹及进食研究中,大量样本分析批被中断和
/
或分析物被重分析;申办者对中断及重分析没有提供充分的依据。此外,还有大量的样本中分析物重新积分,但是申办者没有对重新积分提供充分的依据。
|
|
3
|
被检查单位此前有不良检查记录
|
此前在对该研究单位进行检查时发现许多受试者研究样本都存在完整性的问题。
|
|
4
|
文件不完整
|
申办者在研究受试者的进度记录本上没有保留充分且准确的病案历史。
|
|
5
|
研究设计与实施不当
|
再次给药研究中对照受试者样本量不足,在实施异常值检测时缺乏可用的标准操作规程。此外,分析方面的缺陷还包括了质控浓度选择不当。
|
|
6
|
“其他”
|
要求对临床机构进行检查是基于已知特定药物引起严重不良事件以及研究受试者住院。
|
表
4.
因“数据可靠性和有效性问题”而要求实施“有因”检查举例















