BioArt按:近年来,越来越多的研究发现,表观遗传调控对于许多生理过程都发挥着非常重要的作用。那么表观遗传发挥作用特别是在神经发育调控方面的分子机理是什么目前还有许多问题尚待解决。5月 17 日,中国科学院动物研究所干细胞与生殖生物学国家重点实验室焦建伟课题组在Journal of Cell Biology杂志上在线发表了题为“Histone chaperone HIRA regulates neural progenitor cell proliferation and neurogenesis via β-catenin”的最新的研究成果,该论文揭示了组蛋白伴侣HIRA能够调控大脑早期的神经发育,并发现这一功能的发挥是通过影响H3K4me3在β-catenin启动子区的活性来完成的,是组蛋白伴侣和甲基化修饰协同作用的结果,拓展了“组蛋白密码”的识别机制,为神经生物学以及疾病诊断和治疗提供了非常新颖的表观遗传学机制。此项研究是继去年该课题组在Cell Reports杂志上报道首次实现了通过Tet3的表观修饰促进神经细胞转分化之后的又一重要成果,提高了人们对于表观遗传与神经发育的了解。此外,该课题组5月19日又在Cell Death & Differentiation杂志上在线发表题为“Histone variant H3.3 orchestrates neural stem cell differentiation in the developing brain”的另外一项组蛋白变体表观调控的研究论文,报道了组蛋白变体H3.3 对胚胎早期发育过程中神经干细胞增殖分化的调控机制,详细地阐明了组蛋白变体H3.3 在脑发育过程中所起到的重要功能。

论文解读:
HIRA(Histone cell cycle regulator)最先是在酵母中被鉴定为组蛋白基因表达的一种负调因子,HIRA基因产物编码一组十分保守的蛋白家族,并且 广泛存在于酵母、果蝇、爪蟾、小鼠和人类以及植物等多种生物体当中【1】。作为组蛋白H3.3的分子伴侣,HIRA广泛分布于机体中,在核小体组装过程中发挥着重要作用,并且在没有DNA复制的条件下就可以将核心组蛋白沉积到DNA上【2】。HIRA与原肠胚的发育、受精、神经转录及可塑性都有着非常密切的关系,并且当它被敲除后会出现胚胎致死的现象【3-6】。
迪乔治综合症(DiGeorge syndrome,DGS)是一种遗传的疾病伴随着认知的损伤和学习的障碍。有意思的是,有研究提到DGS的病人较普通人患精神分裂症的风险大约高出20倍。精神分裂症是一种严重的脑部疾病,与神经发育异常相关。而许多报导指出HIRA是DGS的候选基因,它能映射到染色体DGS特定的区域【7】。
然而, HIRA对于对小鼠胚胎发育早期神经发生是否有影响呢?这是一个长期没有得到解决的重要科学问题。
该研究通过构建HIRA的敲降质粒(shRNA),分别通过体内电转及体外转染的手段,观察HIRA敲低后对于神经前体细胞增殖和分化以及细胞形态的影响,发现HIRA在神经前体细胞中表达,且HIRA敲降减少了前体细胞增殖,增加了末端分化以及细胞循环的退出,最终导致了未成熟的神经元的分化。除此之外,研究中还发现HIRA能招募H3K4三甲基转移酶Setd1A,增加H3K4me3水平,加强了β-catenin(标准的Wnt信号通路的重要成员) 启动子的活性,从而增加了β-catenin的表达(下图)。重要的是,实验证明过表达HIRA, HIRA的N端以及β-catenin能够回救HIRA敲降造成的神经发生的异常。
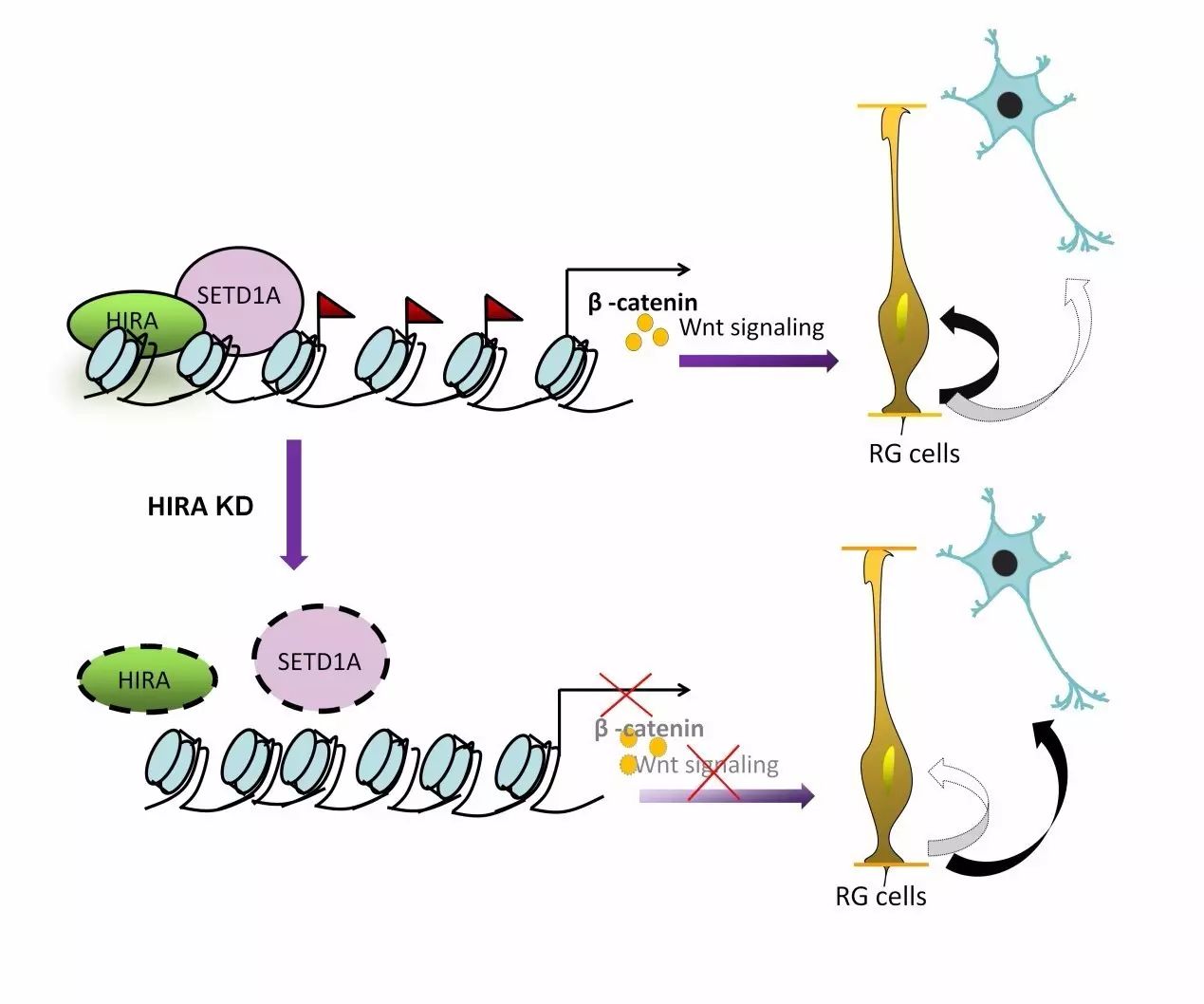
组蛋白伴侣HIRA调控神经干细胞增殖和分化机制
这些结果不仅揭示了HIRA/H3K4me3/β-catenin 在神经前体细胞(NPC)增殖中的重要调控作用,同时发现了神经系统发育,组蛋白表观调控以及早期神经发育中组蛋白修饰之间的新的联系。
据悉,该工作主要是由博士生李妍昕完成的,通讯作者为焦建伟研究员。该研究得到了国家重大基础研究计划,国家自然科学基金和中科院干细胞先导专项的资助。
几乎在同时,该课题组5月19日又在Cell Death & Differentiation杂志上在线发表题为“Histone variant H3.3 orchestrates neural stem cell differentiation in the developing brain”的另外一项组蛋白变体表观调控的研究论文。报道了组蛋白变体H3.3 对胚胎早期发育过程中神经干细胞增殖分化的调控机制,详细地阐明了组蛋白变体H3.3 在脑发育过程中所起到的重要功能。
与常规组蛋白形成的染色质结构相比,组蛋白变体可以形成一些独特的染色质高级结构,进而行使不同的生物学功能。目前已有的报道表明组蛋白变体H3.3对于生物体生存是必须的,H3.3敲除的小鼠会在胚胎发育时期致死,并且H3.3蛋白是由两个基因同时编码的,这就导致经典的条件性敲除模型的获取非常困难。本项研究综合利用了小鼠体内胚胎电转,细胞生物学和基因表达测序分析等多种技术手段,从体外和体内两个方向,对组蛋白变体H3.3胚胎早期发育过程中神经干细胞增殖分化的调控机制这两个重要的生物学过程中起到的作用进行了深入的研究。发现H3.3与大脑皮层发育的关系,确定了GLI zinc finger家族成员GLI1作为H3.3的下游调控分子参与到神经干细胞命运调控过程。

组蛋白变体H3.3对神经干细胞调控机制
据悉,该篇论文的第一作者为夏文龙(中国科学技术大学和中国科学院动物研究所联合培养博士生),焦建伟研究员为本文通讯作者。
焦建伟课题组主要从事神经干细胞的增殖和分化研究,以及非神经细胞到神经细胞的重编程和转分化研究。其中一个比较重要的研究方向是研究表观遗传分子调控调控神经干细胞的增殖和神经元产生机制,近几年来该课题组在这方面也取得了一些列的成果,包括:“Ezh2调控神经干细胞及神经元产生和学习记忆”(Journal of neuroscience ,2014);“首次实现了通过Tet3的表观修饰促进神经细胞转分化”(Cell Reports,2016);“组蛋白分子伴侣调控早期神经发育”(Journal of Cell Biology,2017);“组蛋白变体H3.3对神经干细胞分化调控”(Cell Death & Differentiation, 2017 )。此外还研究了miRNAs对神经干细胞增殖分化的影响(EMBO Rep,2014);自噬对神经干细胞分化的调控(EMBO Rep,2014)等。
参考文献:
1、Lamour, V., Lécluse, Y., Desmaze, C., Spector, M., Bodescot, M., Aurias, A., ... & Lipinski, M. (1995). A human homolog of the S. cerevisiae HIR1 and HIR2 transcriptional repressors cloned from the DiGeorge syndrome critical region. Human molecular genetics, 4(5), 791-799.
2、D. Ray-Gallet, J.P. Quivy, C. Scamps, E.M.D. Martini, M. Lipinski, G. Almouzni HIRA is critical for a nucleosome assembly pathway independent of DNA synthesis Mol. Cell, 9 (2002), pp. 1091–1100
3、Szenker, E., Lacoste, N., & Almouzni, G. (2012). A developmental requirement for HIRA-dependent H3. 3 deposition revealed at gastrulation in Xenopus. Cell reports, 1(6), 730-740.
4、Majumder, A., Syed, K. M., Joseph, S., Scambler, P. J., & Dutta, D. (2015). Histone chaperone HIRA in regulation of transcription factor RUNX1. Journal of Biological Chemistry, 290(21), 13053-13063.
5、Nashun, B., Hill, P. W., Smallwood, S. A., Dharmalingam, G., Amouroux, R., Clark, S. J., ... & Kelsey, G. (2015). Continuous histone replacement by Hira is essential for normal transcriptional regulation and de novo DNA methylation during mouse oogenesis. Molecular cell, 60(4), 611-625.
6、Loppin, B., Bonnefoy, E., Anselme, C., Laurençon, A., Karr, T. L., & Couble, P. (2005). The histone H3. 3 chaperone HIRA is essential for chromatin assembly in the male pronucleus. Nature, 437(7063), 1386-1390.
7、Lorain, S., Demczuk, S., Lamour, V., Toth, S., Aurias, A., Roe, B. A., & Lipinski, M. (1996). Structural Organization of the WD repeat protein-encoding gene HIRA in the DiGeorge syndrome critical region of human chromosome 22. Genome research, 6(1), 43-50.
8、Zhang, J., Chen, S., Zhang, D., Shi, Z., Li, H., Zhao, T., ... & Jiao, J. (2016). Tet3-Mediated DNA Demethylation Contributes to the Direct Conversion of Fibroblast to Functional Neuron. Cell Reports, 17(9), 2326-2339.

焦建伟,博士,现任中科院动物所研究员。2002年在北京大学生命科学学院获得博士学位,2002年到2007年在美国哈佛医学院从事博士后研究,2008年被提升为Instructor。2009年到2011年在中科院神经所任研究员。2011年8月加入中科院动物所,任研究员,神经干细胞增殖与分化研究组组长。入选中国科学院“百人计划”,是中国科学院干细胞与再生医学先导专项总体组成员,是王宽诚率先人才计划“卢嘉锡国际团队”负责人。目前承担国家重大科学研究计划项目,国家自然科学基金项目,中科院干细胞战略先导项目等。研究组主要研究方向是神经干细胞机制研究,近年来的主要工作包括:(1) 揭示染色体重塑基因影响神经干细胞自我更新;(2)发现组蛋白甲基酶调控神经前体细胞产生,影响学习记忆;(3) 发现 DNA 甲基转移酶 Tet3 在早期神经元发育中的重要作用;(4) 实现了小鼠和人神经元转分化,以上发现丰富和完善了神经发育的表观遗传调控理论。近年来以第一作者或通讯作者身份在包括PNAS,J Cell Biol,EMBO J,EMBO Rep ,Cell Reports, Cell Research等国际杂志上发表论文30多篇。


BioArt,一心关注生命科学,只为分享更多有种、有趣、有料的信息。关注请长按上方二维码。投稿、合作、转载授权事宜请联系微信ID:fullbellies或邮箱:[email protected]。















