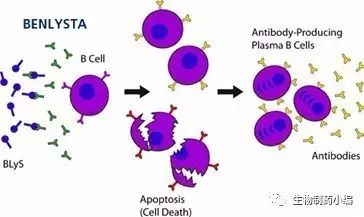
Benlysta (Belimumab)新剂型获批用于SLE的治疗
7月22日,美国,GSK公司今日宣布FDA已经批准了新的皮下注射剂型用于成人系统性红斑狼疮(SLE)的治疗。SLE是一种慢性、无法治愈的自身免疫系统疾病。
此次获批意味着Benlysta (Belimumab)是用于SLE治疗的第一个可以皮下自我注射的药物。Benlysta是目前被批准用于SLE治疗的唯一用药,其是一种人源化单克隆抗体,能够特异性靶向BLyS。通过结合BlyS,Benlysta能够抑制B细胞包括自身反应性B细胞的生存,减少B细胞分化为浆细胞产生免疫球蛋白。
CHMP建议批准KEYTRUDA®(Pembrolizumab)用于局部晚期或转移性尿路上皮癌的治疗
7月22日,美国,Merk公司近日宣布CHMP已经推荐KEYTRUDA®(Pembrolizumab)用于局部晚期或转移性尿路上皮癌的治疗。具体说,KEYTRUDA® (Pembrolizumab)被推荐用于那些既往接受过铂类药物化疗或对于铂类药物化疗不耐受的病人。后续欧盟委员会将会进行市场营销授权的审批,最终的结果有望在今年下半年得出。
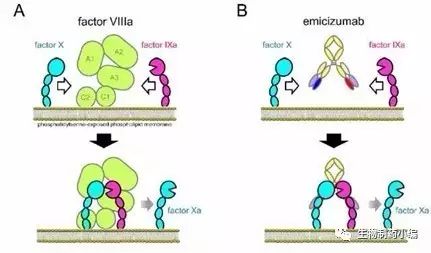
Chugai Pharmaceutical递交了有关Emicizumab预防血友病出血的新适应症申请
7月21日,日本,Chugai Pharmaceutical今日宣布其已经向卫生劳动福利部(MHLW)递交了有关Emicizumab用于血友病A患者出血的常规预防用药的申请。此项申请是基于两项3期临床研究,数据显示Emicizumab用于血友病A患者的出血预防效果显著且安全。有关数据的结果已经在新一期的NEJM杂志发表。
BAY949343治疗恶性胸膜间皮瘤的临床试验未达到临床终点
7月21日,德国,拜耳公司今日宣布该公司一项治疗复发性恶性胸膜间皮瘤(MPM)的2期临床试验没有获得主要终点。这项试验旨在评价其在研的抗肿瘤药物BAY949343用于单药治疗复发性恶性胸膜间皮瘤的有效性和安全性,其主要终点无进展生存周期没有达到,药物安全和耐受性方面的数据与之前的数据相一致。
恶性胸膜间皮瘤(MPM)是一种罕见的、致命的癌症,是胸膜原发肿瘤中最多见的类型。临床表现与侵袭行为有关,它通常局部侵袭胸膜腔及周围结构,如果不治疗,中位生存期不足一年,目前的发病原因和机制仍不清楚。
BAY949343是一种靶向间皮素的抗体药物偶联物。具体机制表现为抗体与肿瘤细胞表面的间皮素相结合,然后进入细胞,经降解酶分解释放毒性药物DM4,引起细胞周期阻滞和肿瘤细胞凋亡。在之前的1其临床中,BAY949343表现出良好的抗肿瘤活性和药物安全性。
AbbVie收到了来自CHMP关于HUMIRA® (Adalimumab)儿童腹膜炎的积极意见
7月21日,美国,AbbVie公司今日宣布CHMP已经就HUMIRA® (adalimumab)治疗儿童非传染性腹膜炎给出了积极意见。
HUMIRA® (Adalimumab)目前在欧洲被批准用于成人中度至重度活动性进展性类风湿关节炎、重度活动性强直性脊柱炎(AS),中度至重度慢性斑块型银屑病,中度至重度活动性银屑病关节炎、Crohn病、中度至重度活动性溃疡性结肠炎和非传染性成人腹膜炎。如今更为系统性的数据证实HUMIRA® (Adalimumab)对于儿童患者安全有效,可以进一步拓宽适应症的人群。
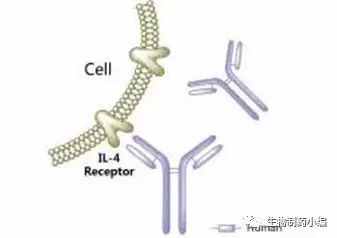
Sanofi和Regeneron收到了来自CHMP关于Dupixent®(Dupilumab)治疗中重度特应性皮炎的积极意见
7月21日,美国,Sanofi和Regeneron公司今日宣布CHMP就Dupixent®(Dupilumab)治疗中重度过敏性皮肤炎给出了积极意见。
特应性皮炎的特征为患者或其家族中可见明显的“特应性”特点:①容易罹患哮喘、过敏性鼻炎、湿疹的家族性倾向;②对异种蛋白过敏;③血清中IgE高;④血液嗜酸性粒细胞增多。典型的特应性皮炎具有特定的湿疹临床表现和上述四个特点。临床分三期:婴儿期呈急性或亚急性湿疹状;儿童期及青年期则为亚急性或慢性湿疹状。去除并避免可能的致病因素,对症治疗是目前临床主要的治疗策略:包括润肤膏的常规应用、局部外用糖皮质激素、合并感染的抗感染治疗、非激素类的局部免疫调节剂、抗组胺药口服治疗、光疗、大剂量静脉注射免疫球蛋白等。
Dupixent® (Dupilumab)是一种人源化单克隆抗体,能够特异性的抑制两个关键蛋白IL-4和IL-13信号的过度激活。如果此项适应症获得批准,患者将减少对于外用皮质类固醇药物的依赖。
Merk公司收到了来自CHMP关于Avelumab治疗转移性默克尔细胞癌的积极意见
7月21日,德国,Merk公司今日宣布其关于(BAVENCIO®)单药治疗转移性默克尔细胞癌的申请已经获得了CHMP的积极意见。欧盟委员会最迟将在今年下半年给出审评意见。
默克尔细胞癌(MCC)是原发于皮肤的一种高度恶性肿瘤,1972年Toker首先描述并用”梁状癌”命名,因其肿瘤细胞质内有神经内分泌颗粒出现,也被称作原发于皮肤的神经内分泌癌主要发生于老年人的头颈部及四肢,具有独特的超微结构改变和免疫组化染色特征。手术切除后,易局部复发,也可远处转移,在皮肤源性的肿瘤中,它的病死率最高。在病理诊断上,易与其他恶性肿瘤相混淆。
Avelumab (BAVENCIO®)是一种靶向PD1的人源化单克隆抗体,可以增强机体的适应性免疫和固有免疫。
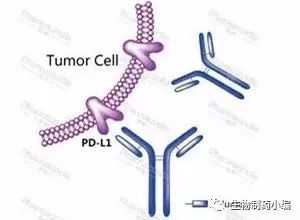
Kyntheum在欧洲获批上市用于中重度斑块状银屑病的治疗
7月20日,英国,AstraZeneca和MedImmune公司今日宣布其合作伙伴LEOPharma已经获得有关Kyntheum治疗银屑病在欧洲各国的营销授权申请。
银屑病是一种常见的慢性、免疫介导的炎症性皮肤病,影响着全球1亿多人的健康,其中欧洲就有超过1400万的患者。银屑病虽然只对皮肤造成一些影响,但同时给患者带来的社会和心理压力是无法估量的。
Kyntheum是第一个靶向IL-17受体配基的生物药,通过与皮肤细胞相应受体的特异性结合,阻断IL-17炎症因子的信号传导,从而阻断皮肤斑块的形成。
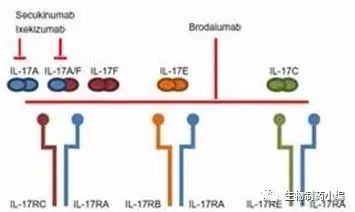
GSK向Emergent BioSolutions转让了治疗炭疽病的药物Raxibacumab
7月19日,美国,Emergent BioSolutions今日宣布其已经与GSK达成协议购买Raxibacumab(一种用于治疗和预防吸入式炭疽病的单克隆抗体)。近期,Emergent BioSolutions已经与生物医学高级研究和发展管理局(BARDA)达成一项1亿3000万美元的订单合同,为的是在未来的几年里向美国国家战略储备供应此产品。此项交易的现金部分包括7600万美元的预付款和2000万美元的产品销售相关费用,所有费用将在2019年之前全部结清。
FDA已经受理了Aimovig™ (Erenumab)的生物许可申请
7月20日,美国,Amgen公司近日宣布FDA已经受理了Aimovig™ (Erenumab)的生物许可申请。Aimovig™ (Erenumab)计划上市用于偏头痛的治疗,如果获批,Aimovig™ (Erenumab)有望成为第一个靶向降钙素基因相关肽(CGRP)受体的单克隆抗体药物。
FDA增加Hizentra®适应症用于CIDP的预防复发治疗
7月19日,美国,CSLBehring近日宣布FDA已经批准增加Hizentra®的适应症用于慢性炎性脱髓鞘性多神经病(CIDP)的维护治疗以防止神经肌肉损伤的复发。此项适应症的获批是基于一项大样本随机对照研究试验,试验旨在评价Hizentra®用于CIDP患者后期维护治疗的有效性和安全性。
CDIP是以周围神经近端慢性脱髓鞘为主要病变的自身免疫性运动感觉性周围神经病,属于慢性获得性脱髓鞘性多发性神经病(ADP),呈慢性进展或缓解--复发病程,大部分患者对免疫治疗反应良好。
早在2013年Hizentra®就获批用于原发性免疫缺陷症(PI)患者的抗感染治疗,该药是首个也是唯一一种20%皮下注射免疫球蛋白药物,能够周复一周地维持血清IgG的水平。目前概要已经在全球46个国家和地区上市并使用,药物的有效性和安全性良好。
OSE Immunotherapeutics获得920万欧元投资用于OSE-172的安全性及疗效评价
7月19日,法国,OSE Immunotherapeutics今日宣布该公司即将获得来自Bpifrance未来项目的920万欧元的投资用以研发新的免疫检查点抑制剂OSE-172抗体药物。此次基于肿瘤免疫疗法的新一代免疫检查点抑制剂研发项目EFFI-CLIN将由OSE Immunotherapeutics自己主导。
肿瘤生长过程中,会分泌特定的因子,募集或产生相应抑瘤细胞,以阻止免疫系统发挥抗肿瘤的功能,目前已经确定的细胞有MDSC或髓源性抑制细胞,TAM或肿瘤相关巨噬细胞。
OSE Immunotherapeutics是第一个将骨髓细胞的SIRP-alpha作为靶点的公司。目前公司已经开发出了SIRP-alpha拮抗剂OSE-172能够改善肿瘤微环境,激活抗肿瘤效应细胞功能。
现在的肿瘤免疫疗法还是基于T淋巴细胞检查点抑制剂领域,此类抑制剂中的几个产品已经取得了革命性的突破,能够持续的减少肿瘤体积。但确定的是临床的需求仍没有被满足,因为仍有患者对于治疗无应答,或者存在复发的情况。目前将T细胞作为靶点的药物已经有很多经受临床的验证,但是将存在于肿瘤微环境中的骨髓细胞作为靶点的研究都还处在初期阶段,急需进一步的探索,以验证临床疗效。
FivePrime Therapeutics启动了FPA144治疗晚期胃癌的1期临床研究
7月17日,美国,FivePrime Therapeutics今日宣布该公司已经启动了一项FPA144治疗晚期胃癌和胃食道癌的1期临床试验,此项试验旨在评价药物的安全性耐受性和相关药代动力学参数。未来公司还将计划FPA144作为一线用药联合化疗用于FGFR2b过表达的胃癌的治疗。
FPA144是能够靶向FGFR2b的人源化单克隆抗体药物,FGFR2b是一种成纤维细胞因子生长受体。过表达FGFR2b的肿瘤其临床预后较差,FPA144可以募集NK细胞,增强抗体依赖的细胞毒作用,控制肿瘤进程,改善临床预后。

Sutro的抗体偶联药物STRO-001在预临床试验中展现出极高的抗肿瘤活性
7月17日,美国,Sutro Biopharma公司近日宣布其在研发的靶向CD74的抗体药物偶联物在非霍奇金淋巴瘤和多发性骨髓瘤的疾病模型表现出极高的抗肿瘤活性。预临床的数据显示STRO-001能够显著抑制肿瘤生长并在最终彻底清除异种移植的肿瘤。鉴于此优异的表现,Sutro计划在2018年开展该药物的1期临床试验。
CStone Pharmaceuticals的CS1001获得了CFDA颁发的临床试验批件
7月17日,中国,CStone Pharmaceuticals公司今日宣布经过8个月的资格审查,该公司在研的PD1抗体药物CS1001已经获得了CFDA临床试验申请的批准,目前该药物是中国第一个批准进入临床试验的人源化全长抗PD1单克隆抗体。CS1001是由CStone Pharmaceuticals公司独立自主研发的PD1抗体药物,前期的数据显示CS1001可以显著降低患者的免疫原性风险和药物毒性风险。目前公司计划开展其用于在中国发病率较高的晚期癌症试验。
Apexigen公司治疗非小细胞肺癌和黑色素瘤的临床试验有第一位病人入组
7月17日,美国,Apexigen公司今日宣布日前该公司正在开展一项新的多中心1b/2期临床试验已经有第一个病人入组进行试验。此项临床试验是由Apexigen和BMS公司联合开展,旨在评价APX005M联合Opdivo (Nivolumab)作为二线用药治疗转移性非小细胞肺癌和黑色素瘤的有效性和安全性,试验的主要临床终点是药物的安全性和总有效率。
APX005M是一种全新的人源化单克隆抗体,通过肿瘤微环境中的APC细胞,机会机体的抗肿瘤免疫反应。APX005M能够选择性靶向肿瘤组织的CD40,并激活相应的肿瘤免疫反应,同时初期的数据证实药物的安全耐受性良好。
EVENITY™(Romosozumab)用于骨质酥松症的上市申请已经获得FDA的最新回复
7月17日,Amgen和UCB公司今日宣布FDA针对之前EVENITY™(Romosozumab)治疗绝经后骨质酥松的生物许可申请作出了完整回复。在此之前公司提交了有关药物有效性和安全性的3期临床数据,在后续的再次提交中,FDA要求提供更为详细和具体的安全性相关数据,包括对于男性骨质酥松症相关的疗效和安全性数据。
EVENITY™(Romosozumab)是由Amgen和UCB公司共同研发的单克隆抗体药物,目前还未被批准用于骨质酥松的治疗。该药物可以抑制硬化蛋白的活性,通过减少骨骼流失并增加骨骼吸收以帮助骨骼形成,同时临床数据显示EVENITY™(Romosozumab)可以显著减低患者骨折的风险。
欢迎加入小编团队成为小编一员
请加小编微信号:wuwenjun7237
如有技术解读、行业洞见愿意分享
欢迎投稿到小编邮箱:
[email protected]














