 关注小药说药,一起成长!
关注小药说药,一起成长!
肺癌是最常见的肿瘤疾病,全世界每年有超过200万例病例和近180万人死亡,其中大约85%的肺癌患者被诊断为非小细胞肺癌(
NSCLC
),肺腺癌(
LUAD
)和肺鳞状细胞癌(
LUSC
)是NSCLC最常见的亚型。过去的20年中,NSCLC的治疗已从经验性使用细胞毒性药物发展为通过靶向疾病特定分子亚型的耐受性及效果更好的方案。
NSCLC是肿瘤学中个性化药物开发的前沿,其生物标志物驱动疗法的数量不断增加,旨在治疗具有驱动突变的肿瘤,如EGFR、ALK、ROS1、BRAF、MEK、MET、RET、KRAS抑制剂,以及最近的HER2抑制剂。此外,免疫检查点抑制剂(
ICIs
)也彻底改变了NSCLC的治疗模式。
无驱动突变的转移性
NSCLC
对于无驱动突变的转移性NSCLC,靶向PD-1或PD-L1的ICI是一线治疗的基石,用作单药治疗,与化疗联合使用,或与其他ICI联合使用。方法的选择主要取决于PD-L1表达水平和组织学亚型。在肿瘤中PD-L1高水平表达(
≥50%
)的患者中,最常见的是PD-1抑制剂pembrolizumab (
Keytruda
);PDL1抑制剂atezolizumab(
Tecentriq
)和PD-1抑制剂cemiplimab(
Libtayo
)。
肿瘤PD-L1低表达(
1-49%
)或阴性(
<1%
)的患者通常接受pemrolizumab联合铂类化疗,或不太常见的atezolizumab联合铂类化疗。PD-1抑制剂nivolumab(
Opdivo
)和CTLA4抑制剂ipilimumab(
Yervoy
)被批准用于肿瘤PD-L1表达≥1%的患者,提供了无化疗的选择。无论PD-L1表达如何,Nivolumab联合ipilimumab和有限化疗也被批准。
2022年11月,FDA基于III期POSEIDON试验,批准PD-L1抑制剂durvalumab(
Imfinzi
)联合tremelimumab(
Imjudo
)和铂类化疗用于无EGFR突变或ALK易位的转移性NSCLC。同一个月,FDA根据EMPOWER-Lung III期试验,批准了cemiplimab联合铂类化疗作为
无EGFR、ALK或ROS1异常的
转移性NSCLC的一线治疗方案。
具有驱动突变的转移性NSCLC
EGFR酪氨酸激酶抑制剂(
TKI
)osimertinib(
Tagrisso
)是治疗EGFR突变NSCLC的标准药物,alectinib(
Alecensa
)是治疗ALK易位阳性NSCLC的标准药物。其他几种EGFR和ALK TKI也可用一线或后线治疗。EGFR/cMET双特异性抗体amivantamab(
Rybrevant
)和EGFR TKI mobocertinib(
Exkivity
)是EGFR外显子20插入突变患者的选择,这些患者对经典EGFR抑制剂反应不佳。
ROS1抑制剂包括crizotinib(
Xalkori
)和entrectinib(
Rozlytrek
)被批准用于ROS1突变的NSCLC。BRAF抑制剂dabrafenib(
Tafinar
)和MEK抑制剂trametinib(
Mekinst
)的组合被批准用于BRAF-V600E突变的 NSCLC。Capmatinib(
Tabrecta
)和tepotinib(
Tepmetko
)可用于MET外显子14跳跃突变患者,而selpercatinib(
Retevmo
)和pralsetinib(
Gavreto
)可用于RET融合的NSCLC。
Sotolasib(
Lumakras
)是首个获得FDA加速批准的KRAS抑制剂,用于经先前治疗的转移性KRAS-G12C NSCLC。根据第二阶段的KRYSTAL-1试验,于2022年12月FDA加速批准了adagrasib(
Krazati
),adagrasib与多西他赛的III期试验正在进行中。2022年8月,基于二期DESTINY-Lung02试验,抗体偶联药物trastuzumab deruxtecan(
Enhertu
)成为首个获得FDA加速批准的HER2靶向治疗用于HER2突变转移性NSCLC。使用生物标志物靶向疗法治疗的驱动基因突变患者可以在后线进行免疫治疗。
不可切除的局部晚期NSCLC
不可切除的III期NSCLC采用多模式治疗,包括序贯或同时的放化疗。Durvalumab被批准用于该条件下放化疗后的治疗,但在欧洲仅限于PD-L1表达≥1%的患者。durvalumab和其他上市ICI的此类临床试验正在进行中。
局限性和可切除的局部晚期NSCLC
局部I–II期NSCLC患者接受具有治疗目的的手术或放疗,而大多数IB或II期NSCL患者接受辅助双重化疗。可切除的III期NSCLC患者主要采用新辅助化疗(
放疗
)或手术治疗,然后进行化疗或放化疗。在IB–IIIA期非小细胞肺癌中,EGFR外显子19缺失或外显子21替代突变的患者有条件在切除后接受osimertinib治疗。atezolizumab被批准用于某些切除和化疗后PD-L1阳性的II–IIIA期NSCLC患者。2022年3月,FDA批准了用于可切除NSCLC的新辅助nivolumab加铂类化疗。其他一些已上市的ICI和生物标志物驱动疗法正在评估中。
根据
Clarivate
的数据,截至
2023
年
1
月
12
日,
NSCLC
拥有肿瘤学领域最具活力的管线之一,有
330
多种药物正在积极的临床开发中。
后期管线跨越了广泛的作用机制和药物类别。
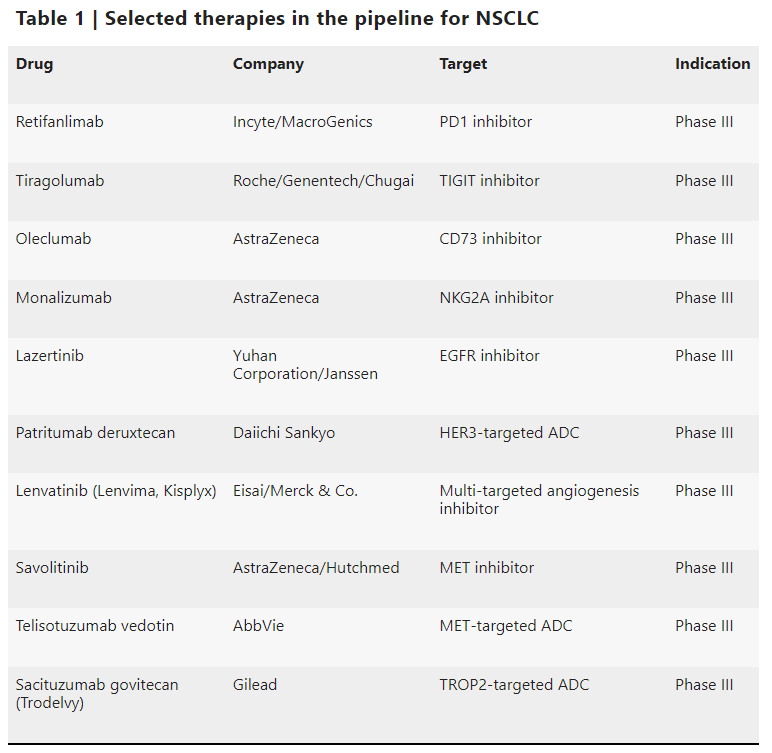
ICI在NSCLC管线中占有重要地位。许多新型PD-1/PD-L1抑制剂正处于III期开发阶段,例如retifanlimab。TIGIT是一种新的免疫检查点靶点,在三期中有几个候选。尽管在两个三期试验(
SKYSCRAPER-01和SKYS CRAPER-02
)中,以 tiragolumab为基础的联合疗法遭遇挫折,但tiragolumab联合atezolizumab对比durvalumab的III期试验(
SKYSCRAPER
)仍在进行中。其他新型检查点靶标包括CD73和NKG2A,III期 PACIFIC-9 试验正在测试oleclumab(
抗CD73
)或monalizumab(
抗NKG2A
)联合durvalumab在不可切除的III期NSCLC患者中的效果。
此外,在之前未经治疗的具有某些EGFR突变的转移性NSCLC的MARIPOSA III期试验中,正在评估EGFR TKI lazertinib联合amivantamab 与osimertinib的对比。第三阶段MARIPOSA-2试验正在测试amivantamab联合化疗加或不加lazertinib用于先前经osimertinib治疗的患者。HER3靶向ADC patritumab deruxtecan用于某些EGFR突变型的III期NSCLC患者,正在进行II期临床试验(
HERTHENA-Lung01
)。
多靶向血管生成抑制剂lenvatinib正在转移性NSCLC中进行评估。III期LEAP-008试验比较了既往免疫治疗和化疗后,lenvatinib单药或联合pembrolizumab与多西他赛的疗效。第三阶段LEAP-006试验正在评估将lenvatinib添加到pembrolizumab和化疗中作为一线治疗对无进展生存期和总生存期的益处。但在LEAP-007的III期试验中,PD-L1阳性的既往未治疗患者中,lenvatinib加pembrolizumab未能提高总生存率,这给LEAP-006蒙上了一层阴影。
MET是EGFR TKI获得性耐药的生物标志物。三期SAFFRON试验正在先前经osimertinib治疗的EGFR突变和MET过表达的转移性NSCLC患者中,评估MET抑制剂savolitinib联合osimertinib治疗中的效果。Telisotuzumab vedotin是一种抗MET ADC,目前正处于III期临床开发阶段,用于先前治疗过的MET过表达的转移性NSCLC患者。
两种TROP2靶向ADC,sacituzumab govitecan和datopotamab deruxtecan,正在先前经免疫治疗和化疗后的转移性NSCLC患者中进行III期临床试验。datopotamab deruxtecan还在其他III期试验中,与一线pembrolizumab联合或不联合化疗进行测试。

















