国际制药项目管理协会
[2017]19号
2017注射剂仿制药一致性评价与研发技术指导及质量控制高级培训班
尊敬的同仁们:
国家注射剂仿制药质量一致性评价工作即将开展,为帮助大家掌握其中关键技术要点和药学研究内容,熟知相关政策法规与技术要求,顺利通过一致性评价工作,同时提高注射剂仿制药研发技能与质量管理水平,增强药品安全与有效性。
为此, 国际制药项目管理协会(IPPM)定于
2017年10月19-21日
在北京市举办【2017注射剂仿制药一致性评价与研发技术指导及质量控制高级培训班】
本次培训将邀请业内资深专家做剖析讲演,由于授课讲师具有丰富的从业经验和良好的语言表达能力,所以坚信此次培训一定会让您受益匪浅,获益良多,精彩不容错过!诚挚欢迎大家参加交流学习,现有关培训事项通知如下;
主办单位:
国际制药项目管理协会(IPPM)
北京乔氏鑫源会议服务有限公司
支持单位:
北京安森博医药科技有限公司
天津冠勤医药科技有限公司
一、培训时间地点:
培训时间:2017年10月19-21日 周四-周六(培训两天、19日全天报到)
培训地点:北京市 (详细地点、报名后另行通知)
二、培训讲师介绍:
周老师:
国家仿制药质量一致性评价专家组成员 、国家药典委员会委员
韩老师:
国际实战派技术专家, 曾任诺华制药(Novartis)主任研究员、梯瓦制药(Teva/Barr) 全球研发项目项目总管。
丁老师:
资深专家 现任国际制药企业质量高管, 从事注射剂生产质量管理、工艺开发与认证工作20多年,实战经验丰富。
三、培训形式说明:
1、专题剖析指导,人性化教学模式,现场时刻互动答疑,有问必答!
2、请参加学员提前准备提问事项,现场进行有序提问,谢谢配合!
3、招募合作赞助单位,提供企业形象展示与产品宣传,可致电详谈!
四、培训课程内容
1.注射剂仿制药质量一致性评政策解读与分析
2.注射剂仿制药质量一致性评价中关键技术要点与控制策略
3.如何将《ICH指导原则》灵活运用于“注射剂仿制药质量一致性评价”中的质量对比研究工作
4.深度剖析注射剂仿制药各剂型关键性评价指标
5.注射剂仿制药一致性评价产品现场核查要点与注意事项
6.注射剂仿制药国际研发技术指导与研究实践
7.注射剂的处方设计与工艺研究及案例分析
8.如何根据ICHQ8开发无菌注射剂处方和工艺
9.注射剂药学研发的技术要点与案例分析
10.注射剂研发过程中的技术转移、工艺放大及工艺验证
11.注射剂处方工艺变更的技术要求及案例分析
12.注射剂质量稳定性研究与技术要点
13.注射剂原料药选择要求与质量控制要点
14.注射剂辅料选择要求与质量控制要点
15.注射剂包装材料的技术要求与相容性研究实践
16.注射剂药用辅料与包材关联审评技术要求与问题解析
17.注射剂生产质量关键工艺控制点剖析指导
18.注射剂交叉污染控制措施与案例分析
19.注射剂二合一认证流程与技术指导
20.注射剂无菌保证工艺研究与验证-问题剖析
21.注射剂质量风险分析与控制方案
22.欢迎您携带问题而来,与授课讲师现场互动探讨答疑。
课时安排:
10月20-21日
上午:9:00-12:00点
午休
下午:14:00-17:00
五、培训费用说明:
1、培训费:2500元/人;包含(专家费、资料费、 场地费、茶歇等)食宿统一安排,费用自理。 会务费可现场交纳或提前汇款
2、IPPM会员单位 2000元/人;IPPM会员办理咨询:杨老师13922129660
六、培训咨询与报名:
乔老师:13269770767
邮 箱:[email protected]
电话/传真:010-51713248
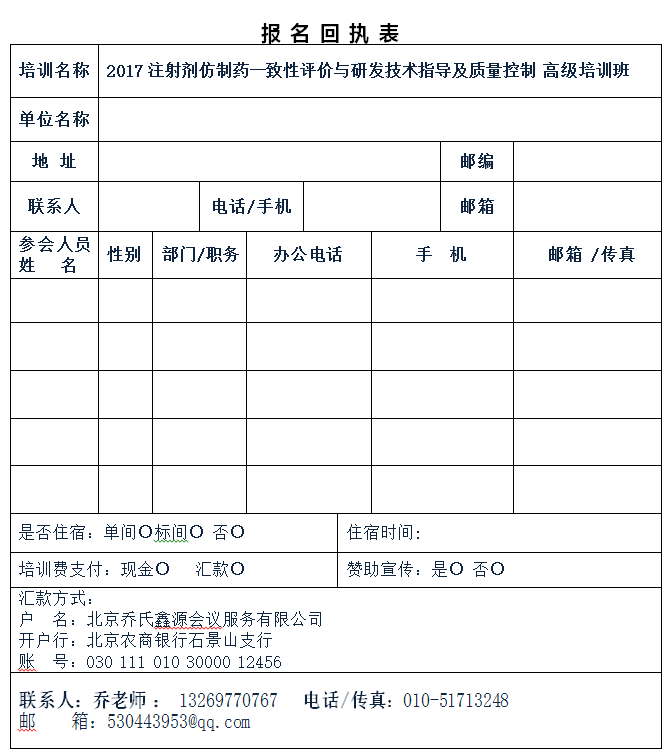
下页附件:报名回执表