2018年3月7日,台湾中裕新药的抗艾滋病单克隆抗体药物
Ibalizumab
的生物制品许可申请(
BLA
)获美国食品药品监督管理局(
FDA
)批准。该药物是
FDA
在今年批准的第一款抗体药物、第一款创新生物药,也是
10
年来获批的首款艾滋病创新疗法。这是广大艾滋病患者的福音,也标志着中裕新药与药明生物的合作取得了圆满的成功。
药物的基本信息和
临床
研发历程
Ibalizumab
最早是由唐南珊和张子文两位教授创办的
Tanox
公司从
B
iogen
公司引进,并进行临床阶段的开发(当时的项目代号为
TNX-355
)。该药物通过结合人的
T
细胞表面的
CD4
蛋白,阻止人免疫缺陷病毒(
HIV
)入侵
T
细胞,从而保护
T
细胞不被攻击,维护机体免疫系统,进而利用机体自身的免疫系统清除病毒。相比于现有的抗逆转录病毒药物,该药物在机理上是一个很大的创新。
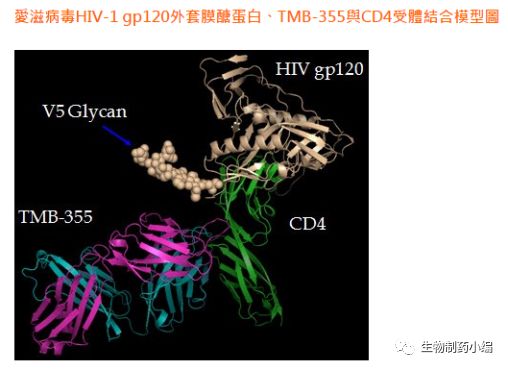
(图片来源:中裕新药官网)
在
2007
年
Tanox
被
G
enentech
收购之前,该药物的临床试验历程如下:
2007
年,
Tanox
被
G
enentech
收购,随后宇昌生技(中裕新药前身)从
Genentech
处购得
TNX-355
(之后将项目代号改为
TMB-355
),并启动临床试验。之后的临床试验历程如下:
-
2008
年
5
月
——
静脉注射剂型第二个二期临床试验启动
-
2011
年
6
月
——
静脉注射剂型第二个二期临床试验完成
-
201
4
年
1
0
月
——
该药
获
FDA
孤儿药
资格认定
-
2015
年
3
月
——
该药
获
FDA
突破性
疗法认定
-
2015
年
8
月
——
静脉注射剂型的三期临床试验启动
-
2016
年
10
月
——
静脉注射剂型的三期临床试验完成(委托
Theratechnologies Inc.
)

(
Theratechnologies Inc.
公布的
Ibalizumab
的三期临床数据)
-
2017
年
5
月
——
中裕新药就该药物正式完成向
FDA
的
BLA
申请
-
2017
年
7
月
——
该药
获
FDA
优先
审评资格
-
2018
年
3
月
——
静脉
注射剂型
获
FDA
批准
上市
除了
TMB-355
的静脉注射剂型之外,中裕新药还开发了该药物的皮下注射和肌肉注射剂型,这两个剂型也都在临床试验阶段。
药明生物所作的贡献
2012
年
7
月,也就是
Ibalizumab
的静脉注射剂型的二期临床试验完成之后,中裕新药与药明生物签订
Ibalizumab
的生产委托合约。
合约签订之后,药明生物对该药物的生产工艺作了重新摸索和建立。该药物的原液和无菌制品的生产,是在药明生物的无锡生物制药研发生产基地进行。
2014
年
5
月,该药物的原液和无菌制品
获得
FDA
批准,用于临床试验中对艾滋病患者的持续治疗。这是国内生产的无菌制品首次获得
FDA
认可进行临床试验。
随后在
2015
年
8
月针对该药物静脉注射剂型开展的三期临床试验,使用的药物就是由药明无锡生产基地所生产.
在中裕新药完成
Ibalizumab
的
BLA
申请之后,
去年的
8
月份
,
FDA
顺利完成针对
Ibalizumab
生产地
——
药明生物无锡
cGMP
生产基地的批准前检查。这标志着药明生物帮助
Ibalizumab
完成了获批前最后一个关键步骤。
因此,可以说,药明生物高质量的一次性生产技术,对该
Ibalizumab
的后期推进起到了非常重要的作用。这款药物的获批,标志着治疗艾滋病的首款单克隆抗体药进入市场,也标着首款在中国生产的无菌生物制品获批进入美国市场。这不仅是药物本身的疗效获得肯定,也是药明生物领先的一次性生产工艺获得
FDA
的认证。这一成就,对于药明生物在全球范围内树立自己高品质的形象,举足轻重。
目前,药明生物已经在国内和国际上拥有众多客户,为他们提供新药的早期研发、临床前药学研究、工艺优化、生产、药品注册等全方位的技术服务。此次
Ibalizumab
获批,必然会进一步强化药明生物高品质的形象,进一步提高药明生物在全球的知名度和影响力。同时,这也有助于树立整个
中国生物制药
行业的形象和品质,对未来高效、模块化的新药研发模式产生重要的促进作用.
在这款药物的获批之际,小编与就该药的研发、生产、市场等各个方面的问题,对药明生物首席执行官陈智胜博士进行了采访。
部分
精彩的问答如下:
Q
:
Ibalizumab
是首例在中国生产并得到
FDA
批准进入美国市场的无菌生物制品,在此之前,中国企业折戟沉沙的主要原因是什么?
A
:
主要有两方面原因:生产工艺
和
GMP
资质
难以获得
FDA
认可,没有合适的产品申报。
Q
:
由于
Ibalizumab
的生产必须符合
FDA
的要求,为了该药物的生产,药明对生产设施和生产工艺作了哪些方面的专门改进?
A
:
这款药之前是在美国圣地亚哥生产,那时候的生产用的是不锈钢发酵罐,
工艺和生产设施存在一定的挑战。我们改用一次性反应器工艺进行生产,提高了产量。
当然,这个工艺我们摸索了很长时间。
Ibalizumab
能获
FDA
批准,被肯定的不光是药物本身,还有我们药明生物的一次性生产技术。
Q
:
经过
8
月份
FDA
PLI
审查员的现场核查后,药明生物对生物药原液及无菌制剂厂作了哪些方面的改进?
A
:
在
FDA
审查员来之前,我们就有改进方案,并且仍在不断改进。他们来之后核查出的问题基本也都是行业内的一些常见问题,比如
SOP
写得不足够规范等。
Q
:
中裕新药自身的研发管线里也有了基于
Ibalizumab
的改造版本,如
TMB-360/365
等。那将
Ibalizumab
推向市场,中裕新药对它的市场定位是怎样的?只是一个过渡吗?
A
:
中裕新药在这个药物的基础上做改进是顺理成章的,因为我们可以通过改进来提高药物的疗效,或者应付将来可能的新的耐药问题。另外,中裕新药也需要扩充自己的产品线,新的研发也会跟进。在研的新药在将来的临床应用中未必一定能成功,但是我们需要努力实现。所以,不能说是过渡。
Ibalizumab
这个药的临床效果很好,这对于对现有疗法产生耐药的患者来说,是一个新的希望。
Q
:
艾滋病如今已经得到了很好的管理,
HIV
的传播和艾
滋病的发病通过有效的预防和抗逆转录病毒药物的治疗,已经得到有效的控制。在这样一个趋势下,用抗体药物治疗艾滋病这一治疗方法有多大的市场前景?
A
:
一方面,部分患者对口服抗逆转录病毒药物这样的现有疗法已经产生耐药,选择抗体药物治疗不失为一个全新的策略,何况
Ibalizumab
的临床数据显示其疗效很好。另一方面,也是比较重要的一点,据何大一博士所说(他对非洲的艾滋病传播和治疗情况比较了解),很多非洲患者对每天口服药物很反感,而患者自己按时口服药物这样的治疗过程对医疗救助人员来说是很难管理的。因此,如果能推广抗体药物治疗,将口服换成打
针,并降低用药频率,
这有助于对患者的用药管理。但是,用抗体治疗最大的难点或许是用药成本,患者的支付能力大多有限。因此,与药明生物合作,通过工艺的优化降低生产成本,从而降低药物价格就显得格外重要。
Q
:
我查了一下,这个药在
1997
年就开始临床试验了,可是最终提交
BLA
却是直到今年。为何这个药物在临床上的开发时间如此之长?
















