
Mark R. Looney 教授【6】
“毫无疑问,这一重要发现证明肺是个非常复杂的器官,它可不仅仅是个呼吸器官,还是形成血液重要成分的关键器官,”Looney 教授告诉 UCSF 新闻部门的 Nicholas Weiler,“我们在小鼠体内观察到的现象,强烈地暗示肺在人体血液形成中也有非常重要的作用。”对于数以百万计的血液病患者和需要接受肺移植的患者而言,这个新发现,有可能对他们疾病的治疗产生巨大而深远的影响。
Looney 教授是肺部先天性免疫学领域的专家,2011年为了观察小鼠肺部的免疫监视活动,Looney 教授和同校的病理学专家 Matthew F Krummel 教授一起发明了“双光子活体成像技术”(2-photon intravital microscopy;2PIVM)(2),这种成像方法允许研究人员执行非常微妙的观察任务,可以让研究人员看到活的小鼠肺里微小血管内的单个细胞的行为。

略残忍的“双光子活体成像技术”成像过程【1】
在一次日常的研究中,Looney 教授团队正在利用双光子活体成像技术观察血液中的血小板与肺部免疫系统之间的相互作用,意外地在肺血管里看到了大量生产血小板的巨核细胞和各种造血祖细胞。造血祖细胞由造血干细胞分化而来,与全能的造血干细胞相比,造血祖细胞只能向一个或几个血细胞系定向增殖分化。
血小板最早发现于1882年。那一年,意大利医师 J.B.Bizozzero(1846-1901;他也是幽门螺杆菌的发现者)发现,一直以来被认为是血液中无功能的细胞碎片的家伙,居然在血管损伤后的止血过程中起着重要作用,血小板这才有了自己的名字。后来科学家逐渐发现,血小板的主要功能是凝血和止血,修补破损的血管,以及参与炎症反应,但是它究竟是如何产生的我们还是知之甚少(3)。
在这个研究出现之前,学界普遍认为,巨核细胞主要存在于骨髓里,并在骨髓里完成生产血小板的过程。虽然之前也有人在肺里观察到巨核细胞(4),并且观察到了一种奇怪的现象:血液从肺部穿过之后,血小板变多了,生产血小板的巨核细胞变少了(5);但是并不确切知道肺里面发生了什么。于是有人猜想,巨核细胞在肺里生产血小板了。但是没有直接的证据,这个问题也就悬而未决的放置了好多年。
穿梭中的巨核细胞【6】
当 Looney 教授团队利用双光子活体成像技术实时地看到巨核细胞的活动时,Looney 教授认为机会来了。“当我们看到大量的巨核细胞生活在肺里的时候,我们觉得我们必须得看看它们在里面都干了些啥。”本研究的第一作者 Emma Lefrancais 博士告诉 Weiler。
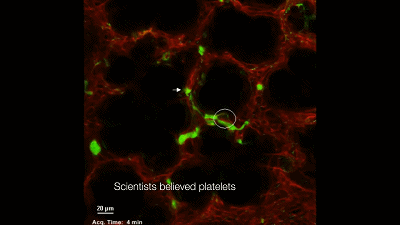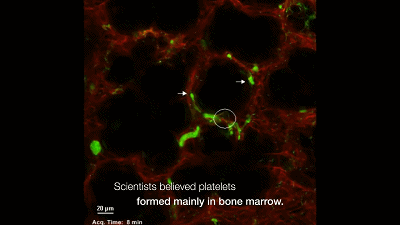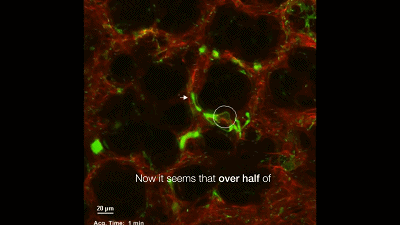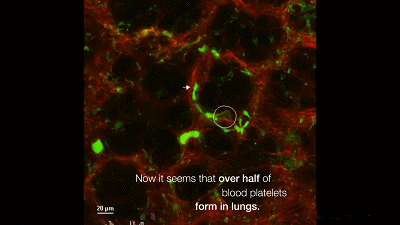
于是,他们构建了一个巨核细胞会发出绿色荧光的模式小鼠,然后用双光子活体成像系统盯着小鼠的肺部,记录下巨核细胞的一举一动。很快,他们就有了一个惊人的发现:巨核细胞在小鼠的肺部生产血小板了,而且每小时生产的数量超过1000万个。这就意味着小鼠体内一半以上的血小板是来自于肺的,生产血小板的主要器官不是骨髓!一直以来笼罩在科学家心头的迷雾终于被驱散了。最后,Looney 教授通过肺移植实验证明,肺里面的巨核细胞是从骨髓里游过来的。
“这太有趣了,巨核细胞竟然从骨髓中跨越万水千山来到肺中生产血小板,”论文的并列第一作者 Guadalupe ortiz-Munoz 对 Weiler 说,“有可能对于巨核细胞而言,肺里面的血管更狭窄,产生的压力更利于它们生产血小板;也有可能是肺在释放一种信号分子,更有利于巨核细胞生产血小板。”
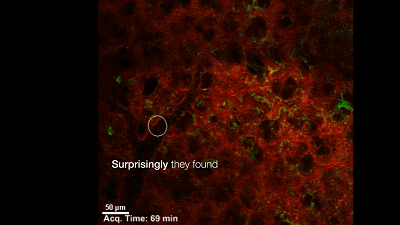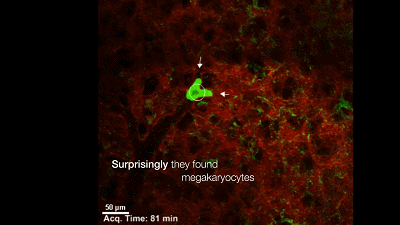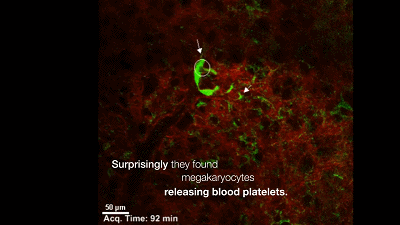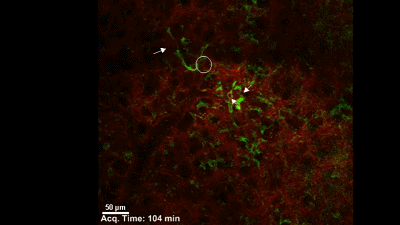
在肺血管穿梭的巨核细胞在生产血小板【6】
为了验证肺部巨核细胞生产血小板的能力,研究人员构建了一个血小板水平低的模式小鼠,然后给它们移植一个新肺,这个肺里携带有含绿色荧光蛋白的巨核细胞。移植完成之后,模式小鼠的血小板水平很快就回升了,而且是绿汪汪的一波血小板。这种稳定的水平持续了数月,明显长于巨核细胞和血小板的寿命。这显然是潜伏在肺里的巨核细胞祖细胞在源源不断的分化成巨核细胞,才保证了小鼠体内血小板水平的稳定。肺对动物血液成分稳定的重要性可见一斑。
既然肺里的造血祖细胞如此威猛,Looney 教授团队想看看在骨髓造血干细胞有缺陷的模式小鼠身上,肺里面的造血祖细胞是不是有能力逆转这一缺陷。
于是他们给模式小鼠移植了健康小鼠的肺脏。最终,他们如愿在模式小鼠的骨髓里发现了长期造血干细胞、短期造血干细胞、多能祖细胞2和多能祖细胞3/4,以及嗜中性粒细胞、B 细胞和 T 细胞等免疫细胞。这就意味着驻扎在肺里面的造血祖细胞在骨髓受损的时候,可以迁移到骨髓,恢复骨髓造血能力。
Looney 教授认为,这是学界第一次指出肺里存在造血祖细胞。犹他州立大学医学院内科系副主任医师 Guy A. Zimmerman 博士认为,这个研究改变了我们对血细胞形成、肺生物学和疾病,以及器官转移的认知。
参考资料:
【1】Lefrançais E, Ortiz-Muñoz G, Caudrillier A, Mallavia B, Liu F, et al. 2017. The lung is a site of platelet biogenesis and a reservoir for haematopoietic progenitors. Nature advance online publication
【2】Looney MR, Thornton EE, Sen D, Lamm WJ, Glenny RW, Krummel MF. 2011. Stabilized imaging of immune surveillance in the mouse lung. Nat Meth 8:91-6
【3】Machlus KR, Italiano JE. 2013. The incredible journey: From megakaryocyte development to platelet formation. The Journal of Cell Biology 201:785-96
【4】Aschoff L. 1893. Uber capillare Embolie von riesenkemhaltigen Zellen. Arch Pathol Anat Phys 134:11-4
【5】Howell WH, Donahue DD. 1937. THE PRODUCTION OF BLOOD PLATELETS IN THE LUNGS. The Journal of Experimental Medicine 65:177-203
【6】http://www.ucsf.edu/news/2017/03/406111/surprising-new-role-lungs-making-blood
论文信息
【题目】The lung is a site of platelet biogenesis and a reservoir for haematopoietic progenitors
【作者】 Emma Lefrançais, Guadalupe Ortiz-Muñoz, Axelle Caudrillier, Beñat Mallavia, Fengchun Liu, David M. Sayah, Emily E. Thornton, Mark B. Headley, Tovo David, Shaun R. Coughlin, Matthew F. Krummel, Andrew D. Leavitt, Emmanuelle Passegué & Mark R. Looney
【期刊】Nature
【日期】 22 March 2017
【DOI】10.1038/nature21706
【摘要】Platelets are critical for haemostasis, thrombosis, and inflammatory responses, but the events that lead to mature platelet production remain incompletely understood. The bone marrow has been proposed to be a major site of platelet production, although there is indirect evidence that the lungs might also contribute to platelet biogenesis. Here, by directly imaging the lung microcirculation in mice, we show that a large number of megakaryocytes circulate through the lungs, where they dynamically release platelets. Megakaryocytes that release platelets in the lungs originate from extrapulmonary sites such as the bone marrow; we observed large megakaryocytes migrating out of the bone marrow space. The contribution of the lungs to platelet biogenesis is substantial, accounting for approximately 50% of total platelet production or 10 million platelets per hour. Furthermore, we identified populations of mature and immature megakaryocytes along with haematopoietic progenitors in the extravascular spaces of the lungs. Under conditions of thrombocytopenia and relative stem cell deficiency in the bone marrow, these progenitors can migrate out of the lungs, repopulate the bone marrow, completely reconstitute blood platelet counts, and contribute to multiple haematopoietic lineages. These results identify the lungs as a primary site of terminal platelet production and an organ with considerable haematopoietic potential.
【链接】
http://www.nature.com/nature/journal/vaop/ncurrent/full/nature21706.html

阅读更多
内容合作请联系
[email protected]















