正文
10月20日,CDE发布关于征求《首批专利权到期、终止、无效尚且无仿制申请的药品清单》意见的通知。
通知表示,为了引导仿制药研发生产、提高公众用药可及性,CDE组织对国内化合物专利权到期、终止、无效且尚无仿制申请的国外已上市药品进行筛选,初步选出他伐硼罗等10个具有明确临床价值的药品,拟纳入《首批专利权到期、终止、无效尚且无仿制申请的药品清单》。对10个品种专利权属状态有异议的,需在2017年11月25日前通过电子邮件向CDE提出意见并说明理由。
首批专利权到期、终止、无效尚且无仿制申请的药品清单
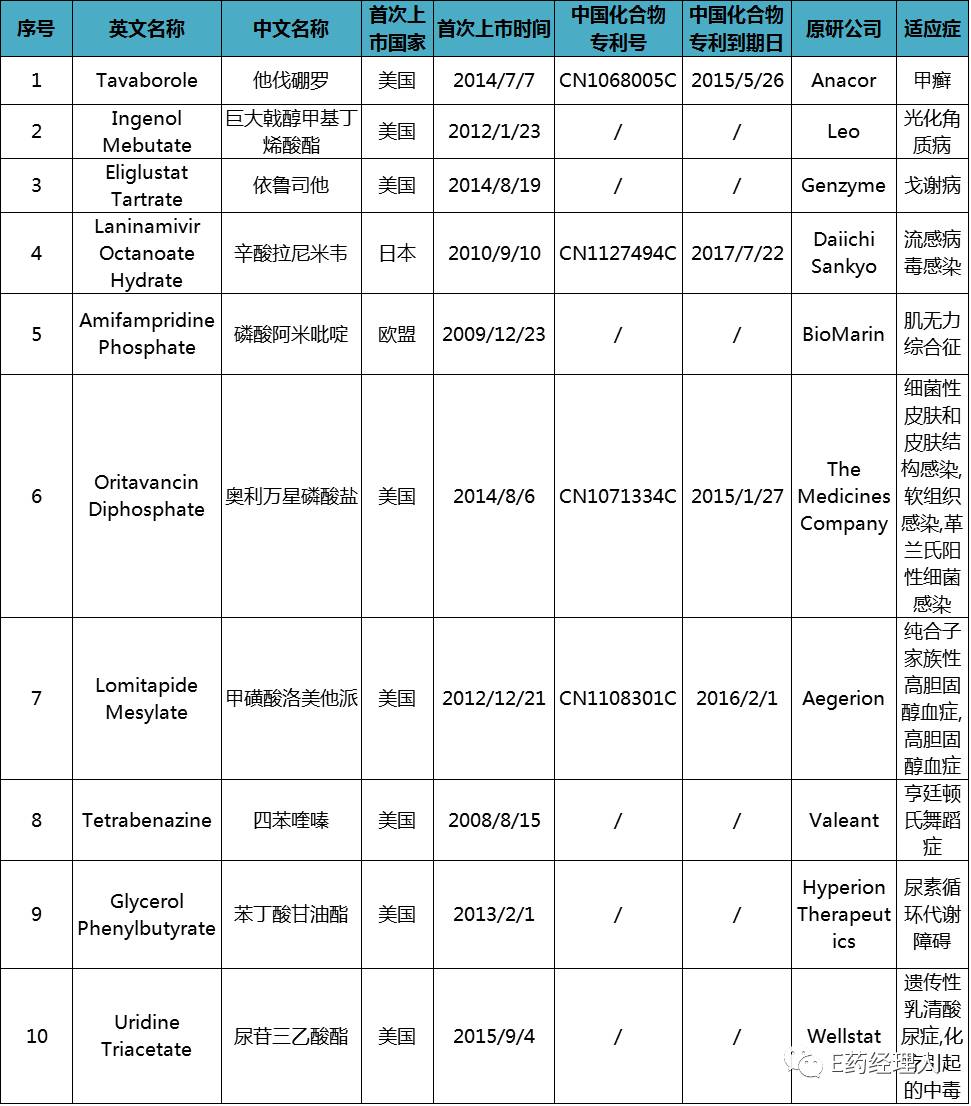
从表面看,这是CDE一项给行业的相关提示性文件,但是实际上,这是药审改革中,打响有关“建立专利强制许可药品有限审评审批制度”,鼓励专利挑战的第一枪。
建立专利挑战制度迫在眉睫
这一列清单的公布与长期以来国家鼓励本土药企生产仿制药的大方向步调一致,同时也意味着国家层面有意推动专利挑战。
在最新发布的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(以下简称“《意见》”)第十四条指出,建立专利强制许可药优先审评审批制度。在公众健康受到重大威胁的情形和启动强制许可的程序,由国家卫生计生委会同相关部门规定。
过去,由于国内没有药品专利的强制许可,很多产品在印度等国家上市,而在中国无法上市。此前,“药侠”陆勇代购印度仿制抗癌药事件曾引发极大关注,以远低于原研药品价格购买到救命药,引发了对提高中国仿制药水平的思考,推动和鼓励临床价值高的仿制药生产的呼声再次响起。
对此,在10月10日举行的全国深化审评审批制度改革鼓励药品医疗器械创新工作电话会议上,国家食品药品监督管理总局(以下简称“CFDA”)局长毕井泉强调,“境外看病买药多。通过中介机构出境看病人数和通过网上购买或请人携带入境药品的现象越来越多,存在诸多隐患”。
此外,值得注意的是,在最早一轮国家药价谈判中,有跨国药企的产品虽然过了专利期,但是国内并未相应的仿制药上市,在谈判过程中,跨国药企在价格上变现强硬,致使国家在谈判中处于被动地位。这对于满足公众用得上、用得起新药好药的迫切需求无法满足。
在欧美日等药品市场,一旦创新药专利到期,必然有专利挑战成功者促使其降价。不同的是,在中国,很多跨国药企的产品虽然过了专利期,但是依然能够以高价大行其道,致使在药物可及、满足患者方面呈现与其它市场不同的景象。
面对这种现状,在今年3月,国务院医改办特地召集了国内颇具研发实力的企业进行了一场闭门研讨会,向业内征求国家需要制定怎样的政策才能促进国内企业在仿制药层面以专利挑战的形式进行抢仿。由此,中国的专利挑战制度与强制许可制度的建立正式被提上日程。
1~3 年独占期?
关于“建立专利强制许可药品优先审评审批制度”,在最新发布的《意见》中已经有了明确的表述,而有关“专利挑战”的相关制度目前还未明确,这也是接下来药审改革以及医改进程中需要关注的重点。
在美国,首仿是指第一个递交、并在专利挑战中杀出一条血路,最终获批成为第一个上市的仿制药。对此,最大的好处在于首仿药可以获得180天的“首仿独占期”,在这期间,FDA不会批准其它仿制药的申请。而这180天往往使得首仿企业获益匪浅。但是在中国,这一制度一直缺失。
面对此,在今年3月份进行的调研中,国务院医改办相关人士曾向医药行业人士表示,他们认可国外通行的180天独占期或许与国情不相符,但1至3年则更为可行。也就是说,接下来国家层面将力推专利挑战制度,并结合中国国情,给出更大的优惠力度。
其实,今年以来,国家已经为“专利挑战制度”的建立做了不少的铺垫。在此前,医药行业人士认为,中国无法向美国那样进行专利挑战、享有180天首仿独占期。一方面是因为中国审评审批比较缓慢,另一方面,在医保对接上,新上市的产品很难进入,且多年调整一次,没有医保对接,即使有180天,对于一个产品的销售也毫无助益。
但是现在,显然条件已经开始成熟,在审评审批速度方面,随着药审改革力度的不断加强,审批速度已经提高了前所未有的境地,且优先审评制度的建立,为专利挑战做好了充分准备。而在医保对接方面,今年人社部做了两项颇具划时代意义的事情,第一件是医保目录的动态调整制度的建立,另一件是药价谈判。从医保角度来讲,如果是专利挑战成功,企业则无需再担心进入医保的问题,可以通过医保目录的动态调整制度,迅速的进入到医保目录,随着1~3年的首仿独占期获得很好的收益。
由此可见,中国专利挑战制度建立的基础条件已经成熟,此次CDE发布专利权到期、终止、无效尚且无仿制申请的药品清单,实则在积极引导本土企业参与仿制,提高药品的可及性。抢仿成功的企业,未来很可能在政策和抢占市场份额上占据优势。相信国家层面有关专利挑战的制度的建立已经开始,在不久的将来就会出台实施。
对于中国具有研发实力的企业来说,盘点自身的研发管线,确定哪些专利挑战产品进行加速研发或许现在时机已经到来。其实,不一定要去做原研创新,首仿也是一个不错的选择。因为,中国鼓励专利挑战、进行首仿的力度将会很大。
扫描二维码,参加药代备案落地全国巡讲交流(免费)

扫描二维码报名:
成都地区:

武汉地区:

本文版权属于E药脸谱网(www.y-lp.com),转载请注明出处。















