千呼万唤始出来的美国FDA “Bioanalytical Method Validation Guidance for Industry” 正式版在上个月21日终于出台了。对于FDA 的这一正式版相对于2013 年的draft改动,以及与EMA在 2011年颁布的Guideline on bioanalytical method validation和CFDA在2015版《中国药典》中发布的“生物样品定量分析方法验证指导原则”的比较,我们访问了大分子生物分析的专家
李冬蓓
博士、
蔡晓燕
博士和
黄启宽
先生,谈谈他们的看法。
问:FDA这一正式版跟2013年的初稿有什么改动?
答:
2013可以看做是FDA对行业的征询稿。当时FDA也的确收到了不少反馈,其中我们参与的Global Bioanalysis Consortium (GBC) on harmonization of bioanalytical guidance 大分子生物药分会就把我们的意见反馈给FDA(见下)。 仔细比较一下,不难看出FDA还是认真考虑采纳了我们的意见。从这个表格中,大家也可以抓住2018正式版与2013年draft版在大分子细则上的更新:
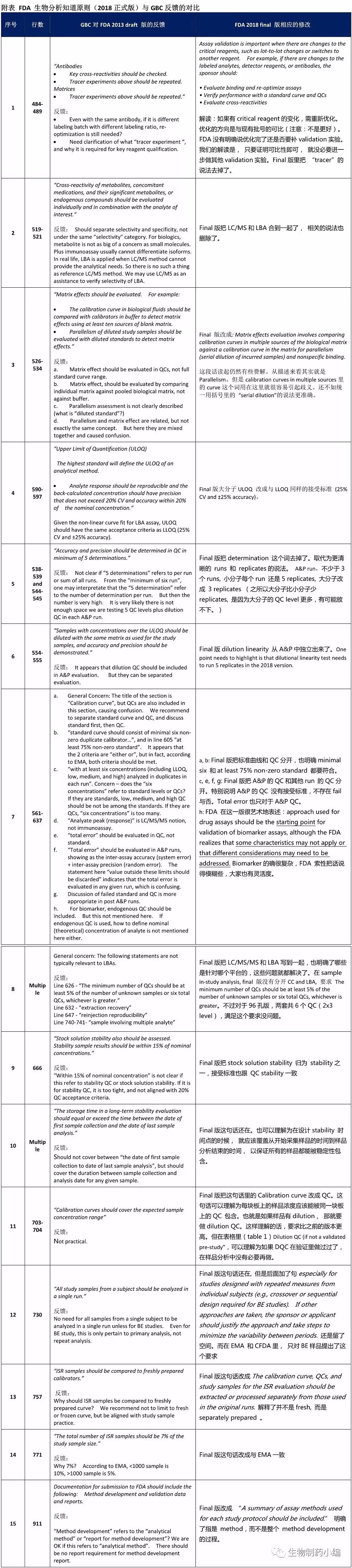
问:FDA 2018正式版跟 EMA 2011 年和 CFDA 2015 年发表的指导原则有没有差异的地方?
答:
在FDA 2018 正式版里可以看到很多与EMA 2011和CFDA 2015相呼应的地方,三大指导原则基本一致。但在一些细则上还是有差别的。我们借用FDA (2018 )列表的方式,把其与 EMA (2011)CFDA(2015)的异同列了出来。同时也把FDA(2018)里面CC/LBA的异同总结了一下。

问: 最后请您们谈谈对FDA (2018)版指导原则的整体看法。
答:
这一版跟以前的指导原则版本比较起来有不少优化改革的,包括细则到整体编排上。比如把小分子化药常用的质谱检测(CC)和大分子生物药常用的配体结合检测(LBA)两大块合二为一;把验证的具体要求从行文中抽取出来,以表格的形式总结出来;还把对documentation 和 report 也从行文叙述转成表格的形式。列表的优点是读者可以清晰地比较FDA对CC与LBA要求的差异,以及documentation和report在方法验证阶段和样品分析阶段的不同要求, 哪些内容只需要在原始记录中保存,哪些内容要在验证报告中体现,一目了然。另外,这一版在不少方面比之前的版本可以说更严格了。 比如说,
-
把critical reagent 跟reference standard放在一起,除了不要求CoA,基本上是同一个规范高度;
-
要求在方法验证和样品分析报告里包含instrument ID, 还建议包含 QC graphs trending;
-
在样品分析里建议同一个subject的样品在同一个批次中分析(EMA和CFDA只是BE study这样的建议);
-
建议所有跟approval 和labeling有关系的study都要做ISR (EMA和CFDA只是BE,tox study of each new animal species, first human, first impaired hepatic and/or renal function study有这样要求)。
这些新要求会引起行业内的不少讨论。我们认为,在规范化要求上越来越严谨,是行业发展的趋势。而且,这些做法也是具有科学必要性的 。如ISR, 之前的做法只考察了检测方法的可重复性,FDA的要求还考察了具体参与的机构和实验人员的可重复性,是更严谨的做法。 当然,这一版还有一些需要FDA进一步解析的地方。 我们相信国内外的同行们都会积极的展开讨论, 给FDA进一步的反馈。
参考资料:
-
FDA Guidance for Industry - Bioanalytical Method Validation (2001);
-
FDA Guidance for Industry - Bioanalytical Method Validation (DRAFT GUIDANCE) (2013);
-
EMA: Guideline on bioanalytical method validation (2011);
-
《中国药典》“生物样品定量分析方法验证指导原则” (2015)。
鸣谢:
-
黄启宽
:是中国生物分析论坛青年分会常务理事,多次受邀行业国际会议做学术报告(CPSA,CBF)。曾任国内最大生物分析室总监,10+年大分子生物分析经验,负责海外业务及国内生物类似药业务。 有多年成功的国内外政府机构审计经验,为多个重量级新药(Cosentyx, Keytruda,Opdivo, Yervoy等)提供PK、ADA、NAb的上市审批数据支持。
上海精翰生物(宁波熙宁)
是李冬蓓博士、黄启宽先生创办,蔡晓燕博士为特聘高级顾问的专注于大分子生物分析的专业平台。在上海、宁波及美国新泽西均设立GLP分析实验室。团队平均5年以上的专业经验, 技术力量雄厚。为国内外药企提供 药物代谢, 免疫原性, 中和抗体的咨询检测服务。
欢迎加入小编团队成为小编一员
请加小编微信号:wuwenjun7237
如有技术解读、行业洞见愿意分享
欢迎投稿到小编邮箱:
[email protected]

欢迎个人转发分享。其他任何媒体、网站如需转载或引用本网版权所有内容须获得授权且在醒目位置处注明“转自:生物制药小编”。















