中国科学院上海药物研究所徐华强研究员领衔国际交叉团队经过联合攻关,再次利用世界上最强 X 射线激光,成功解析磷酸化视紫红质(Rhodopsin)与阻遏蛋白(Arrestin)复合物的晶体结构,攻克了细胞信号传导领域的重大科学难题。该项突破性成果以上海药物研究所作为第一单位于北京时间 2017 年 7 月 28 日以封面文章发表于国际顶级学术期刊《细胞》(Cell)上。该项工作是徐华强合作团队继续他们发表在 2015 年《自然》(Nature)杂志里程碑式研究的又一重要突破。
生命的功能是信号传导密码来体现或来执行的,比如我们遗传的物质基础是 DNA,它贮藏了我们生命的各种密码,其中最基本的一种是 20 种氨基酸编码。同样,GPCR 信号通路需要“开”与“关”来调节,而“关”的信号就是由 GPCR 磷酸化密码来决定的。鉴定与解释 GPCR 磷酸化密码乃是当今细胞信号传导领域最重要的一个科学问题。
GPCR 是目前最成功的药物靶标,迄今 40% 左右的上市药物是以 GPCR 为靶点。GPCR 作为细胞信号转导的“信号兵”,是通过下游 G 蛋白和阻遏蛋白两条主要的信号通路转导跨膜信号。当受到外界信号刺激,GPCR 激活 G 蛋白调节第二信使产生,进而“开放”下游信号传导。为了“关闭”这一信号,GPCR 激酶(GRK)将 GPCR 尾部磷酸化。GPCR 尾部一旦被磷酸化随即激活阻遏蛋白并与之形成紧密结合为复合物,进而介导信号“关闭”。因此,阻遏蛋白与 GPCR 的结合是协调整合 GPCR 下游信号网络的关键,而 GPCR 的尾部磷酸化则是破解 GPCR 招募并结合阻遏蛋白难题的关键密码。
徐华强领衔的交叉团队在 2015 年利用 X 射线自由电子激光技术,率先在《自然》杂志发表了视紫红质与阻遏蛋白复合物的晶体结构。该结构是继 2011 年人β2 肾上腺素受体与 Gs 蛋白复合物晶体结构获得解析后首个 GPCR 与 Arrestin 复合物的完整复合体结构,为揭示两者间的相互作用奠定了结构学基础。然而, GPCR 与 Arrestin 的相互作用依赖于 GPCR 尾端氨基酸残基的磷酸化来介导,由于该结构不包含视紫红质尾部的高分辨率结构,因此 GPCR 通过其尾部磷酸化进而招募 arrestin 的分子机制仍然未知。发表于《细胞》的文章不仅提供了视紫红质和阻遏蛋白复合物整体组装的结构信息,更重要的是破解了 GPCR 招募阻遏蛋白的磷酸化密码——GPCR 通过其尾部氨基酸的磷酸化招募并与阻遏蛋白结合,同时发现该密码对整个 GPCR 蛋白组具有普遍性。
这个项目由国家“千人计划”特聘教授徐华强和美国温安洛研究所 Karsten Melcher 合作主导完成。项目合作机构遍布全球,包括加拿大多伦多大学、斯克利普斯研究所、德国 Desy 自由电子激光科学中心、斯坦福大学、德国汉堡超快成像中心、加州大学洛杉矶分校、南加州大学、上海科技大学和范德堡大学等。
该研究获得国家“重大新药创制”重大专项、973、先导专项以及国际项目等基金的资助。
文章链接:http://www.cell.com/cell/fulltext/S0092-8674(17)30773-0
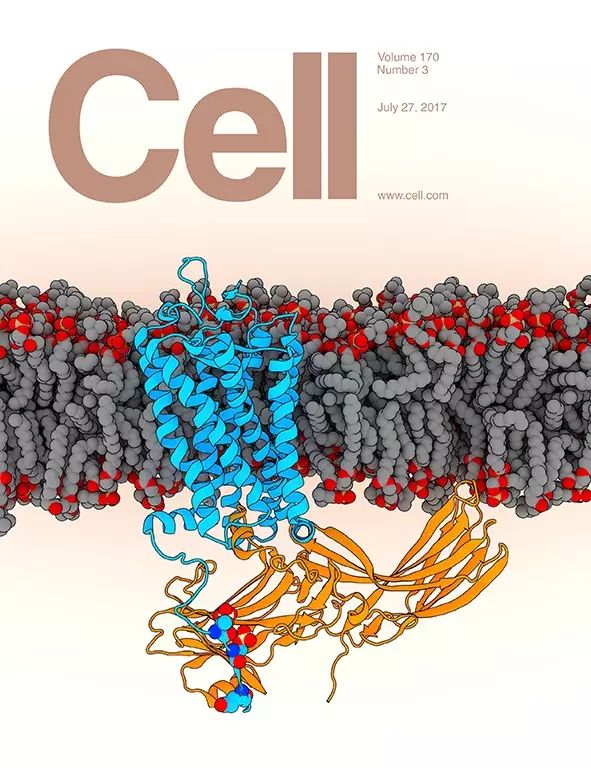
磷酸化视紫红质和阻遏蛋白复合物的高分辨率三维结构
(蓝色所示为视紫红质的结构;黄色所示为阻遏蛋白的结构;灰色和红色球状结构为细胞膜磷脂;深蓝、蓝和红色小球所示为视紫红质的磷酸化氨基酸;图片来源:徐华强课题组)
微信小程序推荐:没有我找不到的文献
















