Toni K. Choueiri, Mario Eisenberger, Anne-Claire Hardy-Bessard, Choung Soo Kim, Lajos G´eczi, Daniel Ford, Lo¨ıc Mourey, Joan Carles, Phillip Parente, Albert Font, Gabriel Kacso, Mustapha Chadjaa, Wenping Zhang, John Bernard, and Johann de Bono
本刊负责人:傅小龙
上海
复旦大学附属肿瘤医院
审校:王弘恺 上海复旦大学附属肿瘤医院
翻译:
曾晓微 浙江中医药大学
摘 要
目的:
III
期
TROPIC
研究结果证实,与米托蒽醌(
mitoxantrone
)相比,
Cabazitaxel
25 mg/m2(C25)
显著改善了既往已经接受过一种含多西他赛(
docetaxel/Taxotere
)方案治疗的mCRPC患者的总体生存期(
overall survival
,
OS
)(
P
= 0.001
)。本
III
期
PROSELICA
研究(
ClinicalTrials.gov
标识符:
NCT01308580
)评估了与
C25
相比,
Cabazitaxel
20mg/m
2
(
C20
)治疗既往已经接受过一种含
docetaxel
方案治疗的
mCRPC
患者的非劣效性。
对象及方法:
患者根据美国东部肿瘤协作组
(Eastern Cooperative Oncology Group
;
ECOG)
的体力活动状态,实体肿瘤疗效评价标准(
RECIST
)的可测量性以及地域进行分层并随机分配到
C20
或
C25
组。为证明
C20
组
95%I
C
的非劣效性(在
TROPIC
研究中
C25
组患者的
OS
获益与
mitoxantrone
组相比维持在
≥50%
的水平),在期中分析后其风险比
(HR)
单侧
98.89
%
CI
的上限与
C25
相比不能超过
1.214
。次要终点包括无进展生存期(
progression-free survival
,
PFS
),前列腺特异性抗原(
PSA
),肿瘤和疼痛的反应及进展,健康相关生命质量
(
health-related quality of life
,
HRQOL
)和安全性。
结果:
总体而言,随机分配(
C20
组,
n = 598; C25
组,
n = 60
2
)到
2
组的
1200
名患者的基线特征相似。
C20
组的中位
OS
为
13.4
个月,
C25
组为
14.4
个月(
HR,1.024
),
HR CI
的上限为
1.184
(低于非劣效性界值
1.214
)。
C25
组在PSA反应率
(C20,29.5%;C25, 42.9%;
P
<0.001)
和
PSA
进展时间(中位数:
C20,5.7
个月
; C25,6.8
个月
; C20 vs. C25 HR,1.155; 95
%
CI
,
1.025-1.393
)上较
C20
组有显著优势。
2
组的
HRQOL
无差异。
3
级或
4
级治疗
-
紧急不良事件(
treatment-emergent adverse events
,
TEAEs
)的发生率
C20
组和
C25
组分别为
39.5
%和
54.5
%。
结论:
本研究证实了
Cabazitaxel
治疗既往已经接受过一种含
docetaxel
方案治疗的
mCRPC
患者的有效性。
C20
组患者的
OS
获益维持在
TROPIC
研究中
C25
组与
mitoxantrone
组相比
≥
50%的水平,达到了非劣效终点。次要疗效终点偏向于
C25
组。
C20
组的不良事件较少。
引言
据估计,
2016
年美国新诊断的前列腺癌有
180890
例,占美国男性所有新癌症诊断的
21
%
[1]
。资料表明雄激素受体(
androgen receptor,AR
)是前列腺癌发生进展的有力驱动因素,且为最近批准的通过调控
AR
信号轴来治疗前列腺癌患者提供了机制性理论依据。然而,尽管
AR
靶向药物治疗的反应率很高,绝大多数患者会出现耐药性,并最终导致疾病进展。
2004
年,在证明含
docetaxel
的治疗方案与
mitoxantrone
相比存在显著生存优势的2项
III
期临床试验
[2,3]
发表后,docetaxel成为
mCRPC
的标准非内分泌治疗方案。自
2004
年后批准用于治疗
mCRPC
的方法包括
Cabazitaxel
,前列腺疫苗(
sipuleucel-T
),
AR-
靶向药物阿比特龙(
abiraterone
)和恩杂鲁胺(
enzalutamide
)以及放射性镭
Ra-223
药物
[4]
。
Cabazitaxel
基于其对
docetaxel
耐药的肿瘤细胞株和肿瘤模型均有抗增殖活性而被开发
[5]
。
III
期
TROPIC
试验表明
Cabazitaxel
联合泼尼松(
prednisone
)治疗既往已经接受过一种含
docetaxel
方案治疗的
mCRPC
患者具有一定的疗效
[6]
。与
mitoxantrone
对照组相比,
Cabazitaxel
组患者有更长的
OS
(中位
OS
,分别为
15.1 vs. 12.7
个月,
P
< 0.001
)和
PFS
(
mPFS,
分别为
2.8 vs. 1.4
个月,
P
<0.001
),以及更高的
PSA
反应率(分别为
39.2
%
vs. 17.8
%,
P
<0.001
)
[6]
。基于该研究结果
,
Cabazitaxel 25mg/m
2
联合
prednisone
被批准用于治疗既往使用过一种含
docetaxel
方案治疗的
mCRPC
患者
[7]
。
早期阶段的临床试验推荐,在
II
期和
III
期试验中,初步数据分析显示
20mg/m
2
(
C20
)和
25mg/m
2
(
C25
)
Cabazitaxel
中较低剂量可能与药物毒性降低有关
[6,8-10]
。临床试验安全性数据总结报告,3级和
4
级中性粒细胞减少症的发生率在
C20
和
C25
治疗组分别为
57.1
%和
82.1
%
[11]
,提示较低剂量的
Cabazitaxel
可能降低血液毒性的发生率
;
但需要额外的评估来确定
C20
与
C25
的相对疗效。
获批准的
PROSELICA
研究(
ClinicalTrials.gov
标识符:
NCT01308580
)评估了
C20
与
C25
相比在
OS
方面是否存在非劣效性。额外探索性分析评估了患者亚组治疗效果的一致性,并检测了基线特征和预后因素对
OS
的影响。次要目标包括
PFS
,
PSA
,肿瘤和疼痛反应及进展,
HRQL
以及安全性的评估。
对象及方法
研究对象
该
III
期、随机、公共标识试验纳入全球
22
个国家
172
个中心的
mCRPC
患者。主要纳入标准包括经早期雄激素剥夺治疗(
androgen-deprivation therapy
,
ADT
)后疾病进展以及既往接受过
docetaxel
治疗的前列腺癌确诊病例。
年龄
>18
岁的
患者
ECOG
体能状态(
performance status
,
PS
)评分为
0~2
分
。主要排除标准包括既往使用过
mitoxantrone
或
Cabazitaxel
治疗,早期使用过放射性药物治疗,以及随机分配时任何既往的抗癌治疗持续存在
1
级不良事件
(adverse events,AEs)
。患者根据地域,
ECOG
体能状态和实体肿瘤疗效评价(
RECIST
)
[12]
1.1版的疾病可测量性进行分层,并通过交互式语音应答系统按
1:1
随机分配接受
C20
加
10mg prednisone
或
C25
加
10mg prednisone
。
该研究方案,包括所有修正案需经独立伦理委员会和机构审查委员会的审查和批准。该研究严格遵循第十八届世界卫生大会(赫尔辛基,芬兰,
1964
年)的建议和所有适用的修正案以及进行研究的国家的法律、法规和指导方针。所有患者入组前提供书面知情同意书。
疗效评估
主要评价终点是
OS
,定义为从随机化开始至因任何原因引起死亡的时间。在未确认患者死亡的情况下,通过知道病人活着或研究截止的最后日期(以较早者为准)进行生存时间分析。次要终点包括
PFS
,肿瘤反应和进展,
PSA
反应和进展,疼痛基线稳定和进展的患者疼痛反应,
HRQL
和安全性。详细解释见附录(仅在线)。
安全评估
本研究通过监测
AEs
和严重的
AEs
,实验室检查异常,生命体征和心电图来评估安全性。国家癌症研究所常见不良反应事件评价标准(
CTCAE
)(版本
4
.03
)作为评估临床
AEs
的指南。在研究中,除第
1
周期外允许治疗或预防性应用粒细胞集落刺激因子。
统计分析
该研究样本量的大小是检测
C20
组患者的
OS
获益能否维持在注册过的
III
期
TROPIC
研究中已经证实的
C25
组患者
OS
受益的
50%
及以上,同时是基于上市后要求提供的建议确定的。在
TROPIC
研究中,与
mitoxantrone
组相比,
C25
组患者死亡的相对危险性降低了30%(
HR
,
0.70; 95
%
CI
,
0.59-0.83;
P
<0.001
)
[6]
。本研究目的是验证与
TROPIC
研究中
mitoxantrone
组的结果相比,
C20
治疗组的死亡风险是否有
≥15%
的降低(即
HR≤0.85
)。在这些假设的基础上,本试验
C20
组与
C25
组
HR
相比其非劣效性界值设定为
1.214(0.85HR
除以
0.70HR)
。经过
2
次期中分析,为证实
95
%
IC
的非劣效性,
C20
与
C25
组相比其
HR
单侧
98.89
%
CI
的上限(
UCI
)不能超过
1.214
。单方面阐述实际
HR
为
1
时(
α=0.025
,使用
East 5.1
软件),需要
1200
名随机分配的患者和
988
例死亡人数以达到
80
%的权重来证实与
C25
组相比
C20
治疗组的非劣效性。同时额外的研究需要来评估亚组患者治疗效果的一致性,并检测基线特征和影响
OS
的潜在预后因素,如地域,
ECOG
体能状态,年龄,性别,脏器受累,乳酸脱氢酶(
lactate dehydrogenase
,
LDH
)及白蛋白的基础值,
Glaeson
评分,既往使用过
abiraterone
和
/
或
enzalutamide
治疗,淋巴结或骨转移,既往使用过阿片类药物,以及既往使用
docetaxel
的持续时间。该研究有独立数据监测委员会和指导委员会。所有总结和统计分析使用
SAS 9.2
版统计软件(
SAS Institute
,
Cary
,
NC
)生成。
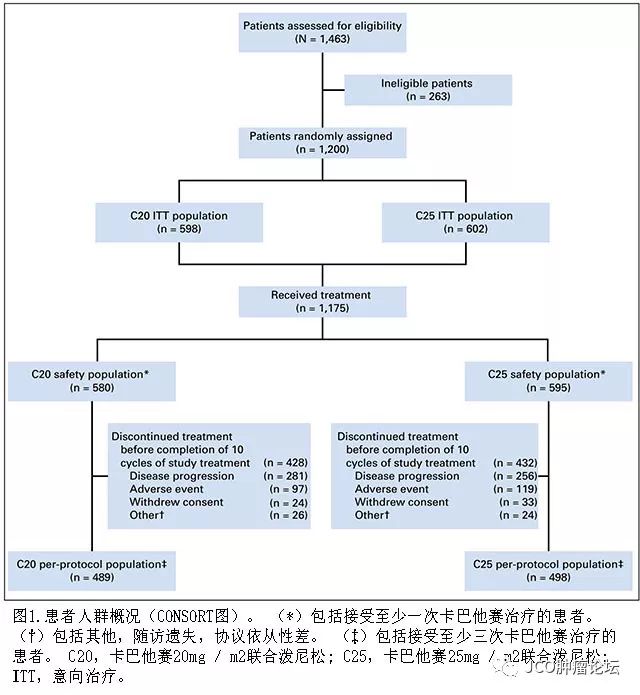
结果
2011
年
4
月至
2013
年
12
月共招收
1,200
名
mCRPC
患者,其中
598
名和
602
名被随机分配接受
C20
和
C25
治疗(图
1
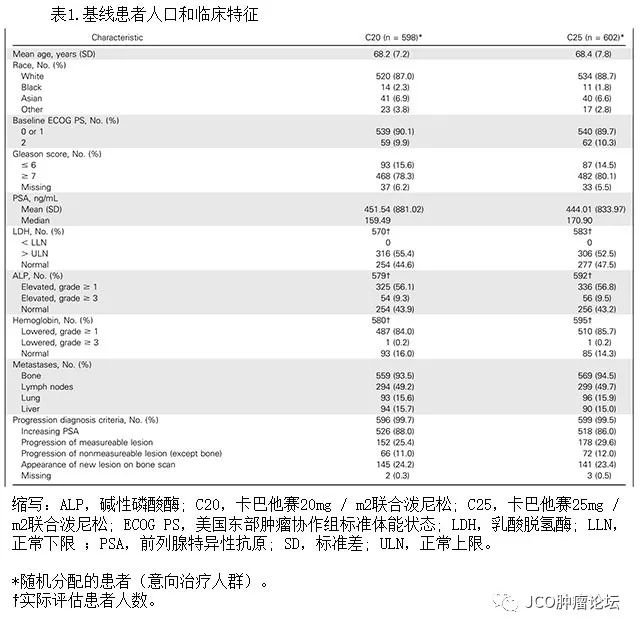
)。治疗组之间基线特征匹配良好(表
1
)。在大多数患者纳入研究前存在
PSA
水平的逐渐升高(
C20
,
n = 526 [88.0
%
]; C25
,
n = 518 [86.0
%
]
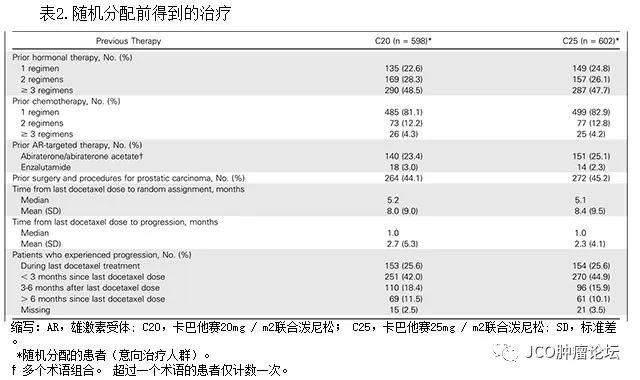
)。在入组前,每个治疗组中的大多数患者已经接受了一种或多种含
docetaxel
的化疗方案,并且每组中近一半的患者已经接受三种或更多种内分泌治疗方案(表
2
)。 在随机分配的总人群中,
308
名(
25.7
%)患者既往接受过
AR-
靶向治疗(
abiraterone
或
enzalutamide
)。最后一次使用
docetaxel
治疗到随机分配的中位时间和最后一次使用
docetaxel
治疗到疾病进展的中位时间在两个治疗组间相似(表
2
)。
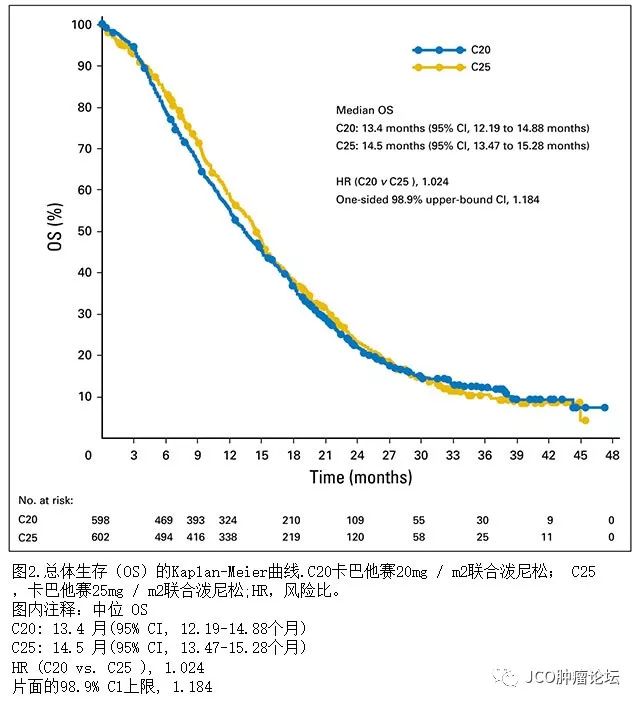
图
2
显示随机分配接受
C20
与
C25
意向治疗(
ITT
)群体中患者
OS
的主要分析的
Kaplan-Meier
曲线。 接受
C20
和
C25
患者的中位
OS
分别为
13.4
和
14.5
个月(
HR
,
1.024
)。
HR
单侧
98.89
%
UCI
为
1.184
,低于非劣效性界值
1.214
,从而满足
ITT
人群非劣效性的预期标准(预定义的初级人群
;
表
3
和图
2
)。每个方案群体的二次分析(包括仅接受至少三次
cabazitaxel
治疗的患者)评估
OS
时,接受
C20
和
C25
的患者观察到的中位
OS
分别为
15.1
和
15.9
个月(
HR
,
1.042
)。此时
C20
治疗组的
HR
单侧
98.89
%
ICU
为
1.224
,大于
C25
治疗组的非劣效性界值
1.214
,不能确定
C20
治疗组具有非劣效性。
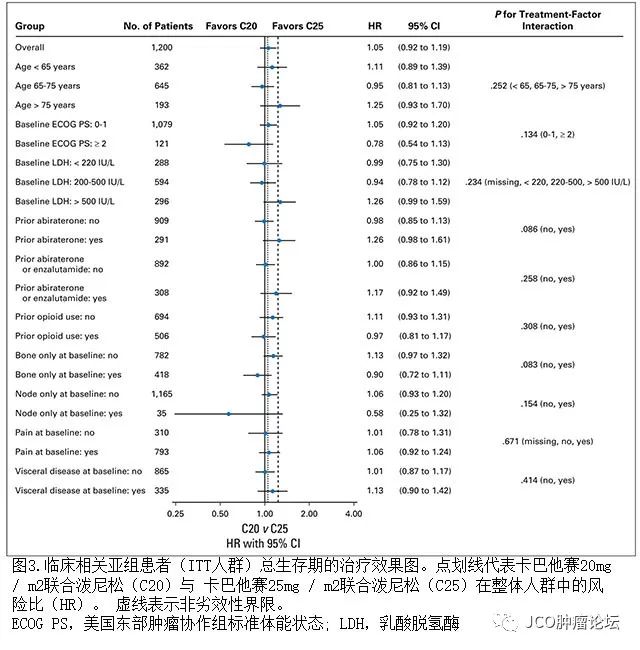 在意向治疗(
intent-to-treat,ITT
)人群中进行额外的OS分析以评估患者亚组治疗效果的一致性,并检查基线特征对
OS
的影响(图
3
)。在既往接受过
abiraterone
治疗(
HR
,
1.260; 95
%
CI
,
0.983-1.615
),高
LDH
基线水平(
>500 IU / L; HR,1.256; 95
%
CI
,
0.991-1.591
)和在最初进展期即存在新骨病变(
HR,
1.233; 95
%
CI
,
0.965-1.574)
的患者中,他们的结果倾向于
C25
治疗组。既往接受过
abiraterone
治疗的患者中对于易感群体(接受至少
3
次
cabazitaxel
治疗的患者;
HR
,
1.344; 95
%
CI
,
1.020-1.771
)这种趋势更明显。相反,在其他患者的亚组中趋势有利于
C20
组,包括在基线状态下
ECOG PS≥2(HR,0.778; 95
%接受
C20
和
C25
治疗的患者其中位
PFS
分别为
2.9
个月和
3.5
个月(
HR
,
1.099; 95
%
CI
,
0.974-1.240;
表
3
和附录图
A1
,仅在线)。在肿瘤反应,
PSA
和疼痛进展方面,每个治疗组观察到的结果相似。最常见的PFS事件是PSA进展(
C20
,
39.8
%
; C25,34.7
%)和疼痛进展(
C20,25.8
%
; C25,28.1
%)。
在意向治疗(
intent-to-treat,ITT
)人群中进行额外的OS分析以评估患者亚组治疗效果的一致性,并检查基线特征对
OS
的影响(图
3
)。在既往接受过
abiraterone
治疗(
HR
,
1.260; 95
%
CI
,
0.983-1.615
),高
LDH
基线水平(
>500 IU / L; HR,1.256; 95
%
CI
,
0.991-1.591
)和在最初进展期即存在新骨病变(
HR,
1.233; 95
%
CI
,
0.965-1.574)
的患者中,他们的结果倾向于
C25
治疗组。既往接受过
abiraterone
治疗的患者中对于易感群体(接受至少
3
次
cabazitaxel
治疗的患者;
HR
,
1.344; 95
%
CI
,
1.020-1.771
)这种趋势更明显。相反,在其他患者的亚组中趋势有利于
C20
组,包括在基线状态下
ECOG PS≥2(HR,0.778; 95
%接受
C20
和
C25
治疗的患者其中位
PFS
分别为
2.9
个月和
3.5
个月(
HR
,
1.099; 95
%
CI
,
0.974-1.240;
表
3
和附录图
A1
,仅在线)。在肿瘤反应,
PSA
和疼痛进展方面,每个治疗组观察到的结果相似。最常见的PFS事件是PSA进展(
C20
,
39.8
%
; C25,34.7
%)和疼痛进展(
C20,25.8
%
; C25,28.1
%)。
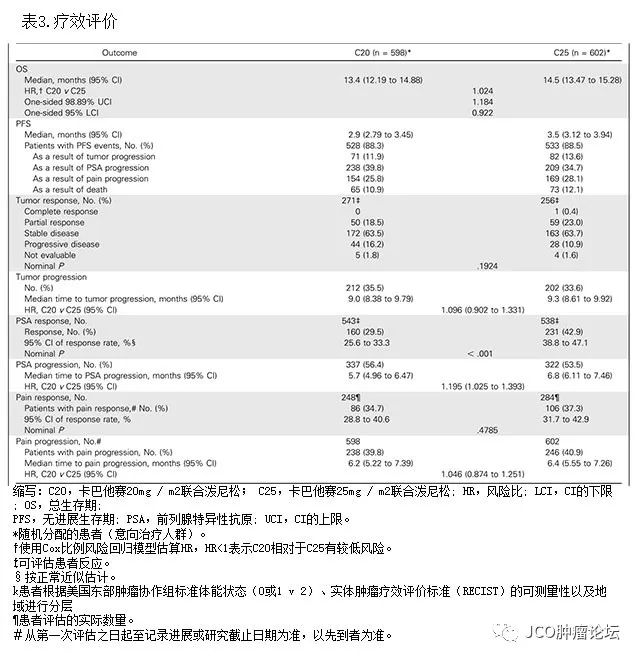
在可评估患者(
C20
,
n = 271; C25
,
n = 256
)中,接受
C20
和
C25
的患者的肿瘤反应率无明显差异(分别为
18.5
%
vs.23.4
%,
P
= 0.1924;
表
3
)。接受
C25
和
C20
的患者肿瘤进展中位时间分别为
9.3
个月和
9.0
个月(
HR,1.096; 95
%
CI
,
0.902-1.331;
表
3
)。
C25组患者的
PSA
反应率明显高于
C20
组(表
3
),其中
C20
组
543
例中有
160
例(
29.5%
),
C25
组
538
例中有
231
例(
42.9
%),这表明
C25
组患者与基线水平相比
PSA
降低
≥50%
(
P
<0.001
)。接受
C25
治疗患者的中位
PSA
时间比
C20
治疗组的更长(分别为
6.8 vs. 5.7
个月,
C20 vs. C25
组
HR,1.195; 95
%
CI,1.025-1.393;
表
3
)。
在疼痛基线可评估的患者中,两治疗组中有疼痛反应的患者数量无显著差异(
C20,34.7%;C25,37.3%;
P
=0.4785
,表
3
)。治疗组间(
C20,39.8
%
; C25,40.9
%)疼痛进展速度相似,接受
C25
和
C20
治疗的患者疼痛进展的中位时间分别为
6.4
个月和
6.2
个月。 两种剂量
cabazitaxel
治疗的疼痛进展风险比相似(
HR,1.046; 95
%
CI,0.874-1.251;
表
3
)。
通过分析癌症治疗
功能评价系统
(
Functional Assessment of Cancer
Therapy,FACT
)
—
前列腺癌健康量表或前列腺癌特异关注(附录和附录表
A1
,仅在线)确定两种剂量
cabazitaxel
治疗组患者的恶化中位时间无差异(附录和附录表
A1
,仅在线)。
安全人群由
C20
和
C25
组的
580
例和
595
例患者组成,分别接受至少一剂
cabazitaxel
治疗。
C20
组患者的中位治疗周期为
6
个疗程,中位治疗时间为
18
周,而
C25
组患者的中位治疗周期为
7
个疗程,中位治疗时间为
21
周(表
4
)。两治疗组的中位相对剂量强度相似。相比于C20组,接受
C25
治疗的患者存在剂量延迟和减少(表
4
)。在最后
30
天治疗剂量中
2
组因不良事件
(Adverse Events
,
AEs
)死亡的发生率均较低(
C20,2.1
%
; C25,3.2
%
;
附录表
A2
仅在线)。导致死亡最常见的治疗
-
紧急不良事件(
TEAEs
)为中性粒细胞减少性败血症(
C20,0.2
%
; C25,0.5
%
;
见附录)。治疗组发生非血液学治疗
-
紧急不良事件最常见的为腹泻,恶心和疲劳(表
5
)。
C20
和
C25
组发生严重
TEAEs
的患者分别为
177
例(
30.5
%)和
257
例(
43.2
%)。其中接受
C20
治疗的
95
例(
16.4
%)患者与接受
C25
治疗的
116
例(
19.5
%)患者可能因
TEAE
而导致永久性治疗停药。

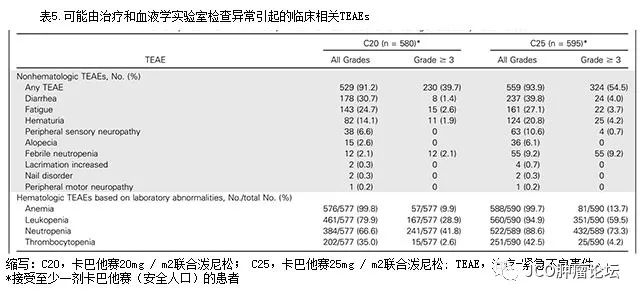 在
C20
和
C25
治疗组中,分别有
2.1
%和
3.2
%的患者在最后一次服用
cabazitaxel
的
30
天内因
AEs
死亡。
2
组发生
≥
3级的中性粒细胞减少症的患者分别占
41.8
%和
73.3
%;发生发热性中性粒细胞减少症(
febrile neutropenia
在
C20
和
C25
治疗组中,分别有
2.1
%和
3.2
%的患者在最后一次服用
cabazitaxel
的
30
天内因
AEs
死亡。
2
组发生
≥
3级的中性粒细胞减少症的患者分别占
41.8
%和
73.3
%;发生发热性中性粒细胞减少症(
febrile neutropenia















