近年来,我们在转基因工程T细胞治疗新策略的基础研究和临床研究方面都取得了重大进展。嵌合抗原受体(CAR)的修饰赋予T细胞具有肿瘤特异性细胞毒性,从而诱导抗肿瘤免疫。然而,实体肿瘤的组织结构特性,特异性抗原的缺失和强的免疫抑制环境,使得用CAR-T细胞靶向治疗实体肿瘤比治疗B细胞恶性肿瘤更具有挑战性。同时,由于正常组织相对表达靶向标志物引起的靶向/非肿瘤毒性是另一个值得考虑的问题。CAR 载体的优化设计,新的靶标的发现,安全开关的添加和其他治疗手段相结合给以CAR-T细胞为基础对付实体肿瘤的免疫治疗方法带来了新的生机和活力。在这篇综述中,我们关注于限制CAR-T细胞治疗在实体肿瘤中应用的主要困难和总结用于完善这一新的肿瘤治疗模式的一些措施方法。
我们对免疫系统与肿瘤细胞相互作用的认识的提高促进了基于嵌合抗原受体(CAR)或T细胞受体(TCR)修饰T细胞的新治疗策略的迅速发展。CAR-T细胞治疗临床观察取得了巨大的进步,这使得它在肿瘤过继免疫治疗的发展更具吸引力。CARs以一种主要组织相容性复合体(MHC)非依赖的方式赋予T细胞抗原特异性识别、激活和增殖。目前,CARs 快速发展到第三代,包含2个共刺激分子如CD28 + CD134(OX40)或CD28+ CD137(4-1BB),同第一代和第二代CARs相比,这通常具有增强细胞因子产生,提高肿瘤溶解活性和降低活化诱导细胞死亡(AICD)。
新兴治疗方法CAR-T细胞治疗方法引起了极大的兴趣,临床前和临床试验的一些深入研究显示在对多种癌症治疗中取得了令人鼓舞的治疗效果,特别是用CD19 CAR-T细胞治疗B细胞恶性肿瘤。然而,针对实体肿瘤比针对恶性血液病更具有挑战性,这是由于实体肿瘤病理学组织特性,特异性抗原的缺失和局部强的免疫抑制微环境。此外,对靶标/非肿瘤毒性可以构成重大风险。因此,通过优化CAR 载体设计,发现新的的靶标,包含条件安全开关和结合其他策略来开发更有能力更安全的免疫治疗方法是很有必要的。而且还有许多工作要做以提高CAR-T细胞治疗实体肿瘤的疗效作用。这有可能至少部分有可能实现,通过广泛深入的基础研究发现通过CARs的T细胞活化的时空动态和阐明实体肿瘤中T细胞的迁移同实体肿瘤和转移肿瘤根除效果之间的联系。在这篇综述中,我们讨论用CAR-T细胞治疗实体肿瘤的现状和主要障碍,从而提供一些潜在的措施来完善这一新的治疗模式。
2.1 CARs
结构的衍变
专门有报道表明CARs结合抗体精致的抗原特异性和细胞免疫多功能和效力。CAR的独特结构赋予T细胞肿瘤特异毒性和并以MHC非依赖的方式提高抗肿瘤活性,通过病毒载体技术或者转座子系统转染到免疫效应细胞里。经典的CARs由细胞外抗原识别域、铰链结构域、跨膜区和胞内结构域组成。CARs细胞外的抗原结合部分,通常来源于抗原特异性单克隆抗体一个单链可变区片段(scFv),使T细胞与抗原的特异性和亲和力的能力得以保留。铰链区介导CAR的灵活性,传导关键的信号,在保证抗体抗原结合区与抗原相互作用的合适定位中有重要的影响。跨膜结构域是来源于CD3ε、CD4、CD8、OX40、H2-K
b
,有研究已经清楚地证明跨膜结构域确实可以影响CAR-T细胞的功能。其他研究人员研究表明用CD3ε跨膜结构域的CAR-T细胞表现出更强的杀伤活性,而用CD28分子的跨膜结构域的CAR-T细胞更持久。同突变的CD3ε跨膜结构域做比较,未突变CD3ε跨膜结构域诱导增强T细胞的活化。CARs胞内域负责信号传导,这一部分被广泛地操纵用来优化转基因工程T细胞的功能。T细胞活化依赖于免疫受体酪氨酸激活基序(ITAMs)的磷酸化,这一基序存在于TCR复合物中CD3ε的胞浆结构域。信号域对于CAR-T细胞实现抗肿瘤作用很关键,根据信号结构区域的不同组成所构成的CARs会有几种不同的体现。
第一代CARs提供了CAR-T细胞的靶向和活化的证明,但在体内研究中有非常温和的临床活性和差的持续性,为了克服这些局限性,第二代和第三代CARs结合协同刺激分子,包括CD27、CD28、CD134,CD137和ICOS。体内和体外实验表明具有多信号受体的CAR-T细胞持续增值,提高细胞因子的产生,改善肿瘤细胞溶解活性和降低ACID.目前,第二代CAR-T细胞比第三代CAR-T细胞更加广泛地应用于临床试验,因为第三代CAR-T细胞减少的激活阈值可能导致靶向/非肿瘤正常组织的副作用。
2.
2 CARs
技术的治疗优势
使用CARs有一些优于TCR转基因的优势。基于MHC非依赖的抗原识别,CARs能够绕开肿瘤通过下调MHC-I 分子逃避免疫检测的分子机制。从理论上讲,CARs能够检测出几乎所有能被抗体识别的抗原,包括蛋白质抗原、碳水化合物和脂类抗原等,也就是说,CARs更普遍地适用于免疫疗法治疗疾病。此外,CARs细胞内的信号转导结构域具有灵活性,可以设计来补偿肿瘤细胞诱导的共刺激分子表达下调。因此,CAR-T细胞治疗在过继免疫疗法利用最大治疗资源超过TCR-T细胞治疗,后者的主要障碍是效果是HLA/MHC依赖的。
2.3 CAR-T
细胞临床试验
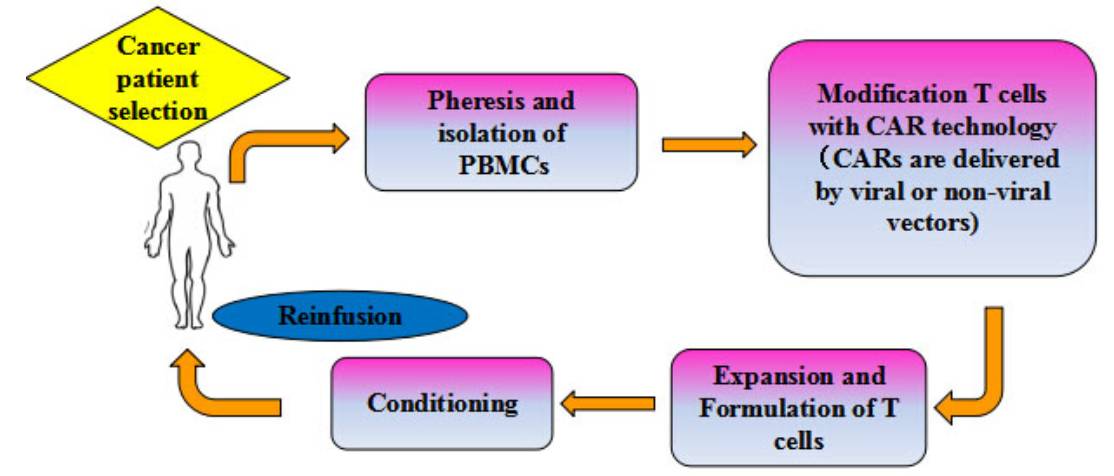
有前途的临床试验给肿瘤患者带来了引人注目的反应,这对激发以CAR-T细胞为基础的过继性细胞免疫治疗在多种肿瘤治疗应用提供了坚实的基础。到目前为止,临床试验利用第二代CD19 CAR-T细胞治疗血液系统恶性肿瘤取得了令人鼓舞的临床反应,CD19-CAR T细胞疗法(CTL019)
已被FDA高度评价并批准作为突破性疗法。目前,靶向CD20的过继性CAR-T细胞对治疗B细胞恶性肿瘤已进入临床试验评价阶段,而其他靶向CD22, CD30和CD33的CAR-T细胞治疗也已经进入体外研究阶段。至今,CAR-T 细胞治疗已经证明成功的作为晚期癌症的一种新的治疗手段,这种手段也成为了全球研究热点。值得提出的是,巨诺(Juno),诺华(Novartis),凯特(Kite)作为全球领先研究CAR-T细胞治疗的大药企归因于它们在CAR-T细胞治疗发展中的开创性贡献。图1显示了在临床治疗用CAR
-T细胞过继免疫治疗的流程图。
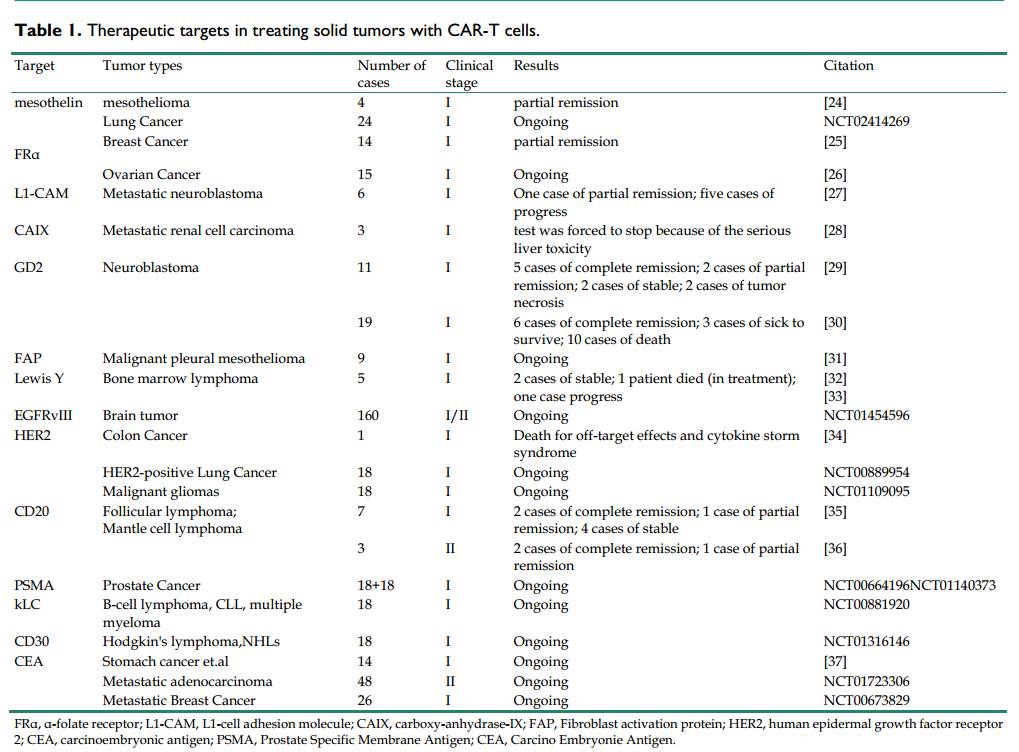
同CAR-T细胞免疫治疗恶性血液病取得显著的临床反应相比,用CAR-T细胞治疗实体肿瘤收到实体肿瘤组织结构,强大的免疫抑制环境所限制,理想靶标的缺失也是治疗实体肿瘤的另一个关键的不足。目前用CAR-T细胞治
疗卵巢癌和成神经细胞瘤的首选靶标分别是FRα和GD2。最新统计与CAR-T细胞免疫治疗实体肿瘤的靶标如表1
所示。
CAR-T细胞通过scFv(通常包含轻、重链可变区)识别细胞表面抗原,以非MHC限制的方式。膜蛋白CD19在几乎所有的B细胞中广泛表达,在B细胞恶性血液病也具有相同的结构特性。所有这些特性导致大多数B细胞恶性肿瘤患者在CD19 CAR-T细胞治疗后表现出令人鼓舞的疗效。但CAR-T细胞治疗在实体肿瘤治疗中的应用严重地受到了异质性特征,肿瘤特异性抗原缺失和免疫抑制微环境的限制。现在我们对CAR-T细胞在实体肿瘤应用中受到的限制因素进行分析以及探讨相关的应对策略。
大多数恶性血液病同造血干细胞再生功能障碍有关,没有形成组织结构。相比之下,实体肿瘤具有特殊的组织病理学特征,比如血管的高浓度,血管壁间隙宽的缺口,大量的血管渗漏,组织结构整体性差等等。这些特征导致实体肿瘤选择性地增强脂质颗粒和大分子物质的渗透性和滞留性。增强的渗透和滞留效应的现象叫做EPR效应。肿瘤浸润淋巴细胞(TIL)大量存在和广泛浸润已经作为多种实体肿瘤病人好的预后和治疗反应良好积极的主要指标,这些实体肿瘤包括结肠癌、肺癌、卵巢癌。实体肿瘤的EPR效应和肿瘤微环境的抑制性在阻碍效应T淋巴细胞浸润到肿瘤组织中发挥着重要的作用。对T淋巴细胞的浸润因素的理解和控制有助于进一步提高靶向肿瘤组织的选择性。
T细胞的转运包括旋转、粘附、外渗和趋化,T细胞向肿瘤微环境的转运是T细胞肿瘤免疫治疗成功的关键。T细胞为基础的免疫治疗对实体肿瘤的临床疗效比晚期黑色素瘤或恶性血液病温和,克服了T细胞迁移的障碍是CAR-T细胞免疫治疗的一个主要挑战,趋化因子受体对失配,粘附分子的下调,和异常的血管也可能导致T细胞的不尽人意的归巢。
研究发现CD3+、CD8+ T细胞和B淋巴细胞浸润与肿瘤高内皮微静脉(HEVs)存在显著相关性。肿瘤HEVs专门位于淋巴细胞集中的区域,高密度的肿瘤HEVs预测着较低肿瘤复发和转移风险。这也是淋巴细胞浸润到肿瘤部位的重要途径,结合临床预后使得它作为肿瘤诊断和治疗的一个指标。内皮素B受体(ETBR)在肿瘤血管中过量表达是另一个限制淋巴细胞浸润到肿瘤组织的因素,它通过阻碍细胞粘附于血管内皮细胞实现。肿瘤血管生成下调了内皮细胞粘附分子,如细胞间粘附分子1(ICAM-1)。上述限制因素阻碍了T细胞归巢,从而影响肿瘤免疫治疗的效率。从理论上讲,抑制EBTR和ICAM-1的上调在治疗上可促进T细胞归巢和提高免疫治疗疗效。ETBR抑制剂BQ-788(一个特定的ETBR抑制肽)在体外试验中显示增加T细胞粘附到内皮细胞上。血管生成是肿瘤细胞生长和转移的先决条件,肿瘤细胞产生一些血管生成因子是ICAM-1的表达下调的原因。例如,以前有证据显示VEGF刺激人脐静脉内皮细胞(HUVECs)后,ICAM-1的表达上调。但相反的是,长时间的刺激(发生在肿瘤的发展过程中)会导致ICAM-1表达下降和白细胞粘附。此外,肿瘤坏死因子-α(TNF-α)诱导的ICAM-1的上调。一些关于加强CAR-T细胞转运到实体肿瘤的策略在下面讨论。
3.1.1
加强
CAR-T
细胞转运到肿瘤部位
实体肿瘤特殊组织结构的一个潜在结果可能在于在肿瘤组织没有观察到足够的T细胞。同样地,没有足够的CAR-T细胞转运到肿瘤位严格限制了实体肿瘤CAR-T细胞治疗的疗效。限制的影响可能来自不利的趋化因子梯度,这意味着肿瘤特异性T细胞缺少肿瘤细胞分泌的趋化因子的相关受体。
肿瘤源性趋化因子是CAR-T细胞免疫疗法有吸引力的靶标,这基于其免疫调节作用:降低肿瘤免疫原性和T细胞趋化因子受体的脱敏。同时,肿瘤细胞通过这种方式利用这种趋化因子提供自分泌生长信号和增强血管生成的信号。所以一旦这些肿瘤细胞被清除,剩下的肿瘤细胞就会更加脆弱。上述机制设想通过给T细胞安装表达相关的趋化因子受体使T细胞改变方向到预定靶点的可能性。一些研究通过给CAR-T 细胞安装表达CXCR2(CXCL1受体),CCR4(CCL17受体),Gro-a,CCL17和CCL2 证实了这一原理。
然而肿瘤细胞采用多种抑制策略,获得具有所有免疫调节基因的CAR-T细胞是很具有挑战性的,这些免疫调节基因通过增加CAR-T细胞转运,生存和安全来克服肿瘤抑制。一些研究人员使用不影响正常细胞的溶瘤腺病毒对付恶性肿瘤细胞来解决这个复杂的任务,这个任务通过安装有溶瘤病毒表达趋化因子RANTES和细胞因子IL-15的CAR-T细胞来完成。
此外,T细胞给入管理的差异对CAR-T细胞的扩张和效应细胞的分化有着重要的影响。研究评价了CAR-T细胞传递两条不同的路线,局部胸膜内给药和常规全身静脉胸膜间皮素靶向M28z CAR-T细胞,相比后者,前者通过避开预留循环瞬态肺隔离症曾现出强大的T细胞持久性和增强抗肿瘤疗效。同样,对CAR-T细胞脑内注射的方法已被应用于CAR-T细胞治疗胶质母细胞瘤y用以避免血脑屏障的转运阻塞。局部输入CAR-T细胞的神通在于提供了一种新的方法提高功能性T细胞的持久性和改善治疗效果,这些通过选择有利的CAR-T细胞给入途径来实现。
3.1.2
工程
CAR-T
细胞释放细胞因子促进肿瘤消除
炎性细胞与肿瘤细胞的生长和转移有显著相关性,说明通过转基因CAR-T细胞分泌的细胞因子(如IL-12)调节肿瘤基质改进CAR-T细胞治疗。该机制就是T细胞受到CAR载体活化分泌IL-12,这可以进一步激活先天免疫细胞应答针对那些CAR-T细胞不能识别和抗原导向免疫治疗不能到达的肿瘤细胞,T细胞重新定向普通细胞因子介导的杀伤过程也称为TRUCKs。TRUCKs 已经被证明在临床前抗肿瘤治疗中有显著疗效。所以设计肿瘤靶向CAR-T细胞加上通过CAR同源抗原参与后CAR 诱导细胞因子盒子(这被一些科学家称为第四代CARs),比如CAR诱导IL-12,这被发现用来招募巨噬细胞反应。这种设计可以用来弥补CAR-T细胞不能消除隐蔽的肿瘤病变的缺陷,以减少系统毒性相关的方式。
3.1.3
优化
CAR-T
细胞的培优条件
细胞因子和刺激条件在CAR-T细胞制造过程中是不可缺少的成分,一些研究显示细胞因子和生长条件对免疫T细胞的扩增和表型的影响。因此,细胞因子的选择决定和生长条件的优化对CAR-T细胞的扩增和相关抗肿瘤的活性很关键。IL-17,IL-15和IL-2经常作为CAR-T细胞培养的生长因子。有研究表明T细胞在IL-7和IL-15以及串行抗原刺激下呈持续扩增和优越的生存能力,从而增强细胞持久性和抗肿瘤活性。总之,这些方法会使CAR-T细胞更好的生存条件,可以转化到临床免疫治疗中。
实体肿瘤的生物学结构的异质性是实体肿瘤CAR-T细胞免疫治疗的一个重要的限制因素。肿瘤异质性可能是由主体因素和个体因素共同作用的结果。主体因素包括细胞起源和患者种族的差异,遗传和表观遗传变化引起的多样性。个体因素主要由肿瘤患者生理异质性、肿瘤内异质性、个体肿瘤不同分布、肿瘤干细胞的存在或进化方向等因素引起。肿瘤的异质性使得免疫治疗的靶标只是肿瘤细胞的一部分,这会恶化病人的预后和增加肿瘤转移和复发。因此,实体肿瘤CAR-T细胞治疗最有利的方法是识别和预测特定的细胞表面抗原,但这种方法会由于高异质性的情况下引起的肿瘤特异性抗原(TSA)的缺少而造成严重地阻碍。后面的方法是靶向相对在肿瘤细胞表面过量表达肿瘤相关抗原(TAA),但CAR-T细胞靶向TAA会引起正常组织的附带损伤。因此,新的策略提高临床实践安全的同时要保持CAR-T细胞的抗肿瘤活性,包括靶向肿瘤细胞特异性的新抗原,这些抗原来源于肿瘤细胞的体细胞突变(如WT1,WT1基因诱导产生的肽),通过双信号独立通路对CAR-T细胞的优化,以及自杀基因和其他安全开关的应用。
3.2.1
靶向肿瘤细胞突变表型的转基因
CARs
表皮生长因子受体(EGFR)是HER2家族的成员,在肿瘤中经常高表达,与临床治疗的疗效呈负相关,这使得它成为一个鼓舞人心的研究靶标。研究人员发现,40–70%脑肿瘤表达突变型EGFR变异III(EGFRvIII),是缺失2-7外显子的 EGFR,这导致细胞外配体结合域缺陷和不依赖与配体的组成型激活。在肿瘤细胞的特异性表达,与肿瘤的侵袭,血管再生和患者的生存率有显著相关性使得EGFRvIII成为新的有前途的靶点。携带多克隆CTL的肿瘤特异性TCR可以避免细胞免疫治疗的许多障碍,这被称为“'T-body ''方法。体系被采用来治疗EGFRvIII表达胶质瘤,并且产生的T-body方法能够分泌细胞因子和以EGFRvIII依赖性的溶解肿瘤细胞。本研究给我们带来CAR-T细胞治疗新的研究方向,那就是靶向肿瘤细胞突变引起的特异性肿瘤细胞表型。
3.2.2
修改
CARs
更好地靶向肿瘤相关抗原
肽/ MHC I类分子复合物的识别赋予T淋巴细胞特异性抗肿瘤疗效和增强细胞因子的分泌。同时,将共刺激信号或CD8粘附分子加入到CARs中可以增强T细胞的活化。WT1肽,存在于HLA-A *02:01(RMF / A2)中,是一种重要免疫验证致癌靶标,在正常组织中有限表达,而在大多数白血病和多种实体肿瘤高表达,特别是恶性间皮瘤和卵巢癌。因此,CAR-T细胞靶向WT1是一个很好的改进项目。改进的CAR-T细胞,含有来自全人单克隆抗体识别抗原的TCR样的ESK1(称为WT1 28z)已发现通过靶向细胞内的癌基因WT1对原发性AML骨髓细胞有毒性作用。同其他抗原靶标相比,WT1 28z CAR-T细胞显示提高分泌促炎性细胞因子,如IFN-γ,IL-2。TCR样单链CAR-T细胞被证明可以通过scFv亲和力成熟进一步增强治疗潜力,如TCR样Q2L单克隆抗体来源的scFv。因此,这些研究表明通过双向改造CAR-T细胞靶向细胞内抗原可改进CAR-T细胞的抗肿瘤活性。
间皮素,一种分子量为40 kDa的细胞表面的糖蛋白,中晚期实体肿瘤的临床治疗中获得越来越多的关注,归因于其在许多实体肿瘤细胞表面高表达。据美国癌症研究协会的报道,诺华公司和宾夕法尼亚大学正在进行临床 I 期研究,meso-CAR T 细胞输入到晚期癌症患者,这些患者不再对先前的多种治疗有回应,结果表明对治疗的患者是安全的并有良好的效果(见表1)。
间皮素被发现也在正常组织中表达,这引发了一个问题,meso-CART细胞可能破坏健康的组织和器官。研究人员发现一些证据表明在患者心脏周围的体液中检测到了 meso-CAR T细胞,但没有相关的毒性反应报道。虽然meso-CART细胞方法仍在评估,毫无疑问,间皮素是另一个有希望的靶标蛋白,有可能开辟对各种实体肿瘤患者有利的治疗方法。
3.2.3
调整
CARs
亲和性选择性地靶向肿瘤细胞
为了提高CAR-T细胞的特异性,设计独立的双CAR体系来识别两个不同的肿瘤抗原,分别传输第一信号和第二信号对T细胞活化必不可少的。共转导的T细胞保持治疗疗效是在第二代和第三代CARs的基础上而来,这是广泛使用的CAR-T细胞方法可以避免潜在的安全问题。
从理论上讲,共转T细胞只杀死表达两种抗原(双阳性)的肿瘤细胞,而不是只表达单抗原(单阳性)的肿瘤细胞。然而,有研究证实共转导的T细胞对单阳性和双阳性肿瘤细胞都有杀伤作用。最可能的解释是,带有第一个信号的CARs对T细胞有太强的刺激作用,即使没有第二个信号也会激活T细胞。因此在2012,Kloss CC和同事在双CAR体系中降低负责传导第一信号的CARs的亲和力,报道共转染CAR-T细胞并没有表现出对单阳性肿瘤细胞的杀伤活性但对双阳性的肿瘤细胞有杀伤活性。这项研究开启了通过调整亲和力增加CAR-T细胞特异性和安全性能。
近年来,上述策略的有效性,通过调整CARS组分中scFv 的亲和力可以选择性地靶向肿瘤细胞而不是正常细胞,被进一步验证,这样可以减少脱靶效应,提高安全性。由于EGFR表达密度的不同,通过调整CAR功能的亲和力可以选择性地靶向过度表达EGFR的肿瘤细胞而不是靶向正常细胞。使用亲和调整过的scFv靶向HER2发现下降scFv的亲和力明显增加CAR-T细胞治疗指数。因此,提高以CAR-T细胞为基础的实体肿瘤免疫治疗方法安全性的另一个方向是调整CARs功能亲和力辨别出过度表达靶标的肿瘤细胞而不是在生理水平表达靶标的正常组织。
3.2.4
应用自杀基因增强
CAR-T
细胞治疗的安全性
CAR-T细胞临床应用表明抗肿瘤疗效与一定程度的细胞毒性相关,特别是靶向TAAs,这些也在正常细胞中表达。因此需要采取策略用来扭转细胞毒性效应。
在CAR结构中加入“理想”的自杀基因,可以选择性地杀死基因修饰的T细胞,从而防止对正常组织或器官的附带损害。因此,CAR-T细胞应用加入一个或两个自杀基因的转基因表达是明智的,同时,选择性自杀基因将通过不可逆地消除具有不必要的毒性的特定部分细胞来确保安全性。目前,两个已经验证的自杀基因,单纯疱疹病毒胸腺嘧啶核苷激酶(HSV-TK)和诱导caspase-9(iCasp9),已被成功地应用于临床,这加强CAR-T细胞治疗在恶性血液病中的安全性。所以应用自杀基因修饰CAR-T细胞可以大大提高安全性和临床疗效。
实体肿瘤的CAR-T细胞治疗的临床疗效不如治疗恶性血液病患者,由于疗效显著地受到实体肿瘤的强免疫抑制环境的阻碍。CAR-T细胞的积累与在实体肿瘤失活率之间的相对动力学将最终决定整体抗肿瘤疗效,这种平衡可能是肿瘤特异性的。影响实体肿瘤微环境中T细胞效率的限制因素主要有两个方面:1)微环境特征,如缺氧、低pH、精氨酸或色氨酸缺乏、肿瘤衍生细胞因子的抑制作用等,2)对活化T细胞的抑制途径,包括抑制受体上调的内源性抑制通路,抑制T细胞受体通路的细胞内抑制途径和T细胞活化后的效应器功能。实体肿瘤微环境中通过多种机制使得新一代CAR-T细胞失活可逆。有研究表明,CAR-T细胞在实体肿瘤微环境中经历功能活性快速损耗限制其疗效,但功能降低是可逆的当CAR-T细胞从肿瘤中分离出来。这种可逆特性是否可以归因于肿瘤微环境中的抑制因子的去除正在研究中。因此,通过结合其他实体肿瘤治疗方法来优化CAR-T细胞治疗很有意义。
3.3.1
工程
CARs
转变免疫调节信号通路
如上所述,实体肿瘤采用多种措施削弱CAR-T细胞的功能。在肿瘤微环境中,活化的CAR-T细胞被负调节信号通路搞得很疲惫,包括同源配体与在T细胞表达上调抑制受体反应的和T细胞共刺激受体配体的缺乏。肿瘤利用负控信号减弱CAR-T细胞反应,如程序性死亡配体1(PD-L1),同在活化的T细胞上表达的程序性死亡受体1(PD-1)相互作用,这就耗尽了CAR-T细胞。因此开发新的工程策略来装备CAR-T细胞使其具有将肿瘤阴性信号调节通路转换成调节通路的能力是很有帮助的,比如构造一个新的嵌合体,通过交换CD28和4-1BB跨膜区和胞质尾,将同源配体转化为T细胞共刺激受体的配体。验证PD1:CD28嵌合体被证明有效的,把PD-L1转换成含有人原发性CD8+CTL共刺激配体,从而增强细胞因子的分泌,增加增殖能力和增强抗肿瘤活性。这是合理的推测,通过遗传修饰的CAR-T细胞表达上述新型嵌合体大大提高抗肿瘤功能,同时为在实体肿瘤的免疫抑制的环境下提高CAR-T细胞治疗的临床疗效提供了一个平台。
3.3.2
工程
CARs
靶向基质细胞
随着实体肿瘤免疫学研究的深入,肿瘤相关基质占肿瘤体积的90%,在肿瘤的发生和发展中扮演的角色得到了越来越多的关注。肿瘤相关成纤维细胞(CAFs),肿瘤间质的主要成分,在高度致瘤性和介导耐药的免疫微环境形成方面具有非常重要的影响。此外,靶向肿瘤相关抗原(TAAS)的CAR-T细胞免疫疗法往往不能根除CAFs,它直接通过旁分泌细胞因子和生长因子来支持肿瘤发展。
因此,靶向TAAs CAR-T细胞和靶向CAFs CAR-T细胞相结合可能会增强抗肿瘤功能。同单独靶向CAFs或者靶向肿瘤细胞相比,同时靶向CAFs和肿瘤细胞的方法被验证显著地提高了抗实体肿瘤作用。找到表达在大多数实体肿瘤中CFAs上的免疫治疗的靶标是必要的,成纤维细胞活化蛋白(FAP),α2型的二肽基肽酶,是在几乎癌间质细胞主要子集的标志物,使其成为一个有吸引力的治疗靶标。研究表明,表达FAP特异性抗原的转基因T细胞能有效识别和杀死FAP阳性肿瘤细胞。结合靶向TAAsCAR-T细胞和靶向FAP特异的CAR-T细胞呈现更加有吸引力的抗肿瘤作用。这种新的组合为实体肿瘤免疫治疗提供了另一个方向。
3.3.3
结合免疫检查点抑制剂或细胞因子表达的溶瘤病毒
肿瘤免疫治疗领域已大大扩展了一些新的治疗方案:免疫检查点抑制剂,肿瘤疫苗和过继性T细胞免疫疗法。但是,在疗效上也存在很多弊端,如免疫检查点抑制剂仅在几例高突变的黑色素瘤和肺癌中有效,不利的微环境导致CAR-T细胞治疗实体肿瘤的疗效有限。因此,免疫检查点抑制剂联合的CAR-T细胞治疗可能是一个解决方案。最近,CAR-T细胞治疗联合免疫检查点抑制剂,它可以通过减少免疫抑制效应创造更加有利的环境提高CAR-T细胞治疗效果,很多检查点抑制剂联合CAR-T细胞治疗的临床试验正在进行中。除了免疫检查点抑制剂,CAR-T细胞治疗也被联合溶瘤病毒表达的趋化因子RANTES和细胞因子IL-15,并通过改善CAR-T细胞转运和招募固有免疫细胞增强的CAR-T细胞功能。总之,CAR-T细胞治疗联合其他方法对实体肿瘤治疗有着巨大的潜力。
CAR-T细胞为基础的免疫治疗在对B细胞恶性肿瘤中取得了巨大成功,但针对实体肿瘤仍然是一个艰巨的任务主要是由于TSAs的缺乏和实体肿瘤的抑制环境。然而,研究人员一直试图从多方面提高CAR-T细胞治疗各种实体肿瘤的疗效:1)细胞因子或趋化因子有增强T细胞的浸润和招募其他免疫效应;2)优化培养条件下获得更有效的CAR-T细胞;3)修改靶标系统通过改变抗原识别域向细胞内抗原或新抗原甚至双向;4)应用双靶标系统,调整scFv的亲和力,应用安全开关,从而减少靶向/非肿瘤效应;5)与其他治疗方法相结合,更彻底地清除肿瘤细胞。很多靶向不同抗原的CAR-T细胞治疗实体肿瘤的临床试验正在进行中。然而,CARs如何激活T细胞的机制研究,CAR和TCR之间的比较,和CARs的每个元件的优化仍然需要的为更好地在实体肿瘤中运用CAR-T细胞为基础的免疫治疗。
参考来源:
Zhang H, Ye ZL, Yuan ZG, Luo ZQ, Jin HJ1, Qian QJ.New Strategies for the Treatment of Solid Tumors with CAR-T Cells.Int J Biol Sci. 2016 Apr 28;12(6):718-29.
识别微信二维码,添加抗体圈小编,符合条件者即可加入抗体微信交流群!
请注明:姓名+研究方向!