
![]()
凭借出色的产品生命周期管理,Acular的产品线在长达17年的时间中不断焕发光彩,并仍在续写辉煌。
专利应永远服务于产品和商业目的,好的专利组合能够在药品的生命周期管理中发挥巨大作用。
在产品研发的道路上,当把产品的持续改进、专利策略和市场独占期结合起来利用时,往往能够充分延长产品的生命周期,从而在竞争中立于不败之地
。Acular就是一个非常好的例子,从1992年首次获批上市,到2009年Apotex的仿制药登上历史舞台,依靠持续创新+专利组合+市场独占期的相互支撑,Acular在17年中一路高歌猛进,并仍在续写辉煌。
Acular 0.5%
Acular 0.5%
Acular 0.5%的诞生
上世纪70年代早期,Syntex SA (1994年并入罗氏旗下)的科学家们发明了一种非甾体抗炎药(NSAID)–酮咯酸(酮咯酸氨丁三醇),其随后被美国FDA批准用于作为强效镇痛药。Syntex获得了保护这一发明的若干专利,分别涉及:
该化合物本身的新化学实体(NCE)、用该化合物治疗严重疼痛的用途和该化合物的制备方法
。
随后,人们继续对这个化合物的性质和潜在的医药用途进行研究,并发现,可以通过局部施用该化合物来治疗某些眼疾。
相应地,Syntex又获得了一个新的专利,保护用包含酮咯酸氨丁三醇的局部制剂来治疗眼疾的这个新用途
。为了把这个新的用途与产品结合起来,他们继续尝试把这个化合物加到眼药水的配方中使用。然而,事情进展得并不顺利,研究人员们一直没找到可靠、稳定的制剂解决方案。Syntex的制剂专家们花费了数年时间,进行了成百上千次尝试。终于,功夫不负有心人,他们发现,通过使用一种特殊的稳定剂可以很好地解决这个问题。
基于此发明,Syntex获得了另一个专利,保护包含这种特殊稳定剂的酮咯酸氨丁三醇眼用制剂
。
1992年11月9日,FDA批准了Acular 0.5% 这个眼药水产品,在FDA的橙皮书中一共列出了三个与此药相关的专利,如下图所示:
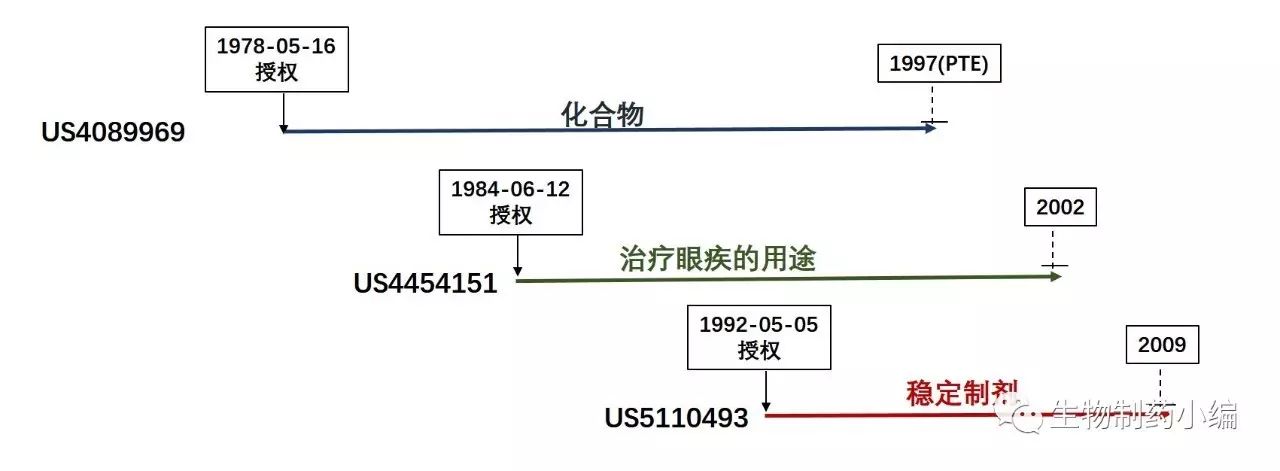
可以看到,
保护药品活性成分(化合物本身)的专利US4089969因受惠于专利期延长,将于1997年到期,保护治疗眼疾的医药用途的专利US4454151于2002年到期,而保护稳定制剂的专利US5110493于2009年到期
。因为US4089969的专利保护期已被延长,对于涉及后续改进的专利US4454151和US5110493将无法再要求延长专利保护期(PTE)。
在市场独占期方面,由于原研药企业根据FDA的要求开展并完成了儿科用药的相关研究,
Acular 0.5%获得了6个月的儿科独占期延长。由于采用了新的制剂并针对新的适应症,Acular 0.5%还获得了3年的市场独占期
。上世纪九十年代,原研药企业开展了利用Acular 0.5%进行的针对孤儿药适应症(白内障手术后的炎性反应)的临床研究,
并于1998年获批用于该孤儿药适应症,且相应地获得了7年的孤儿药独占期(仅适用于白内障手术后的炎性反应这一适应症)
。
综上,围绕Acular 0.5%的专利保护期与市场独占期的相互关系如下图所示。
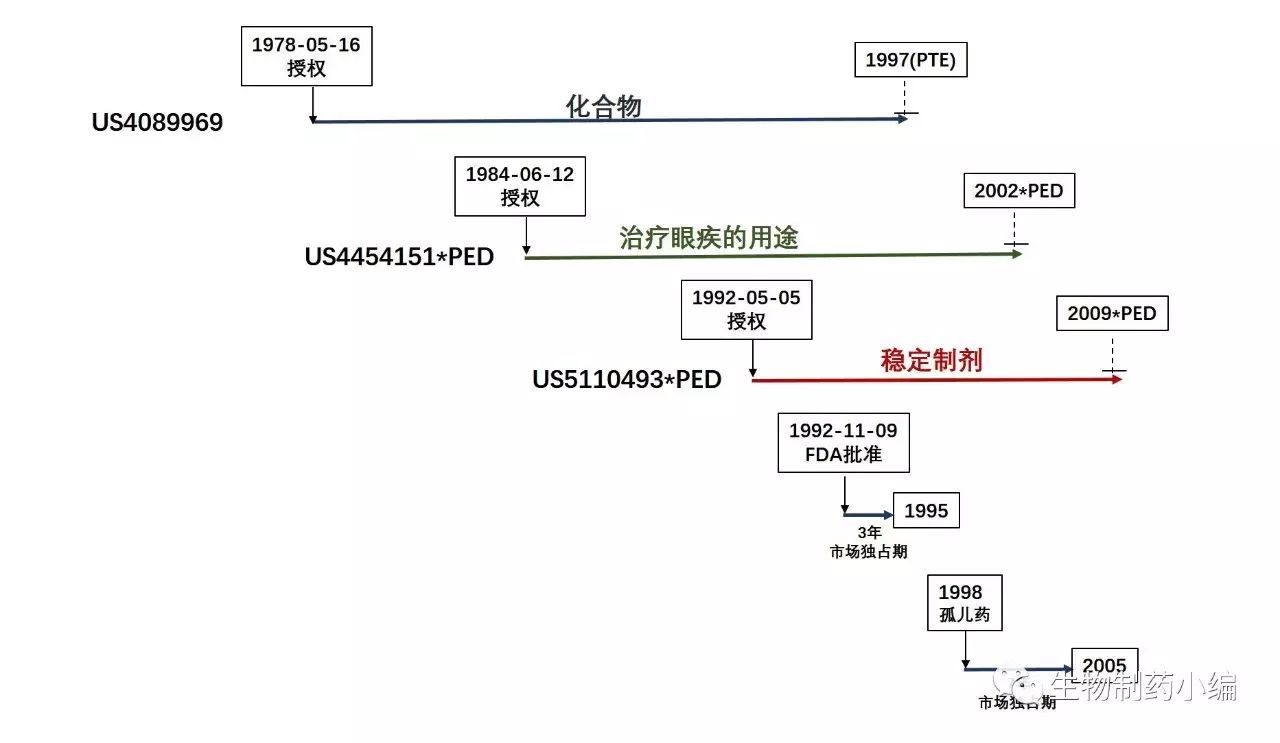
可见,如果没有专利保护,Acular 0.5%将于1995年失去市场独占权,即使加上6个月的儿科用药独占期,也将于1996年失去市场独占权(孤儿药适应症除外)。针对孤儿药适应症,如果没有专利保护,Acular 0.5%将于2005年失去市场独占权。也就是说,
如果完全没有专利保护,用于非孤儿药适应症的仿制药将在1996年就能够上市销售了,比最终的2009年早了整整13年
。
那么如果只有保护化合物的专利,情况又是怎么样的呢?如果只有保护化合物的专利,即使算上专利期延长(PTE),Acular 0.5%也将在1997年失去独占权(孤儿药适应症除外)。换言之,
如果没有保护后续改进的两个专利,用于非孤儿药适应症的仿制药将在1997年就能够上市销售了,比最终的2009年早了整整12年
。
可见,除了保护药物活性成分的专利外,保护后续改进的一系列专利(例如,针对改进的制剂、新的医药用途等)对于延长药品生命周期也将起到至关重要的作用。
来自Apotex的挑战
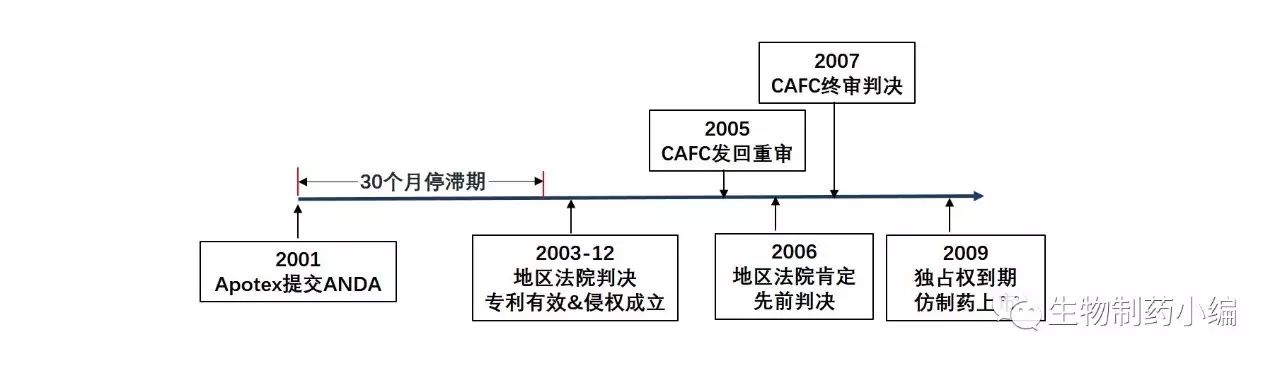
2001年,来自加拿大的仿制药公司Apotex递交了针对Acular 0.5%的ANDA申请。
Apotex的ANDA申请仅涉及非孤儿药适应症,因为针对孤儿药适应症的市场独占权要到2005年才到期。在ADNA申请中,
Apotex同时递交了第IV段声明,认为橙皮书中列出的保护制剂的专利US5110493无效,且仿制药不侵权
。
面对Apotex的ANDA申请,原研药企业(Allergan,其从罗氏许可获得了Acular的相关权利)果断在45天的规定时间内向地区法院提出了针对Apotex的专利侵权诉讼。
相应地,Apotex的ANDA申请自动进入30个月的停滞期。也就是说,从Allergan收到Apotex提出第IV段声明的告知函之日起30个月内(或到法院作出判决时为止),FDA不能批准Apotex的ANDA申请
。
旷日持久的专利侵权诉讼一直持续到2003年夏天,眼看30个月的停滞期就要结束了,法院还没有作出最后决定。
在Allergan的请求下,法院又将30个月的停滞期延长到了2003年年底,并且终于在2003年12月份判定US5110493专利有效且侵权行为成立(Syntex and Allergan v. Apotex, 2003)
。 Apotex表示不服,继续上诉到联邦巡回法院(CAFC),CAFC在2005年作出决定将此案发回地区法院重审以进一步查明事实。2006年,地区法院经查,认为先前的判决没有错误,而CAFC也于2007年认可了地区法院第二次作出的决定。Apotex仍不死心,希望最高法院能够提审此案,但是最高法院拒绝了这个请求,于是本案至此尘埃落定。
根据Hatch Waxman法案的相关规定,法院要求FDA在US5110493专利到期+6个月的儿科用药独占权到期前不可批准Apotex的ANDA申请
。于是,Apotex折腾了一大圈,也只能乖乖等到2009年专利过期,其仿制药才能上市销售。下图中总结了Apotex与Allergan长达6年(2001-2007)的专利纠葛。
Acular LS
Acular 0.5%
Acular LS的诞生
虽然Acular 0.5%销量不错,但它有个很明显的缺点:使用时会引起眼内短暂的灼烧感和刺痛。为了解决这个问题,Allergan(如上文所述,Allergan从Syntex许可获得了Acular的相关权利)开始研发一种新的制剂,其中降低了活性成分的浓度(由0.5%降低到了0.4%)却可以保持药效相当,而且显著增加了使用的舒适度。受试者使用后,均表示使用这种改良的制剂后灼烧感和刺痛都减轻了。由于改良制剂的这一功效,Allergan开展了新的临床试验来检测新制剂在缓解Lasik角膜手术后的眼部疼痛和灼痛方面的效果,并随后就这个改进的产品Acular LS成功获得了FDA批准。
升级换代后的Acular LS于2003年上市,并且在橙皮书里列出的一众专利中,也包括保护稳定制剂的US5110493(正是处于Acular专利纠纷旋涡中心的那个专利)
。此外,基于新的适应症,Acular LS还获得了3年的市场独占期。
此后不久,Apotex紧紧跟上,仿制了改进后的Acular LS,并于2004年10月向FDA递交了另一个ANDA申请,且提交了第IV段声明,声称US5110493无效且其仿制药产品不侵权。Allergan这次仍然当机立断,在45天内提起了侵权诉讼(于是触发了30个月的自动停滞期),而双方在之前交战过的地区法院再次交锋。
2007年,同一个地区法院作出决定,认定涉案专利有效且侵权行为成立,CAFC于2008年再次认可了地区法院的决定,这时候30个月的自动停滞期也刚刚过。最终,Apotex的仿制药仍然要等到2009年专利过期后才能上市
。
让我们来回顾一下Acular LS的故事,如果没有制剂专利US5110493的保护,Acular LS的市场独占权将在2006年到期,而稳定的制剂专利权使Apotex的仿制药延后了3年才上市。
Acuvail
Acuvail
创新在继续
因为预见到Acular和Acular LS的仿制药将在2009年专利到期后上市,
Allergan早早做了准备,并于2009年7月推出了Acuvail,这也是一款有专利保护的产品
,包含0.45%的酮咯酸、不含防腐剂、为单位剂量剂型。此外,Acuvail含有羧甲基纤维素以改善患者使用的舒适度,其用于治疗白内障手术后的疼痛和炎性反应。所以,从某种意义上来说,Acular的产品线仍然保持生机,且将至少持续到2029年相关专利到期为止。
Acular的故事展示了如何综合利用产品的持续创新(化合物、新的医药用途、制剂)、前瞻性专利布局、橙皮书专利披露、专利期延长和四种不同的FDA独占权(新用途、新制剂、孤儿药和儿科用药)来尽量延长药品的生命周期
,并且不断为患者提供更舒适、更有效的产品。正是因为进行了积极有效的产品生命周期管理,Acular的产品线在长达17年的时间中一直立于不败之地。
* 以上文字仅为个人意见,不代表本公司观点,亦不构成法律意见或咨询建议。
生物医药的专利江湖系列文章请点击阅读:
【01】
生物医药的专利江湖:引子
【02】
生物医药的专利江湖:PD-1抗体
【03】
生物医药的专利江湖:Tecfidera
【04】
生物医药的专利江湖:Cyramza
【05】
生物医药的专利江湖:Dupilumab
【06】
生物医药的专利江湖:生物类似药出海的专利策略(一)
【07】
生物医药的专利江湖:生物类似药出海的专利策略(二)
【08】
生物医药的专利江湖:生物类似药出海的专利策略(三)
【09】
生物医药的专利江湖:前专利时代与后专利时代的制药业
【10】
生物医药的专利江湖:Ibrutinib
【11】
生物医药的专利江湖:阿达木单抗
【12】
生物医药的专利江湖:基因编辑的世界





