百奥泰于7月8日获上交所受理科创板上市申请,是否最终获准注册有待监管部门进一步审批
。
摘要
公司
主营情况:
百奥泰生物制药股份有限公司成立于
2003年,是一家专注于创新药和生物类似药研发、生产的创新型生物药企业。
目前公司共有21个在研产品,主要用于治疗肿瘤、自身免疫性疾病以及心血管疾病。
公司尚处于前期研发投入阶段,2016-2018年及2019年1-3月,公司产生亏损净额分别为1.37、2.36、5.53及5.32亿元,尚处于研发投入期。
行业格局和公司竞争优势:
公司
已提交上市申请和处于临床试验阶段的产品包括
4个生物类似药和6个创新药,其中阿达木单抗生物类似药BAT1406已提交上市申请,巴替非班BAT2094、贝伐珠单抗生物类似药BAT1706、曲妥珠单抗偶联药物BAT8001、托珠单抗生物类似药BAT1806这4个产品处于Ⅲ期临床试验阶段,BAT1306处于Ⅱ期临床研究阶段,BAT8003、戈利木单抗生物类似药BAT2506、BAT4306F、BAT5906等4个产品处于Ⅰ期临床研究阶段。抗体药物靶点涵盖目前全球销售量排名前十的多个品种,包括VEGF、TNF-α、HER2、PD-1、CD20等,其中阿达木单抗、贝伐珠单抗、托珠单抗2018年全球销售额分别为205、68.5、22.1亿美元,在国内企业同类产品研发中,公司研发进度靠前。百奥泰拥有具有自主知识产权的抗体酵母展示筛选平台、ADC技术平台及抗体生产平台,具有较强的可持续研发能力。
募投项目投向:
本次发行股数不低于发行后总股本的
10%,发行股数不超过6000万股,发行后总股本不超过41408万股,拟募集资金20亿元,用于药物研发、营销网络建设和补充营运资金,有望提高公司自主创新及商品上市后推广能力。
适用
估值方法及建议:
公司符合科创板上市标准中的:预计市值不低于人民币
40 亿元,主要业务或产品需经国家有关部门批准,市场空间大,目前已取得阶段性成果。
医药行业企业需至少有一项核心产品获准开展 II 期临床试验,其他符合科创板定位的企业需具备明显的技术优势并满足相应条件。
公司核心产品均在研发阶段,暂无产品上市销售,建议使用EVA法进行估值。
风险提示:
药物研发及上市风险、存在累计未弥补亏损及持续亏损的风险。
正文
1. 公司主营情况
百奥泰在研产品丰富
,抗体药物靶点涵盖多个重磅品种。
百奥泰生物制药股份有限公司成立于
2003年,是一家专注于创新药和生物类似药研发、生产的创新型生物药企业。目前共有21个在研产品,主要用于治疗自身免疫性疾病、肿瘤以及心血管疾病。其中已提交上市申请和处于临床试验阶段的产品包括4个生物类似药和6个创新药,阿达木单抗BAT1406已提交上市申请,巴替非班BAT2094、贝伐珠单抗BAT1706、曲妥珠单抗偶联药物BAT8001、托珠单抗BAT1806这4个产品处于Ⅲ期临床研究阶段,BAT1306处于Ⅱ期临床研究阶段,BAT8003、戈利木单抗BAT2506、BAT4306F、BAT5906等4个产品处于Ⅰ期临床研究阶段。公司自主研发的抗体药物靶点涵盖目前全球销售量排名前十的多个品种,包括VEGF、TNF-α、HER2、PD-1、CD20等。
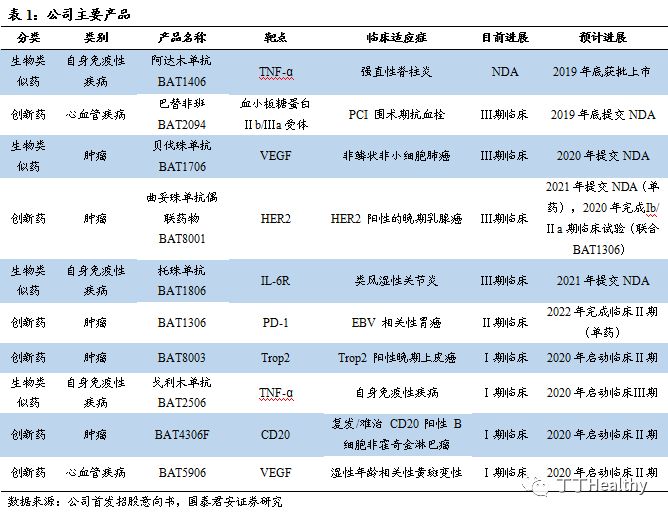
公司仍处于亏损阶段。
2016 年度、2017 年度、2018 年度以及 2019 年 1-3 月,公司产生亏损净额分别为1.37亿元、2.36亿元、5.53亿元及5.32亿元,公司的绝大部分经营亏损由研发项目产生的成本以及与经营有关的行政开支导致。
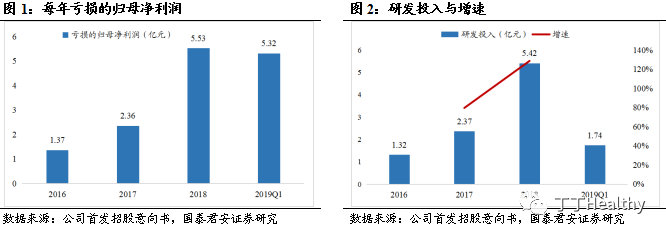
公司具有可持续研发的能力。
公司已申请上市及进入临床
Ⅲ期的研发项目较为丰富。在研产品均通过具有自主知识产权的抗体酵母展示筛选平台、ADC(Antibody Drug Conjugates,抗体药物偶联物)技术平台及抗体生产平台研发,已形成可持续的研发能力。已处于上市申请状态的阿达木单抗BAT1406上市后有望为公司累积产品商业化经验。
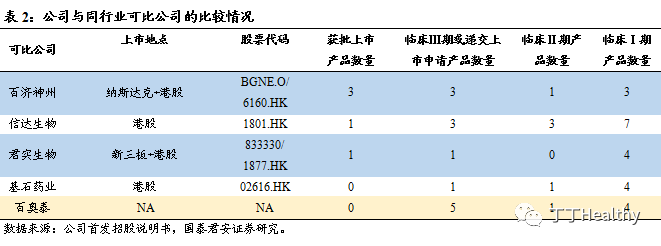
2. 行业格局分析以及公司主要竞争优势
2.1. 自身免疫性疾病
2.1.1 已申报 NDA 产品-阿达木单抗生物类似药BAT1406
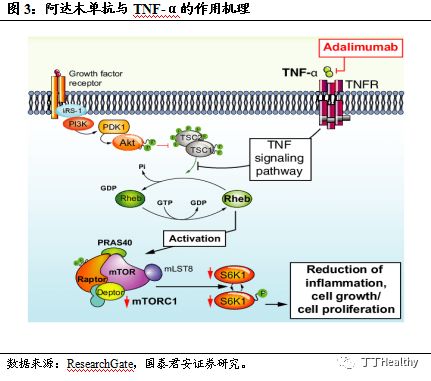
BAT1406与TNF-α的作用机理。
BAT1406是公司自主研发的阿达木单抗生物类似药,为抗人肿瘤坏死因子(Tumor Necrosis Factor,TNF)的人源化单克隆抗体,对应原研药物为艾伯维(Abbvie)的修美乐®。TNF-α是一种重要的细胞因子,
在正常人体状态下参与肿瘤杀伤,但在病理条件下过量的
TNF-α分子会引起促炎症因子的释放,从而导致了自身免疫疾病,包括了类风湿关节炎(RA),系统性红斑狼疮,银屑病等疾病。
BAT1406是由中华仓鼠卵巢细胞(CHO细胞)表达的重组全人源单克隆抗体,通过与TNF-α特异性结合并中和其生物学功能,阻断其与细胞表面TNF-α受体相互作用,从而阻断TNF-α的致炎作用。
全球销售冠军修美乐
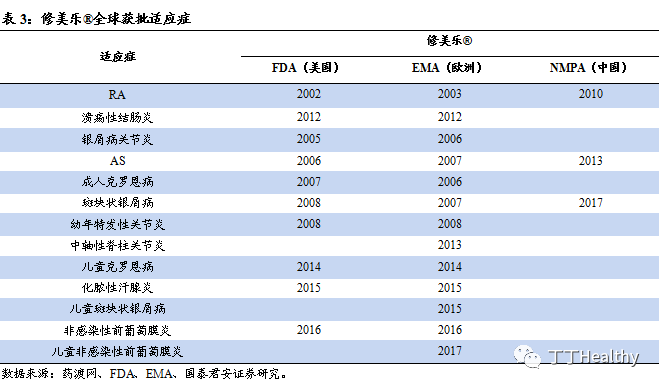
®在中国获批AS、RA及斑块状银屑病的适应症,克罗恩病已完成临床
Ⅲ
期试验。
修美乐
®于2002年在美国上市,已获批包括
类风湿关节炎
(
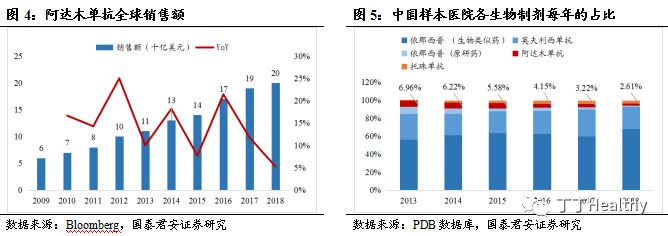
RA)、强直性脊柱炎(AS)、斑块状银屑病、克罗恩病、幼年特发性关节炎和葡萄膜炎等 10 项适应症,连续7年销售收入位于全球首位,保持平均15%的增速,2018年销售收入达到205亿美元。2010年,修美乐®在中国上市,获批3项适应症包括AS、RA及斑块状银屑病,克罗恩病已完成临床Ⅲ期试验。修美乐®抗体序列专利分别于2016 年、2017 年及 2018 年在美国、中国及欧洲到期,Amgen研发的ABP501(Amgevita®/ Amjevita®)、BI研发的BI695501(Cyltezo®)、Samsung Bioepis研发的SB5(Imraldi®)和Sondoz研发的GP2017(Hyrimoz®)均已作为阿达木单抗的生物类似药在欧盟获批上市,其中的ABP501、 BI695501和GP2017在美国也已按生物类似药获准上市。
2023年RA患者将达到608万,生物制剂为二线治疗方案。
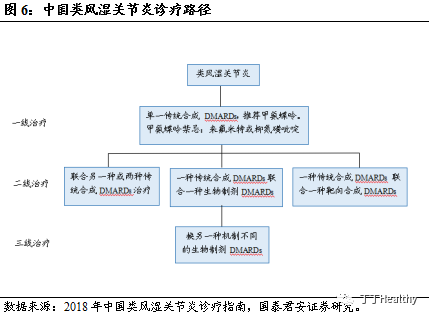
RA是一种以侵蚀性关节炎为主要临床表现的自身免疫病,是阿达木单抗适应症中患者数量增长最快的。据中华医学会风湿病学分会统计,中国大陆地区发病率为0.42%。根据Frost & Sullivan统计,2018年中国RA患者数量为587.8万,2014-2018年复合增长率为0.6%。预计2023年中国类风湿性关节炎患者人数将达到 608.0 万,年复合增长率为0.7%,。根据2018年中国类风湿关节炎诊疗指南推荐,RA患者一经确诊,应尽早开始使用单一传统合成改变病情抗风湿药(DMARDs)治疗。当单一传统合成 DMARDs(推荐甲氨蝶呤)治疗未达标时,可以使用二线治疗方案,即联合另一种或两种传统合成DMARDs治疗、或一种传统合成DMARDs联合一种生物制剂DMARDs或一种靶向合成 DMARDs 进行治疗。
修美乐
®价格高昂,目前中国市场渗透率较低,国产阿达木单抗上市后有望提升
。目前常用的生物制剂
DMARDs可以分为TNF-α抑制剂和白细胞介素6(IL-6)受体抑制剂,在临床使用的选择上并无优先顺序。虽然修美乐®在自身免疫性疾病的治疗效果上已得到广泛认可,但尚未进入医保目录,昂贵的治疗价格限制了其在中国市场的渗透率。2018 年,修美乐®在中国的中位中标价为 7586 元/支(40mg/0.8ml),每2周注射一支,全年费用在19.78万左右。因此,大部分患者选择使用益赛普®、安柏诺®、强克®等价格较低的国产依那西普生物类似药,尤其是益赛普已经纳入部分省份的医保,修美乐®是其价格的近4倍。根据PDB样本医院统计,2018年依那西普生物类似药销售额最高,其次为英夫利西单抗、托珠单抗、阿达木单抗和依那西普原研药。随着BAT1406等生物类似药的上市,阿达木单抗的价格降低有望提升市场渗透性。

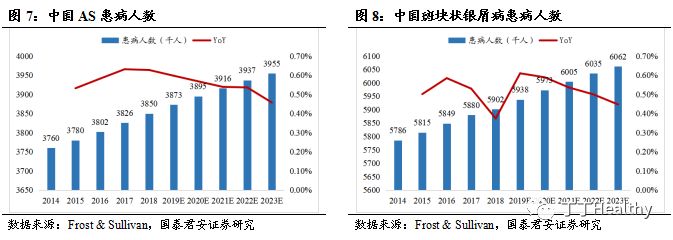
2023年中国的AS患者将达到 395.5万,TNF-α抑制剂为二线治疗方案。
AS是一种发生于患者脊柱位置的慢性炎症,病程长,病情恶化后患者会丧失大部分行动能力。根据Frost & Sullivan统计,2018年中国AS患者数量为385.0万,2014-2018年复合增长率为0.6%,预计2023年中国的AS患者人数将达到 395.5万,年复合增长率为0.5%。根据中国强直性脊柱炎诊断及治疗指南,对于诊断明确的AS患者,一线用药为非甾体类抗炎药,TNF-α抑制剂为二线治疗用药。
2023年斑块状银屑病患者人数将达到606.2万,修美乐®为中重度患者的一线用药。
斑块状银屑病是银屑病中最为常见的一种类型,银屑病是一种在多基因遗传背景下,由多种致病因子刺激机体免疫系统,而引起的以
T细胞介导为主的自身免疫性皮肤病,主要特征是皮损边界清晰,周围无炎症性红晕,也无明显的点状出血现象,皮损表面有较厚的鳞屑。根据Frost & Sullivan统计,2018年中国斑块状银屑病患者数量为590.2万,2023年中国的斑块状银屑病患者人数将达到606.2万,年复合增长率为0.5%。2018年,中国药监局批准修美乐®成为需要进行系统治疗的成年中重度慢性斑块状银屑病患者的一线治疗用药。
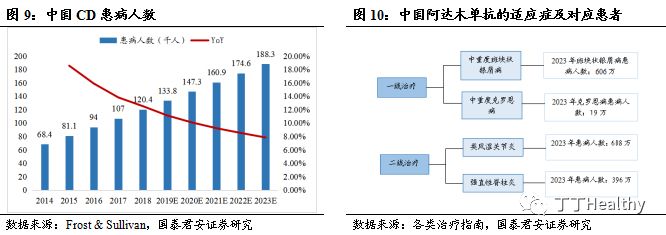
生物制剂可用于中重度
CD的一线用药。
克罗恩病(
CD)是一种原因不明的胃肠道慢性炎性肉芽肿性疾病,临床以腹痛、腹泻、体重下降、腹块、瘘管形成和肠梗阻为特点,慢性病程,反复发作。根据Frost & Sullivan统计,2018年中国CD患者数量为12.0万,2023年中国的CD患者人数将达到18.8万,以9.4%的年复合增长率增长。根据美国胃肠病学会推荐,生物制剂可
用于中重度CD的一线用药。
Ⅲ期临床试验证实了BAT1406与原研药修美乐®的等效性。
在中国,
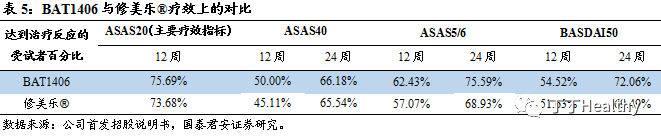
BAT1406已完成治疗强直性脊柱炎(AS)的Ⅲ期临床试验,此临床研究是一项多中心、随机、双盲、与原研药修美乐®平行对照试验,共纳入554例AS患者,受试者按照2:1比率随机分配到 BAT1406注射液组(隔周给药,一共给药 12 次)或修美乐®组(隔周给药,一共给药 12 次),经过为期 24周的治疗和随访。主要疗效指标为第12周达到 ASAS20治疗反应(Assessment in Ankylosing Spondylitis 20,躯体功能、脊柱疼痛程度、患者总体评估和炎症中至少有3项的病情改善率提高20%)的受试者百分比。根据临床数据显示,BAT1406和修美乐®的主要、次要疗效指标相似,即BAT1406在治疗AS的疗效上与修美乐®相似。
BAT1406有望将适应症外推至修美乐®在中国获批的所有适应症。
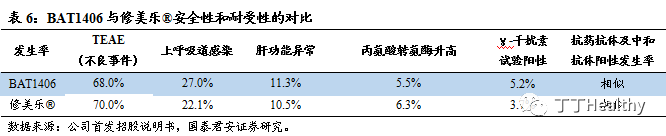
从
AS临床试验的数据得到,BAT1406与原研药的安全性和耐受性相似,即两者的等效性得到了证实。目前BAT1406作为中国首家申报上市的阿达木单抗生物类似药,已于2018 年8月17日正式获得CDE受理。根据 CDE于2019年3月1日发布的《阿达木单抗注射液生物类似药临床试验设计考虑要点》——“临床比对研究需选择国内已经获批适应症人群,与原研药进行1项“头对头”比较的临床等效性研究以支持其注册上市。按此临床研发思路完成单个适应症的临床比对研究可寻求外推其它相同作用机制适应症,同时应考虑其与原研药的整体相似性”,公司有希望将适应症进一步外推至修美乐®在中国获批的所有适应症。
BAT1406有望最早抢占中国阿达木单抗市场。
目前还没有已经上市的国产阿达木单抗生物类似药,但已有
15家药企进行阿达木单抗生物类似药的临床试验。百奥泰是中国首家申报上市的阿达木单抗生物类似药,已于2018 年8月17日正式获得CDE受理,并被纳入优先审评审批,预计2019年有望成为国内首款阿达木单抗生物类似药上市。海正药业、信达生物、复宏汉霖这3家药企也在百奥泰之后提交了上市申请,君实生物、通化东宝、神州细胞已进入三期临床试验。
2.1.2.
临床Ⅲ期产品-托珠单抗生物类似药BAT1806
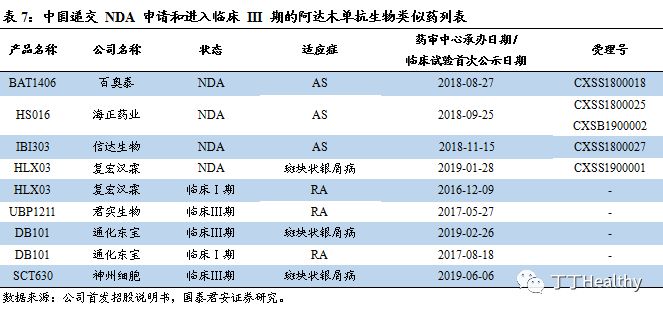
BAT1806与IL-6受体的作用机理。
BAT1806为免疫球蛋白IgG1亚型的重组人源化抗白介素6(IL-6)受体单克隆抗体注射液,是托珠单抗生物类似药,对应原研药为罗氏的雅美罗®。IL-6 是由T、B淋巴细胞和肝细胞等多种细胞分泌的一类具有广泛生物学活性的小分子蛋白,能够诱导肝细胞产生急性期蛋白,并激活补体、诱导促炎性细胞因子释放和刺激中性粒细胞趋化,加强炎性反应。BAT1806通过特异性结合可溶性及膜结合的IL-6受体(sIL-6R 和 mIL-6R),抑制sIL-6R 和mIL-6R介导的信号传导,可有效抑制炎症反应和骨关节损伤,还可以改善类风湿性关节炎伴随的贫血。
公司正在进行临床
Ⅲ期研究的患者招募, 预计2021年提交上市申请。
公司正在全球开展一项在对甲氨蝶呤
(MTX)反应不佳的RA患者中比较 BAT1806 与雅美罗®有效性和安全性的随机、双盲、平行、阳性对照临床Ⅲ期研究,计划入组 612 例受试者。本研究的主要目的是证实在对甲氨蝶呤反应不佳的类风湿性关节炎受试者中 BAT1806 和雅美罗®在第 24 周的疗效等效。主要终点为第 24 周达到美国风湿病学会20% (ACR20) 缓解的受试者比例。本研究的次要目的是评估BAT1806 与雅美罗®相比随时间变化的疗效特征、整个研究期间的安全性、耐受性及免疫原性。目前招募了31例患者,尚无可获得的临床数据。预计2021年,此产品将同步向中国 NMPA、欧盟 EMA、美国 FDA 等机构提交上市申请。
雅美罗
®在全球的销售额为22.1 亿美元,在中国获批RA和sJIA两种适应症。
原研药雅美罗
®在全球共获批5个适应症,包括RA、全身型幼年特发性关节炎(sJIA)、巨细胞动脉炎(GCA)、多关节型幼年特发性关节炎(pJIA) 和细胞因子释放综合症(CRS)。在中国获批RA和sJIA两种适应症。2018年,雅美罗®在全球和中国的销售额分别为22.1 亿美元和约0.39亿人民币。雅美罗®抗体序列专利 2012年、2019年在欧洲和美国期限届满失效。雅美罗®在中国未申请抗体序列专利。
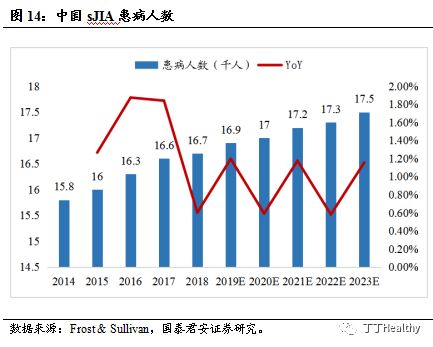
预计
2023年中国的sJIA患者将达到1.75万。
BAT1806的靶点可用于独家适应症sJIA,sJIA发病率约为3-8/百万人口,是幼年特发性关节炎(JIA)的一种特殊类型,国内报道占JIA比率约为41%,临床以发热、淋巴结肿大、关节炎、皮疹和浆膜炎为主要特征,是最急性和最严重的一种类型,病死率高。根据Frost & Sullivan统计,2018年中国sJIA患者数量为1.67万,2023年中国的sJIA患者人数将达到1.75万,年复合增长率为0.6%。
托珠单抗成为治疗
sJIA的首选药物。
根据美国风湿病学会推荐指南,非甾体类抗炎药作为第一线药的地位不确定,对全身症状无效,而对发热和医生总体评分
≥7 的sJIA 患儿首选糖皮质激素治疗,但不良反应多。近年来主要的治疗进展是生物制剂,包括IL-1受体抑制剂(阿那白滞素、卡那单抗、利那西普)和IL-6受体抑制剂(托珠单抗)。儿童关节炎和风湿病研究联盟(CARRA)将单用阿那白滞素和托珠单抗或联合激素作为治疗sJIA的首选药物,目前国内尚无IL-1受体抑制剂上市,托珠单抗成为治疗sJIA的首选药物。
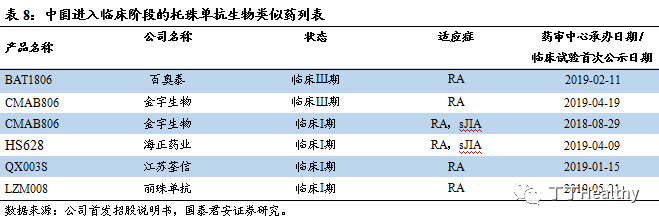
百奥泰和金宇生物进展最快
。雅美罗
®每支售价从1925元调整为830元(80mg/4ml),年使用费用降到5.98万元,与益赛普和英夫利西单抗接近。BAT1806等生物类似药的上市有望进一步降低托珠单抗价格,目前中国有 5 家公司的托珠单抗生物类似药开展临床试验,其中百奥泰的 BAT1806 和金宇生物的 CMAB806 临床进展最快,都处于临床Ш期研究。相比于阿达木单抗市场,托珠单抗市场竞争较少,百奥泰产品如能领先上市则有望率先抢占市场。
2.1.3.
临床
І期产品-戈利木单抗生物类似药BAT2506
戈利木单抗可为阿达木失效患者提供新选择。
BAT2506是公司根据杨森制药的戈利木单抗(欣普尼®)研发的生物类似药,是靶向TNF-α的抗体,能够以高亲和力特异性地结合可溶性及跨膜的人TNF-α,阻断TNF-α与其受体结合,从而抑制TNF-α的活性。阿达木单抗可能引起患者自身产生抗药抗体而失效,戈利木单抗可为医生、患者提供新的选择。
欣普尼
®2009年在美国获批上市,2018年在中国获批上市,用于治疗强直性脊柱炎成年患者;也可联合甲氨蝶呤(MTX)治疗对包括MTX在内的改善病情抗风湿药物疗效不佳的中到重度活动性类风湿性关节炎成年患者。
BAT2506
目前计划临床
I 期在中国健康男性受试者中单次皮下注射 BAT2506和欣普尼®,比较两者的药代动力学相似性、安全性及免疫原性,计划入组182例健康男性受试者,按照1:1的比例随机分配到BAT2506注射液组或欣普尼®组,预计 2019 年7月正式启动临床Ⅰ期研究。
2.2. 肿瘤
2.2.1.
临床
Ⅲ期产品-贝伐珠单抗生物类似药BAT1706
BAT1706与VEGFR的作用机理。
BAT1706是公司根据美国基因泰克公司(罗氏全资子公司)的安维汀®研发的贝伐珠单抗生物类似药,是一种重组人源化 IgG1 单克隆抗体。血管内皮生长因子(VEGF) 能特异性地作用于血管内皮细胞,通过胞内信号转导促进血管内皮细胞增殖、迁移、增加血管通透性并诱导血管生成,是目前公认的抗肿瘤血管新生重要靶标之一。贝伐珠单抗可以特异性地与VEGF结合并阻断其受体(VEGFR)相结合,减少了肿瘤的血管形成,从而抑制了肿瘤的生长。

原研药安维汀
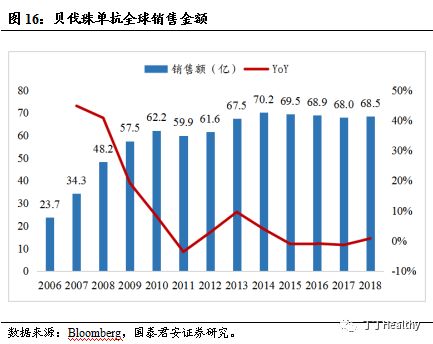
®连续三年成为全球销售额前十的药物。
原研药安维汀
®2004年在美国上市,在美国和欧洲各获批转移性结直肠癌、晚期非鳞状非小细胞肺癌等六项适应症。2016-2018年连续三年成为全球销售额前十的药物。安维汀®于 2010 年在中国获批两个适应症,包括晚期非鳞状非小细胞肺癌和转移性结直肠癌。2018年全球和中国的销售金额分别为68.5亿美元和超过20亿人民币。原研药抗体序列专利分别于 2019 年、2018 年和 2018 年在美国、欧洲和中国到期。
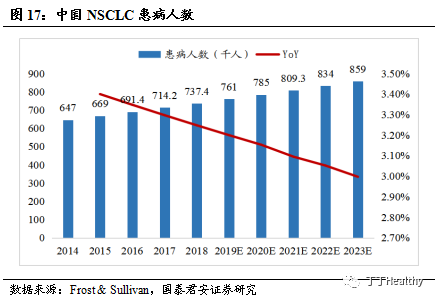
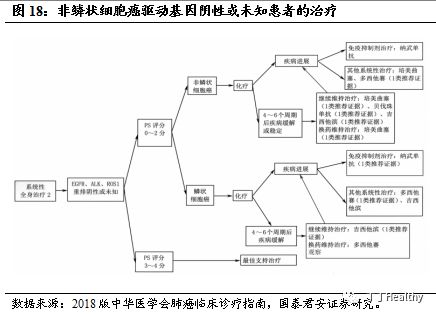
2023年中国晚期NSCLC患者将达到约60.1万,贝伐珠单抗联合标准化疗方案为一线治疗。
根据非小细胞肺癌诊断治疗指南统计,肺癌的发病率和死亡率均居我国恶性肿瘤第
1位,其中80%-85%的患者为非小细胞肺癌(NSCLC)。NSCLC患者的5年生存率约为15%,约70%的NSCLC患者确诊时即为晚期。根据Frost & Sullivan统计,2018年中国NSCLC患者数量为73.7万,2023年中国NSCLC患者人数将达到85.9万,年复合增长率为3.1%,晚期NSCLC患者将达到约60.1万。根据2018版中华医学会肺癌临床诊疗指南推荐,对于Ⅰ
-Ⅲ
期
NSCLC可用手术及同步放化疗治疗,在Ⅳ期(晚期)NSCLC的一线治疗中,对于非鳞状细胞癌驱动基因阴性或未知患者的一线治疗中,功能状态评分0-1分且没有明显咯血和肿瘤侵犯大血管的情况下,推荐在一线化疗(卡铂/紫杉醇或顺铂/吉西他滨)基础上联合贝伐珠单抗,此方案已经被ECOG 4599研究、AVAiL研究等大型临床试验验证。
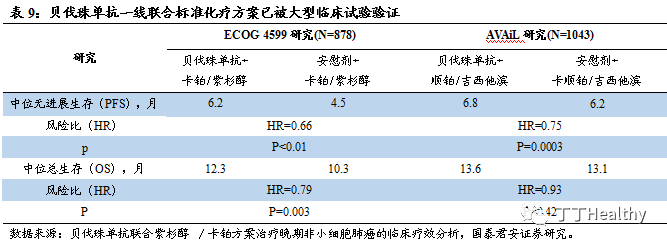
2023年中国转移性结直肠癌患者人数将达到16.1万,贝伐珠单抗联合FOLFOX或FOLFIRI方案作为一线及二线治疗方法。
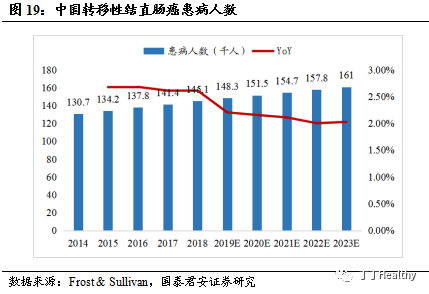
根据国家癌症中心发布的数据显示,结直肠癌是中国发病率第
3 位的恶性肿瘤,仅次于肺癌和胃癌。据Frost & Sullivan统计,2018年中国新发转移性结直肠癌患者数量为14.5万,2023年中国转移性结直肠癌患者人数将达到16.1万,年复合增长率为2.1%。在2018版CSCO结直肠癌诊疗指南中,贝伐珠单抗联合FOLFOX(奥沙利铂+亚叶酸钙+氟尿嘧啶)或FOLFIRI(伊立替康+氟尿嘧啶+亚叶酸钙)方案作为一线及二线治疗转移性结直肠癌的方法。
BAT1706III期临床试验已完成受试者入组。
公司在全球多个国家、
106 个临床试验中心开展了“一项在晚期非鳞状非小细胞肺癌患者中比较 BAT1706 与 EU-安维汀®(用于欧盟销售的安维汀®)+化疗的多中心、随机化、双盲、Ⅲ期临床研究”,以评估比较 BAT1706 与 EU-安维汀®+化疗作为一线治疗的疗效,使用总缓解率(ORR)的比值或差值证明临床等效性。该研究计划招募 632例患者按 1:1 比率随机分配到 2 个治疗组,目前已完成受试者入组,尚无可获得的临床数据。
已完成的中国和新西兰的
Ⅰ期临床试验证明BAT1706和原研药的安全性和耐受性均良好。
公司已经在中国开展了
“一项随机、双盲、单次给药、平行两组 BAT1706 注射液与 EU-安维汀®在健康受试者的药代动力学和安全性比对研究”,以评估 BAT1706的安全性和药代动力学,共计入组 82 例受试者。该试验的 PK 结果与在新西兰进行的Ⅰ期研究结果一致。本研究比较了 BAT1706 与原研药的药代动力学,BAT1706 注射组与原研药之间的浓度-时间曲线变化趋势相似。主要及关键次要 PK 终点指标(AUC0-∞、AUC0-t和 Cmax)的 GMR 和 90%CI 在可接受的等效范围(0.8-1.25)内。研究结果表明,两种药物的安全性和耐受性均良好。整个研究期间未报告死亡或与药物相关的 SAE。
贝伐珠单抗与
PD-1/L1的联合疗法有望进一步提高贝伐珠单抗的渗透率。
贝伐珠单抗已于
2017年进入国家医保目录乙类范围。在进入医保前,该药品中位中标价为5253元(100mg/瓶),经过此轮医保谈判后价格降至1998元(100mg/瓶),2018 年又进一步降至1934 元(100mg/瓶),且报销比例高达70%~90%,降低了患者压力。据Frost & Sullivan统计,预计2023年中国贝伐珠单抗生物类似药市场规模达64亿人民币,并于2030年达到99亿人民币规模。此外,目前罗氏正在进行的IMpower150研究的结果显示,在NSCLC领域,贝伐珠单抗与化疗+PD-1/L1联用可能成为一线治疗方案,此外贝伐珠单抗与PD-1/L1的联合疗法也在肾细胞癌、卵巢癌等疾病中进行临床研究。受益于PD-1/L1在国内的快速推广,贝伐珠单抗的销售量有望进一步提升。
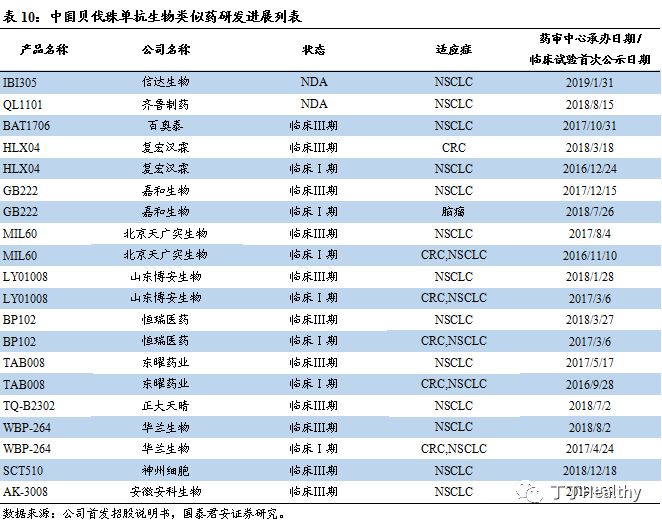
贝伐珠单抗生物类似药研发格局竞争激烈。
目前,信达生物和齐鲁制药的贝伐珠单抗生物类似药已经提交上市申请,百奥泰处于临床
Ⅲ期,另外进入临床Ⅲ期的公司很多,贝伐珠单抗生物类似药研发格局竞争激烈。
2.2.2.
临床Ⅲ期产品-曲妥珠单抗偶联药物BAT8001
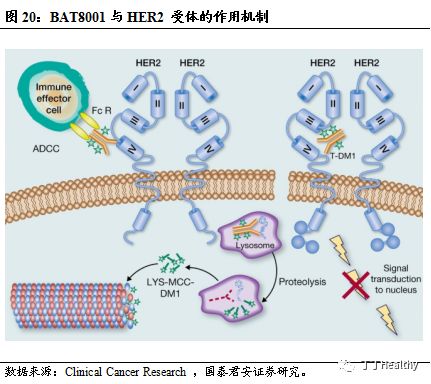
BAT8001与HER2 受体的作用机制
。
BAT8001是百奥泰自主开发的首个靶向HER2(原癌基因ErbB2)的曲妥珠单抗偶联药物,属于抗体药物偶联物(ADC)。HER2的基因拷贝数目和表达水平在许多上皮肿瘤,特别是乳腺癌、胃癌、卵巢癌、前列腺癌、非小细胞肺癌和鼻咽癌等中过度升高。HER2的细胞表面定位、由其介导的癌形成和在肿瘤组织中的高表达,使其成为理想的抗肿瘤治疗靶点。BAT8001结合到 HER2 受体的第Ⅳ小区后,开始以受体介导进行细胞内化,之后的溶酶体降解过程导致在细胞内释放含有半胱氨酸-Batansine(Cys-Batansine,Batansine为一种美登素衍生物)的细胞毒性代谢物。Cys-Batansine 结合到微管蛋白的过程会破坏细胞内的微管网络,引起细胞周期阻滞与细胞凋亡。BAT8001采用的连接子(6-马来酰亚胺基己酸)-毒素复合物与抗体偶联为公司自主研发的技术。BAT8001不仅对 HER2 高表达的肿瘤增殖具有显著的抑制作用,其体内主要的代谢产物 Cys-Batansine 在血浆中浓度低、可以被迅速代谢、毒性低,从而保证药物的安全性。
ADC药物成为全球肿瘤靶向治疗研究的热门方向,靶向HER2的乳腺癌药物Kadcyla®销量最高。
抗体药物偶联物(
ADC)是一种新型的靶向抗肿瘤药物,它利用单克隆抗体将连接的细胞毒药物靶向输送至肿瘤细胞部位,以增强抗体治疗活性、增加细胞毒药物杀伤肿瘤细胞的靶向性,并降低其对正常组织的毒副作用。虽然结构比较复杂,但具有特异性高、选择性强和细胞毒性弱等优势。目前FDA已批准5款ADC药物上市,后续还有数十种ADC药物进入了临床研究阶段,成为全球肿瘤靶向治疗的热门方向。其中罗氏研发的靶向HER2 的乳腺癌药物Kadcyla®成绩最好,2018 年该药品全球销售额达到约10.01 亿美元。
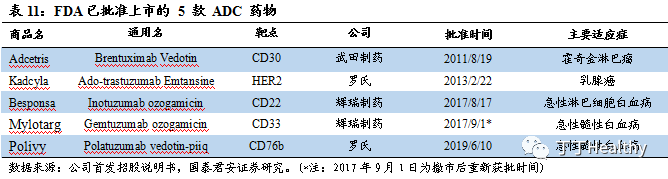
2023年中国晚期 HER2 阳性乳腺癌患者人数将达到1.82万,二线治疗方案推荐曲妥珠单抗-DM1偶联物。
HER2阳性乳腺癌约占全部乳腺癌的 20%~25%,具有浸润性强、进展快速、复发风险高、预后差等临床特点。据Frost & Sullivan统计,2018年中国晚期 HER2 阳性乳腺癌患者数量为1.69万,2023年中国晚期 HER2 阳性乳腺癌患者人数将达到1.82万,年复合增长率为1.0%。根据美国临床肿瘤学会的建议,HER2 阳性晚期乳腺癌的一线治疗推荐化疗联合曲妥珠单抗和帕妥珠单抗,二线治疗方案推荐曲妥珠单抗-DM1偶联物(Kadcyla®,其中DM1是一种美登素衍生物,Maytansinoid)。另外,在Kadcyla®的Ш期临床试验中,HER2阳性早期乳腺癌新辅助治疗完成后有残存病灶的患者,辅助治疗使用Kadcyla®相比曲妥珠单抗(赫赛汀®),可使乳腺癌复发风险降低50%。
中国进入临床
Ⅱ期以上的ADC药物较少,未来BAT8001主要与Kadcyla®进行竞争。
目前中国常用
HER2 阳性晚期乳腺癌治疗药物为罗氏研发的曲妥珠单抗——赫赛汀®,2018年价格约为5513元,已经纳入国家医保。罗氏研发的HER2抑制剂——帕妥珠单抗已于2018年12月17日批准上市,可与赫赛汀®和多西他赛联合用于HER2 阳性晚期乳腺癌的一线治疗。在中国治疗乳腺癌的ADC药物中,虽然进入临床Ⅱ期以上的ADC药物较少,但罗氏的Kadcyla®在中国的上市申请已于2019年3月37日获得CDE承办。预计未来BAT8001主要与Kadcyla®在药品疗效、价格、销售模式方面进行竞争。
BAT8001临床Ⅲ期研究正在进行患者招募。
公司正在中国进行一项多中心、随机、开放、阳性对照的临床
Ⅲ期研究,以拉帕替尼片联合卡培他滨片为阳性对照药,评估 BAT8001 治疗 HER2 阳性晚期乳腺癌患者的有效性、安全性和免疫原性。该研究计划将 410 例患者按照 1:1 比例随机分配到试验组或对照组,以无进展生存期为主要疗效指标。目前已经完成275 例患者的招募,尚无可获得的临床数据。
已完成的
I期临床试验中,BAT8001常见的不良反应与 Kadcyla®一致。
在中国,
BAT8001已经完成了一项开放、剂量递增的Ⅰ期临床试验,以评估 HER2阳性实体瘤患者使用BAT8001的安全性、耐受性以及药代动力学特征,共计入组 29 例受试者。递增剂量设计包括五个剂量水平,在进入下一个剂量之前,将评估来自先前同期群的所有受试者在给药后 21 天的耐受性和安全性数据。在该项临床研究中,接受 BAT8001 治疗后,最常见的不良反应为血小板降低、谷草转氨酶升高以及谷丙转氨酶升高,这与 Kadcyla®一致。
公司将借助
Cipla广泛的市场与销售体系,将 BAT1706 销往多个新兴国家市场。
公司已将部分新兴国家市场商业化权益授权给
Cipla Gulf FZ LLC(以下简称“Cipla”)。Cipla 将凭借其广泛的市场与销售体系,将 BAT1706 销往多个新兴国家市场,发行人将从 Cipla 获得开发里程碑和商业化里程碑付款以及销售收入。

2.2.3. 临床Ⅱ期产品-BAT1306
BAT1306是公司研发的针对免疫抑制检查点PD-1的单克隆抗体。PD-1/PD-L1免疫疗法利用人体自身的免疫系统抵御癌症,通过阻断 PD-1/PD-L1信号通路对 T 细胞的免疫抑制功能,激活T细胞对癌细胞的杀伤能力,具有治疗多种类型肿瘤的潜力。是目前最热门的新一类肿瘤免疫疗法。BAT1306正在进行联合XELOX化疗方案治疗EBV相关性胃癌(EBVaGC)患者的临床Ⅱ期,目前正在患者招募阶段,预计2021 年完成本临床试验。
2.2.4. 临床Ⅰ期产品-BAT8003
BAT8003是公司自主开发的一种靶向肿瘤相关钙信号传感器2(Trop2)的ADC 创新药物,由糖基化修饰的重组人源化抗Trop2单克隆抗体通过定点偶联技术与 Batansine进行共价连接而成。BAT8003的临床适应症是Trop2阳性晚期上皮癌。BAT8003的优势在于,采用新一代定点偶联技术改善ADC 产物的均一性;此外,BAT8003 采用的是不可剪切式连接子,保证ADC 在体内循环的安全性;BAT8003的裸抗由敲除岩藻糖的宿主细胞表达生产,从而增强了药物的ADCC 效应(抗体依赖细胞介导的细胞毒性作用),进而增强了BAT8003的体内抗肿瘤效果。体外药效学显示,BAT8003对Trop2高表达的乳腺癌和胃癌细胞生长均表现出较强的抑制作用。
目前
BAT8003 已于2019年3月份开展临床Ⅰ期试验。在临床前的评估中,BAT8003对 Trop2 阳性乳腺癌和胃癌均有较好的治疗效果。BAT8003 已向中国、美国和 WIPO(世界知识产权组织)等提交多项专利申请,发行人开发的 Batansine 获得多项美国、中国和其他国家专利授权。
2.2.5. 临床Ⅰ期产品-BAT4306F
BAT4306F 是公司研发的新一代糖链修饰的ADCC增强型抗CD20单克隆抗体,其首先开发的临床适应症为复发/难治CD20阳性B细胞非霍奇金淋巴瘤。非霍奇金淋巴瘤(NHL)是一类异质性明显的恶性血液病,按照组织病理类型分为B 细胞NHL和T/NK 细胞NHL。临床上NHL 大部分为B细胞型,占总数的比例约为70%至85%。CD20分子是清除体内B细胞的理想靶标。BAT4306F 能特异性与B细胞及前体细胞表面的 CD20 分子结合,诱发ADCC等生物学效应从而发挥清除B细胞作用以治疗恶性增殖的B细胞淋巴细胞瘤。BAT4306F与目前已上市的抗CD20 抗体利妥昔单抗的作用表位不同,能直接诱导B细胞凋亡,通过对抗体的糖基化进行改造,进一步增强了BAT4306F的ADCC效应。BAT4306F 目前正处于Ⅰ期临床试验阶段。临床前研究将 BAT4306F与已上市的同
类抗
CD20抗体奥滨尤托珠单抗及利妥昔单抗作比较,BAT4306F显示了优秀的ADCC效应、诱导细胞凋亡能力以及体内外清除B细胞能力。

2.3. 心血管疾病
2.3.1.
临床
Ⅲ期产品-巴替非班BAT2094
BAT2094是公司开发的拥有自主知识产权的血小板糖蛋白Ⅱb/Ⅲa(即“GPⅡb/Ⅲa”)受体拮抗剂,为国家1.1类新药。它能特异性地与血小板糖蛋白受体Ⅱb/Ⅲa结合,阻抑该受体与纤维蛋白原的结合,来抑制血小板聚集,可用于经皮冠状动脉介入治疗(PCI)手术围术期抗血栓。预计在2019年底前递交上市申请。
冠心病,又称
“冠状动脉粥样硬化性心脏病”,是指因冠状动脉不同程度的受阻而引起的供血不足和心肌缺氧性心脏病。抗血小板聚集可显著降低冠心病患者的血栓事件风险,国内外指南均将抗血小板凝集药物作为冠心病治疗的Ⅰ类推荐。抗血小板凝集类药物种类众多,其中Ⅱb/Ⅲa 受体拮抗剂具有药效强、效果稳定等特点,在静脉和冠状动脉抗凝中广为应用。
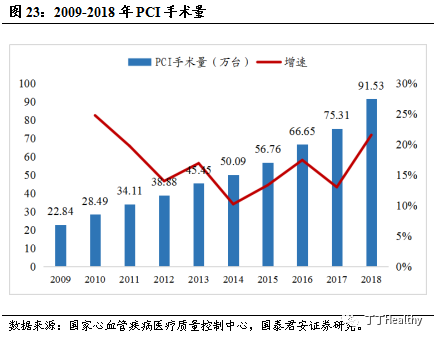
根据
Frost & Sullivan统计,2018年中国PCI手术91.53万台,增长率达到21.54%。国内主要已上市的
Ⅱb/Ⅲa
受体拮抗剂为替罗非班,
2018 年替罗非班的市场规模约为2亿元。
2.3.2.
临床
І期产品-BAT5906
BAT5906 是用于眼底病变治疗的单克隆抗体,其临床适应症为湿性年龄相关性黄斑变性(wAMD)。BAT5906 可通过阻断VEGF与其受体 VEGFR的结合,抑制血管新生。BAT5906 项目正处于Ⅰ期临床试验阶段。临床前研究显示BAT5906具有高亲和力,体内药效学试验结果表明 BAT5906 比上市药物雷珠单抗更能抑制猴眼部血管新生。
2.3. 研发情况
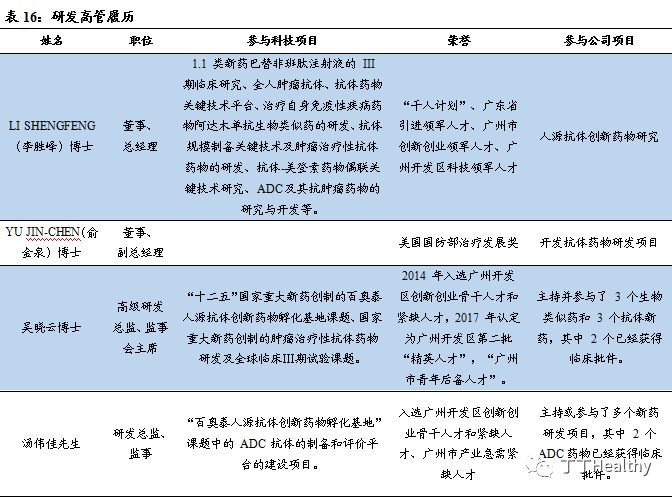
2.4.1. 研发团队
生物制药领域技术壁垒相对较高,需要高水平专业团队。截至
2019年3月末,公司共有核心技术人员5人,共有研发人员226人,分别占员工总数的比例为1.19%和53.81%。公司总经理LI SHENGFENG(李胜峰)博士、副总经理YU JIN-CHEN(俞金泉)博士、高级研发总监吴晓云博士、研发总监汤伟佳先生、生产运营高级总监包财先生等拥有丰富的新药项目开发经验。