
2016年,FDA只批了22个新药,而随着2017年6月的结束,这一数字仅用了半年就被超越了,今年新药获批数量也强势反弹。那么,6月份,哪些新药又获得了获批呢?文|行肖
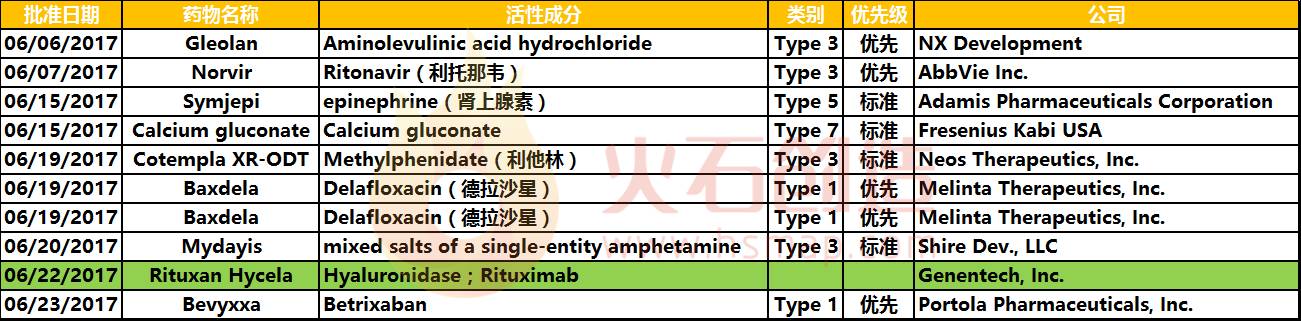
Type 1 - 新分子实体;Type 3 - 新剂型;Type 5 - 新制剂或新制造商;Type 7 - 未获批过NDA的已上市药物;绿色为生物药
新型抗生素Baxdela获批
6月19日,FDA批准了Melinta公司研发的新药Baxdela (delafloxacin),这是一种用于治疗由易感细菌引起的急性细菌性皮肤和皮肤结构感染(ABSSSI)的喹诺酮类抗生素。
该药物共获批了静注和口服两种剂型,用于对抗耐甲氧西林金黄色葡萄球菌等病原体。与市面上的其他两性离子喹诺酮类不同的是,delafloxacin具有阴离子特性,更容易在酸性环境下的病原体和细胞中集聚,并消灭金葡菌。
据了解,在经历了长达17年的研发与等待之后,Melinta公司终于如愿以偿地等到了Baxdela成功获批的这一天。
抗凝新药Bevyxxa获批
6月23日,FDA批准了由Portola Pharmaceuticals研发的新药Bevyxxa(betrixaban),这是一种用于住院以及后续阶段静脉血栓栓塞长效预防的抗凝剂,也是目前唯一一款用于这类住院成人患者的抗凝剂。
Bevyxxa属于口服剂型的因子Xa抑制剂,之前就曾获得FDA授予的快速通道资格和优先审评资格。事实上,在临床试验中该药物并未在目标人群中达到主要临床终点,然而FDA还是因为“该药物在其他人群中的出色数据应该能支持其降低静脉血栓栓塞发病率”而批准了Bevyxxa的上市。
CD20靶向抗体新药Rituxan Hycela获批
6月22日,FDA批准了基因泰克公司的Rituxan Hycela皮下注射剂,这是一种用于治疗滤泡性淋巴瘤、弥漫性大B细胞淋巴瘤和慢性淋巴细胞性白血病的CD20靶向抗体药,也是本月获批的唯一一种生物药。
该药通过将利妥昔单抗这种CD20靶向的溶细胞抗体与人透明质酸酶结合,大大提高了利妥昔单抗在皮下组织中的吸收率。
1、RNAi疗法Givosiran
Albylam Pharmaceuticals公司的在研新药Givosiran是一种用于预防急性肝卟啉症(AHP)的RNAi疗法,其靶点为氨基乙酰丙酸合酶1(ALAS1)。该疗法曾获得过EMA的PRIME认定,也获得过欧盟以及美国的孤儿药资格,如果获批将可能成为首个预防AHP发病的疗法。
2、双特异性抗体Burtomab
由纪念斯隆-凯特琳癌症中心发现并授权给YmAbs Terapeutics公司研发的Burtomab是一种用于治疗患有中枢神经系统或脑脊液转移的复发性或难治性神经母细胞瘤患儿的双特异性抗体,目前市场上还没有用于治疗这种晚期神经母细胞瘤的获批药物。
3、IgA肾病新药OMS721
Omeros公司的主打在研药物OMS721是一种用于治疗免疫球蛋白A肾病(IgA)的完全人源化单抗药物,其靶点是甘露聚糖结合凝集素相关丝氨酸蛋白酶-2(MASP-2)。OMS721在治疗IgA肾病的临床2期试验中大幅度降低了患者的尿白蛋白/肌酐比值,疗效是其他疗法中未曾有过的,这也让它获得了FDA的突破性疗法资格认定。
4、肾病相关适应症疗法IV-CR845
Cara Terapeutics公司的在研新药IV-CR845是一种静脉注射剂,用于治疗接受血透的慢性肾病患者所患有的中重度尿毒症瘙痒。该药是一种选择性靶向外周k阿片受体,目前市场上的抗瘙痒治疗方案尚无法满足充分缓解症状的需求,而该药在临床试验中的出色数据也让其获得了FDA的突破性疗法资格认定。
点击阅读原文,查看更多精彩资讯与行业报告













