宝子们好呀!这里依旧是你们的馆长~不知道大家都发现了吗?最近随便点开哪个软件都是关于双十一购物的推送,各种攻略,各种机制,看得人那叫一个懵圈呀。恍惚之中才意识到一年一度的双十一居然这么快就要来了,这不就意味着本年度马上进入倒计时了嘛~咱们的科研目标都达成了吗?年度总结能拿的出手吗?知道宝子们很急,但先别急,馆长这不就带着好文章来助攻了嘛,一起看看吧!
1、
这项研究旨在探究葡萄糖苷酶I(GCS1)在调节CRC(结直肠癌)中ER(内质网)应激中的功能和分子机制
。
主要通过
细胞增殖、迁移、侵袭和凋亡
检测揭示GCS1的生物学作用;通过
免疫沉淀-质谱联用分析
和免疫荧光共定位分析
揭示GCS1与GRP78之间的相互作用;通过
免疫组织化学和免疫荧光
检测GCS1和GRP78表达之间的联系以及这些蛋白质的细胞内定位;
2、
这项研究的创新之处在于:①确定了CRC的可能治疗靶点;②表明了GCS1可以在体内和体外增强CRC细胞的增殖和转移,同时抑制CRC细胞的凋亡。从
机制
上讲,GCS1与GRP78结合,募集USP10以使GRP78
去泛素化以促进其降解
,并
减少ER应激介
导的
细胞凋亡
,增加CRC细胞增殖和转移。
(
ps:
宝子们,时间过得真是快呀~虽然有的朋友们句句不提焦虑,可字字都充满着心急呀,别怕!你们的定海神针、你们的馆长就一直在这儿!想要进行相关热点方向的课题设计评估和生信分析的快来扫码联系馆长吧!咱们稳扎稳打,一步一个脚印,行动起来就不怕晚!)
定制生信分析
云服务器租赁
加好友
备注“99”
领取试用

题目:GCS1募集USP10以去泛素化GRP78通过减轻内质网应激促进结直肠癌的进展
杂志:
Journal of Experimental & Clinical Cancer Research
影响因子:IF=
11.4
发表时间:202
4
年
9
月
公众号
回复“123”领取
原文PDF,文献编号:241015
研究背景
错误折叠蛋白的长期积累导致结直肠癌(CRC)中的内质网(ER)应激。然而,控制CRC中存活和细胞凋亡之间决定的确切途径尚不清楚。因此,在本研究中,
主要
研究了葡萄糖苷酶I(GCS1) 在调节CRC中ER应激中的功能和分子机制。
研究思路

研究
结果
1.
GCS1在CRC中表达升高
首先,使用肿瘤免疫估计资源(计时器)数据库发现,大多数肿瘤组织的GCS1表达水平高于对应的正常组织,特别是对于结肠癌和直肠癌的病例。通过对癌症基因组图谱(TCGA)中CRC患者的临床资料的检测,研究者们发现GCS1在CRC组织中的表达水平高于正常肠上皮组织,在UALCAN数据库中也发现了相同的模式。随后的研究显示,GCS1在有远处或淋巴转移的患者中,以及在处于高病理阶段的患者中均表达上调。接下来进一步探讨了GCS1与预后的关系。如预测的那样,
GCS1高表达组的总生存期(OS)时间明显短于GCS1低表达的组
。接下来,通过40对CRC组织样本证实了GCS1的RNA表达升高。然后,在8对CRC组织样本中检测到GCS1的高蛋白表达。进一步使用TMA进行验证,代表性图像显示肿瘤组织中GCS1的表达量大于正常肠上皮组织。这些初步结果表明,
GCS1组织在结直肠癌中大量表达,并与结直肠癌患者的预后和病理分期密切相关
。
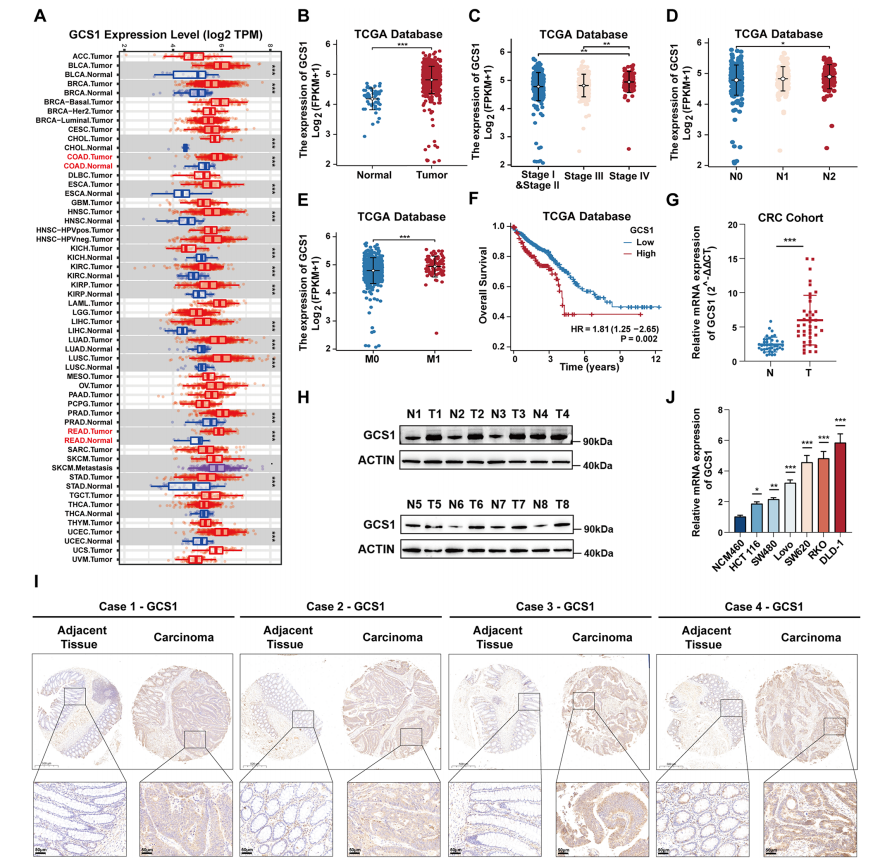
图1
GCS1在CRC中高度上调,表明预后不良
2.
GCS1对CRC的体外恶性发展至关重要
为了深入理解GCS1在CRC中的生物学角色,研究者们分析了正常肠上皮细胞系NCM460及多种CRC肿瘤细胞系中GCS1的RNA和蛋白质表达水平。基于这些初步数据,最后选取了DLD-1、RKO和HCT 116细胞作为后续细胞功能研究的对象。具体而言,在DLD-1和RKO细胞中引入了GCS1短发夹RNA(shRNA)以实现基因敲低,而在HCT 116细胞中则转染了GCS1过表达质粒。通过RNA和蛋白质表达的定量分析,确认了GCS1表达水平的显著变化。细胞增殖实验结果表明,GCS1的缺失显著抑制了DLD-1和RKO细胞的增殖能力,
而GCS1的过表达则显著促进了HCT 116细胞的增殖
。此外,EdU标记实验也显示,GCS1敲除的DLD-1和RKO细胞中EdU阳性细胞比例降低,而GCS1过表达的HCT 116细胞中EdU阳性细胞比例则显著升高。为了进一步研究GCS1在细胞侵袭和迁移中的作用,进行了Transwell和伤口愈合试验。实验结果显示,GCS1过表达组的细胞迁移和侵袭能力显著增强,而GCS1敲除组则表现出较弱的迁移和侵袭能力。综上所述,这些实验结果共同表明,
GCS1在体外条件下能够加速CRC细胞的增殖和转移过程
。
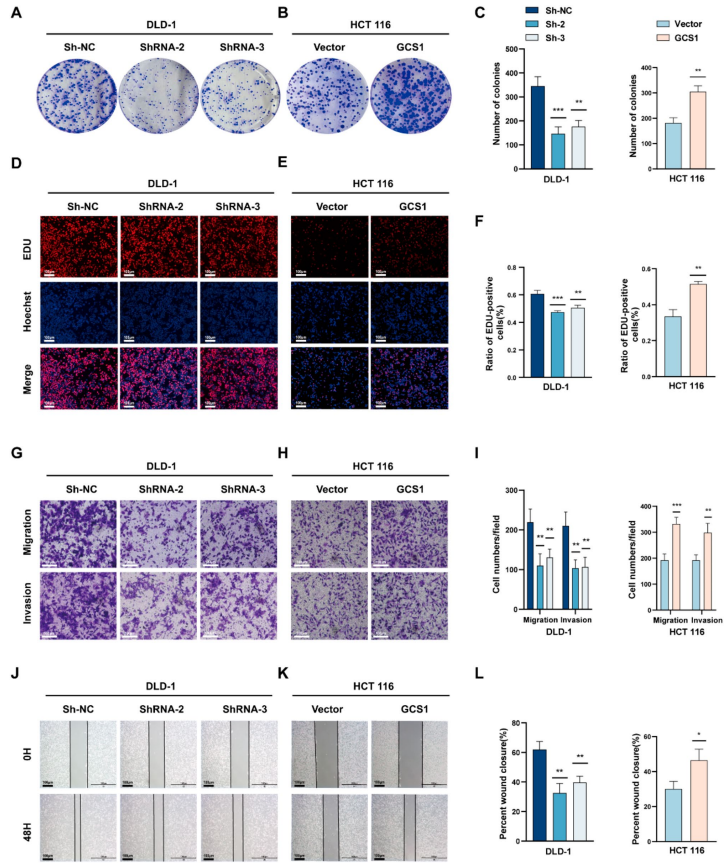
图
2 GCS1加速体外CRC癌的恶性进展
3.
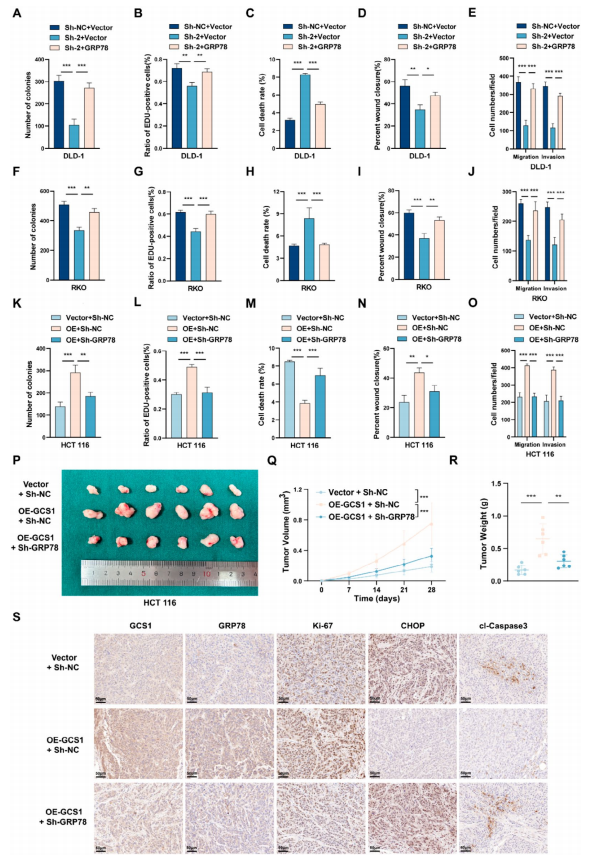
GCS1减轻ER应激并促进体内恶性进展
随后,KEGG富集分析显示,GCS1主要参与ER中的蛋白质加工、泛素介导的蛋白水解和凋亡途径。此外,使用流式细胞术(FCM)证实,与相应的对照细胞相比,过表达GCS1的HCT 116细胞的凋亡率显著降低,而GCS1敲除的DLD-1和RKO细胞的凋亡速率增加。WB分析显示,在GCS1敲除后,ER应激期间产生的促凋亡蛋白CHOP和切割的Caspase 3(cl-Capase 3)的蛋白水平升高。然而,在GCS1过表达组中,CHOP和cl-Capase 3的水平都大大降低了。接下来的实验表明,GCS1缺失显著抑制了异种移植物肿瘤的生长,但GCS1过表达则促进了其生长。总的来说,这些结果表明了
GCS1在体内的促肿瘤作用
。随后从每组随机选择的三只皮下荷瘤裸鼠中提取总蛋白进行WB分析。结果与体外观察结果一致。IHC染色显示,GCS1敲低降低了异种移植物肿瘤中Ki-67的水平,但增加了CHOP和cl-Capase 3的水平,而GCS1过表达增加了Ki-67水平,但降低了CHOP及cl-Capaase 3的水平。综上所述,这些发现表明,
GCS1过表达通过减少ER应激诱导的凋亡来促进CRC的发展,并在体内促进CRC的进展
。
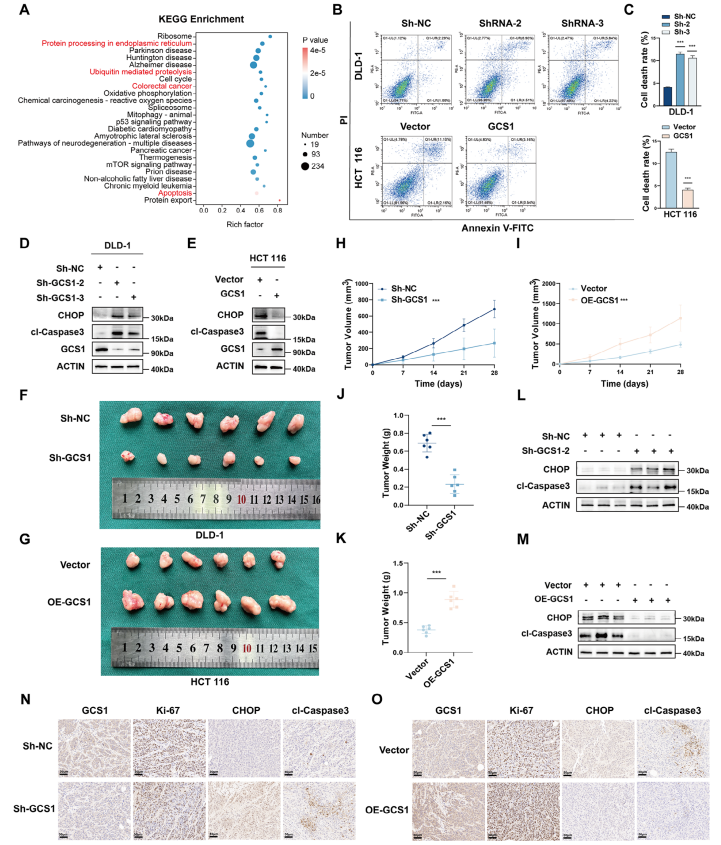
图
3 GCS1减轻内质网应激介导的细胞凋亡,促进结直肠癌的恶性进展
4.
GRP78是GCS1的主要靶点
考虑到GCS1可以减少内质网应激,研究者们确定了IP-MS鉴定的蛋白与GeneCards数据库中鉴定的与内质网应激相关的蛋白之间的重叠。令人惊讶的是,GRP78,也被称为HSPA5或Bip,是内质网应激过程中调节展开蛋白翻译的关键蛋白,在候选蛋白列表中排名最高。因此,研究者们选择GRP78作为GCS1的下游蛋白进行进一步研究。接下来进一步验证了GCS1与GRP78之间的关系。免疫荧光(IF)染色进一步证实GCS1和GRP78主要共定位于CRC细胞的细胞质中。通过共免疫共沉淀(Co-IP)证实了
HEK293T细胞中GRP78与GCS1的外源性结合
。此外DLD-1和RKO细胞进一步验证了GCS1与GRP78的内源性结合。随后,使用蛋白-蛋白对接方法预测GCS1和GRP78之间的结合域,以更深入地了解它们之间的相互作用。最后构建了GCS1截断质粒,将包含氨基酸(aa)1-351和352-837的序列进行截断,得到的蛋白分别命名为Flag-GCS1-N和Flag-GCS1-C。将Flag-GCS1-FL/N/C和Myc-GRP78质粒转染到HEK293T细胞中。Co-IP显示GRP78主要与GCS1的C端结合。

图
4 GCS1与GRP78相互作用
5.
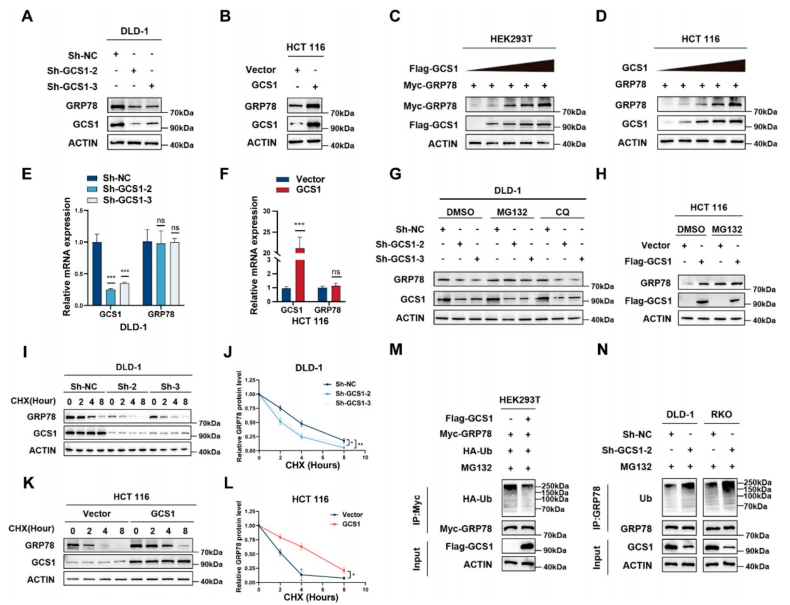
GCS1通过抑制GRP78蛋白的泛素化来稳定其稳定性
接下来的关键任务是探究GCS1对GRP78表达是否具有调控作用。研究揭示,GCS1表达的下调伴随着GRP78蛋白水平的降低,而其上调则导致GRP78蛋白显著增加,且这种增加呈现出剂量依赖性。然而,
无论是GCS1的过表达还是敲除,均未对GRP78的mRNA表达产生显著影响
。在DLD-1细胞中进行的WB分析显示,溶酶体抑制剂CQ并未能阻止GRP78的降解,同时MG132处理也未显著改变GRP78的表达水平。在RKO和HCT 116细胞中重复这些实验,得到了与DLD-1细胞相似或相反的结果。这些发现共同指向一个结论:
GCS1通过泛素-蛋白酶体途径抑制GRP78的降解
。进一步的研究利用蛋白质合成抑制剂放线菌酮(CHX)在HEK293T细胞中验证了GCS1过表达对GRP78降解的影响,结果与内源性GRP78的研究一致,表明GCS1能够延长GRP78的半衰期。此外,在GCS1过表达组中,通过抗GRP78抗体免疫沉淀得到的复合物中,泛素化的GRP78含量降低;而在GCS1敲低组中,这一含量则增加。综上所述,这些研究结果表明
GCS1与GRP78结合,并通过泛素蛋白酶体途径降低GRP78的泛素化,从而阻止其降解
。
图
5 GCS1通过泛素化途径抑制GRP78的降解
6.
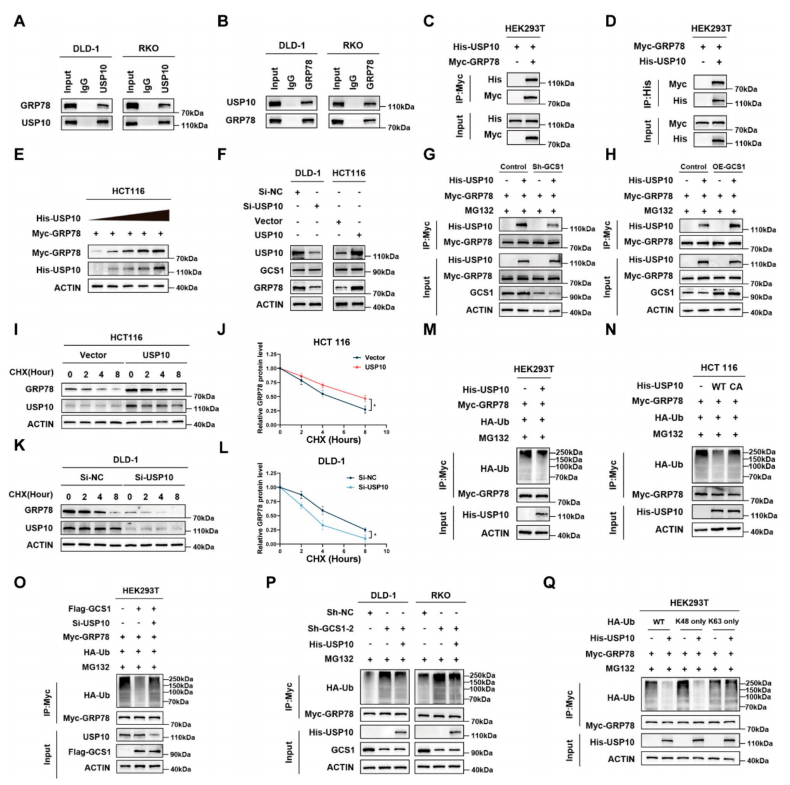
GCS1招募USP10来减轻GRP78的泛素化
以上研究结果表明,虽然GCS1不是一种泛素化酶,但它确实与GRP78结合并控制其泛素化水平。因此,研究者们假设GCS1可以通过招募DUBs来减少GRP78的降解。然后通过Co-IP证实,GRP78存在于USP10免疫沉淀中,而USP10蛋白也存在于GRP78免疫沉淀中。研究者们还检测了内源性和外源性USP10和GCS1的结合。USP10的敲除或过表达均未显著改变GRP78的转录水平;USP10的逐渐过表达导致GRP78蛋白水平逐渐升高,但不影响GCS1的表达水平。进一步研究发现,当GCS1下调时,USP10与GRP78的结合能力降低,而当过表达GCS1时,其结合能力增强。接下来使用蛋白合成抑制剂CHX研究了USP10对GRP78蛋白降解的影响。过表达USP10显著抑制了内源性和外源性GRP78的降解。相反,在USP10敲除后,内源性GRP78的降解显著增加。这些结果表明,
过表达USP10显著抑制了GRP78的降解
。随后,为了研究USP10的去泛素酶活性是否参与了GRP78降解的调控,研究者们将USP10的去泛素酶活性突变体USP10(C424A)转染到HEK293T和HCT 116细胞中,结果显示USP10(C424A)不能稳定和去GRP78泛素化。综上所述,
GCS1可以通过提高USP10切割该蛋白k48连接的多聚泛素链的能力来降低GRP78的泛素化水平
。
图
6 GCS1招募USP10来减少GRP78的K48连接的泛素化
7.
GCS1通过调节GRP78缓解内质网应激,促进结直肠癌进展
进一步的体外和体内研究证实了GRP78在GCS1介导的CRC进展促进中的作用。GRP78在稳定GCS1过表达的HCT 116细胞中被敲低,在具有稳定GCS1敲低的DLD-1和RKO细胞中过表达。细胞增殖试验的结果,如集落形成、EdU掺入和CCK8测定,证实GRP78过表达减轻了GCS1敲低诱导的CRC细胞增殖能力降低。然而,GRP78沉默对过表达GCS1的细胞具有相反的效果。此外,流式细胞术用于确定GCS1控制细胞凋亡的能力是否需要GRP78。结果证实,在GCS1过表达的细胞中,GRP78敲低部分恢复了这些细胞凋亡的能力。另一方面,GCS1敲低则具有相反的效果。使用Transwell和伤口愈合试验评估迁移和侵袭能力。与细胞增殖试验的结果类似,GRP78的过表达可以部分逆转GCS1敲低后观察到的细胞迁移和侵袭的减少
。通过裸鼠皮下移植瘤的代表性图像、肿瘤重量和体积的统计分析以及肿瘤的代表性免疫组化图像,进一步证实了GRP78参与Gcs1介导的CRC进展的促进。基于上述发现,
GCS1依赖于GRP78来抑制内质网应激介导的细胞凋亡,从而加速结直肠癌的发展
。