
BRAF V600E 突变在结直肠癌(CRC)中是一个重要的生物标志物,约占所有结直肠癌病例的 10%。这一突变通常与肿瘤的侵袭性、预后不良以及对常规化疗的耐药性相关联
[1]
。研究显示,
BRAF V600E 突变导致肿瘤细胞激活 MAPK 信号通路,进而快速增殖和转移,使得患者的生存预期显著降低
[2]
。此外,
BRAF V600E 突变患者通常对传统的化疗方案反应不佳
,临床治疗面临重大挑战
[3]
。
在临床实践中,BRAF V600E 突变的结直肠癌患者往往需要更为个性化的治疗方案。近年来,针对这一突变的靶向治疗和免疫治疗相关研究逐渐增多,显示出一定的疗效。尽管这些新的治疗方案为 BRAF V600E 突变患者提供了希望,但仍存在
疗效持续时间短、耐药性发展快
等问题,亟需进一步研究以优化治疗策略
[3,5]
。
因此,深入了解 BRAF V600E 突变对肿瘤生物学、预后及治疗反应的影响,对于制定更有效的治疗方案至关重要。
BRAF 基因位于人类染色体 7q34,编码一种丝氨酸/苏氨酸激酶,属于 RAF 家族的激酶。BRAF 在细胞内主要参与 RAS-RAF-MEK-ERK 信号通路的调控,负责将细胞外生长因子的信号转导至细胞核,促进细胞增殖和存活。正常情况下,BRAF 的激活依赖于 RAS 的结合,而 RAS 的活化又受到细胞外信号的调控。
BRAF 基因的突变,尤其是 V600E 突变,导致其持续激活,从而引发细胞的异常增殖和肿瘤形成
。BRAF V600E 突变是最常见的突变类型,占所有 BRAF 突变的 80% 以上,在多种癌症中被发现,包括黑色素瘤和结直肠癌
[7]
。
BRAF V600E 突变通过改变 BRAF 蛋白的构象,导致其持续激活,进而增强下游 ERK 信号通路的活性。这种持续的信号传导促进了细胞的增殖和生存,同时抑制了细胞凋亡。研究表明,BRAF V600E 突变不仅影响细胞增殖,还可能改变细胞的代谢途径,促进肿瘤微环境的形成,进一步推动肿瘤的进展。此外,BRAF V600E 突变与其他基因的共突变(如 KRAS 和 PIK3CA)相互作用,可能导致更为复杂的致癌机制
[8]
。这些突变的存在使得肿瘤细胞对传统化疗的耐药性增强,导致治疗效果不佳
[9]
。约 5-10% 的结直肠癌患者存在 BRAF V600E 突变,且这些患者通常预后较差,生存期较短。BRAF V600E 突变还与肠癌的特定分子亚型相关,影响治疗策略的选择。
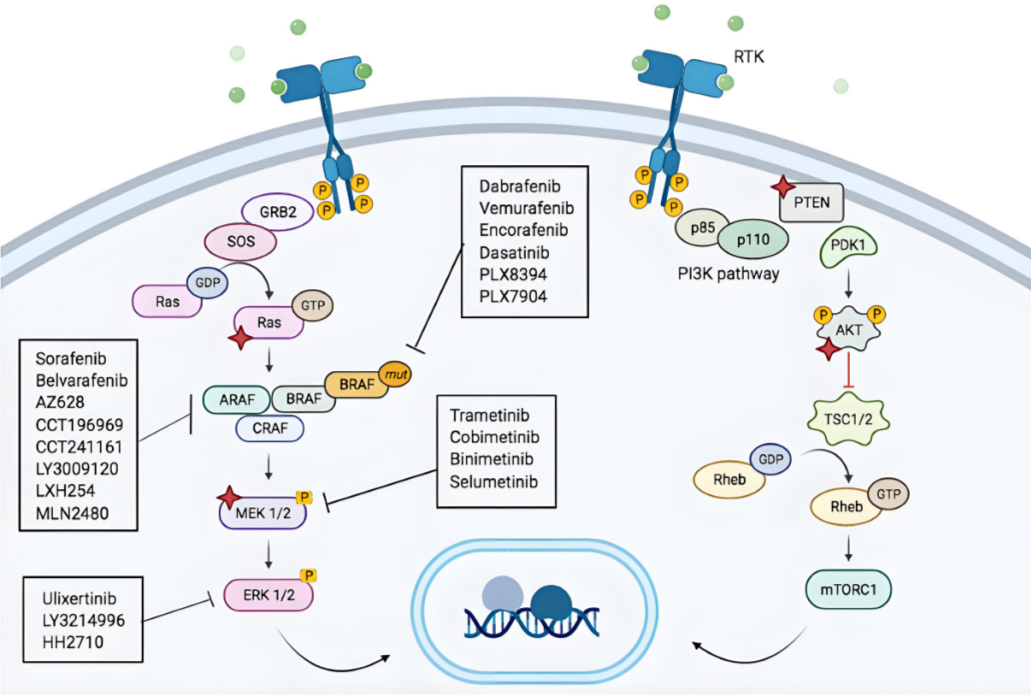 图 1. BRAF 突变相关信号转导通路示意图
图 1. BRAF 突变相关信号转导通路示意图
目前国内外各大权威指南一致推荐
BRAF 抑制剂联合抗 EGFR 单抗 ±MEK 抑制剂的双靶或三靶方案用于 BRAF V600E 突变肠癌的治疗
,最常见的包括 VIC 方案和 BEACON 方案。
VIC 方案即维莫非尼+伊立替康+西妥昔单抗,来自于 SWOG S1406 研究。该研究结果显示,对于既往经治的 BRAF V600E 突变 mCRC 患者,与西妥昔单抗+伊立替康相比,维莫非尼+西妥昔单抗+伊立替康的无进展生存(PFS)显著获益(4.2 vs. 2.0 个月,HR = 0.5,P = 0.001),客观缓解率(ORR;17% vs. 4%, P = 0.05)和疾病控制率(DCR;65% vs. 21%, P<0.001)均显著提升,中位总生存期(OS)分别为 9.6 个月和 5.9 个月
[4]
。
BEACON 方案即 Encorafenib+西妥昔单抗±Binimetinib,来自于 BEACON CRC 研究。该研究结果提示三靶组(
Encorafenib
+西妥昔单抗+
Binimetinib
)和双靶组(
Encorafenib
+西妥昔单抗
)与对照组(伊立替康+西妥昔单抗或 FOLFIRI+西妥昔单抗)相比,均可改善患者 OS 和 PFS,三组中位 OS 分别为 9.3 个月、9.3 个月和 5.9 个月,中位 PFS 分别为 4.5 个月、4.3 个月和 1.5 个月
[23]
。2024 ASCO 年会上,BEACON 研究的中国桥接试验 NAUTICAL CRC 研究公布了其结果,获益与 BEACON CRC 研究一致
[24]
。
针对 BRAF V600E 突变的靶向药物研发正在不断推进,除了已有的 BRAF 抑制剂以外,研究者们还在探索新型靶向药物。例如,PROTAC 技术作为一种新兴的药物开发策略,能够通过泛素-蛋白酶体途径选择性降解 BRAF 蛋白,从而克服传统小分子抑制剂的耐药性
[10]
。此外,针对肿瘤微环境的靶向治疗也在积极探索中,研究发现通过调节肿瘤微环境,可以增强靶向药物的效果并降低耐药性
[11]
。随着对 BRAF V600E 突变机制的深入理解,未来有望开发出更多新型靶向药物,为结直肠癌患者提供更有效的治疗选择
。
据报道,MSI-H 患者中 BRAF V600E 突变发生率为 30%~50%,明显高于 MSS 患者的 10%
[26,27]
。一项纳入了 1253 例结直肠癌的大型分析数据显示,无论 BRAF 状态如何,
MSI-H 患者的生存期均显著优于 MSS 患者
[28]
。Ⅲ期 KEYNOTE-177 研究与Ⅲ期 CheckMate 8HW 研究的亚组分析结果均显示 BRAF 突变患者与 BRAF 野生患者使用免疫治疗显示出和 MSI-H 全人群一致的获益趋势,这些研究结果提示
MSI 状态仍然是免疫疗效的决定性临床因素
。
有研究发现,在肿瘤微环境中,靶向治疗能够促进 T 细胞的浸润和激活,从而增强免疫应答
[12]
。一项Ⅰ期研究初步评估了维莫非尼联合西妥昔单抗和卡瑞利珠单抗治疗经治患者的安全性和疗效。共入组 10 例受试者,ORR 为 40%,DCR 为 80%,中位 PFS 为 3.47 个月,中位 OS 为 10.2 个月,显示出一定的有效性,需要在更大样本量中进一步验证疗效
[29]
。SEAMARK 研究是一项开放标签、多中心、随机、Ⅱ期临床研究,计划纳入 104 例既往未经治疗的 MSI-H/dMMR 合并 BRAF V600E 突变的 mCRC 患者,按照 1∶1 随机分组接受康奈非尼+西妥昔单抗+帕博利珠单抗对比帕博利珠单抗单药,主要终点为研究者评估的 PFS,预计 2026 年初步完成
[30]
。
尽管免疫治疗在 BRAF V600E 突变结直肠癌中展现出潜力,但耐药性仍然是一个重大挑战。研究表明,肿瘤微环境的改变、免疫逃逸机制以及肿瘤细胞的基因突变等因素均可能导致免疫治疗的耐药
[13]
。例如,BRAF V600E 突变的肿瘤细胞可能通过上调 PD-L1 表达来抑制 T 细胞的活性,从而逃避免疫监视
[14]
。研究者们正在探索多种应对策略,包括联合使用其他免疫调节剂、靶向治疗以及化疗,以增强免疫治疗的效果
[3]
。此外,针对肿瘤微环境的干预,如使用抗血管生成药物,可能有助于改善免疫治疗的疗效
[15]
。通过深入理解耐药机制并制定相应的治疗策略,未来有望提高 BRAF V600E 突变结直肠癌患者的免疫治疗效果
。
BRAF V600E 突变的结直肠癌患者通常对传统化疗药物的反应较差,尽管如此,一些研究表明化疗在 BRAF V600E 突变的结直肠癌治疗中仍然具有一定的应用价值。例如,FOLFOXIRI(氟尿嘧啶、亚叶酸钙、奥沙利铂和伊立替康的联合用药)与贝伐单抗的联合使用,在一些患者中显示出较好的效果
[2]
。然而,BRAF V600E 突变的患者在接受化疗时,往往面临较高的复发风险
[3]
。在临床实践中,针对 BRAF V600E 突变的结直肠癌患者,化疗通常与靶向治疗结合使用,以期提高疗效并改善患者的预后
。
化疗与靶向治疗的联合使用在 BRAF V600E 突变的结直肠癌患者中显示出良好的前景。一项中国的单中心 IMPROVEMENT 研究探索了维莫非尼+西妥昔单抗+FOLFIRI 用于 BRAF V600E 突变型 mCRC 的疗效与安全性(n = 21),主要入组一线和二线治疗人群(一线:57.1%;二线:38.1%),
这一双靶联合化疗方案的 ORR 达 81%,中位 PFS 和 OS 分别为 9.7 个月和 15.4 个月
。尽管样本量有限,但初步结果显示出有潜力的抗肿瘤活性,且耐受性良好
[16]
。另一项 Ib 期研究探索了达拉非尼+曲美替尼+西妥昔单抗+伊立替康这一四药联合方案的疗效,ORR 和 DCR 分别为 30% 和 80%,中位 PFS 为 7.5 个月
[25]
。未来需进一步优化化疗联合靶向治疗的方案,以期进一步改善患者预后。
化疗耐药是 BRAF V600E 突变结直肠癌治疗中的主要挑战。耐药机制可能涉及多种因素,包括肿瘤微环境的变化、药物代谢的改变、以及癌细胞内信号通路的激活等
[17,18]
。例如,BRAF V600E 突变可导致 MAPK 通路的持续激活,从而促进肿瘤细胞的生存和增殖,降低化疗药物的敏感性
[19]
。为了解决这一问题,研究者们正在探索多种策略,包括使用联合治疗方案、靶向药物的开发,以及新型药物传递系统的应用等
[20,21]
。
通过对患者基因组特征进行分析,研究者能够为患者量身定制最合适的治疗方案,从而提高治疗效果。然而,个体化治疗的实施仍面临多重挑战,包括生物标志物的识别、治疗反应的预测以及患者的经济负担等
[22]
。此外,如何在临床实践中整合多种治疗方案以实现真正的个体化治疗,也是未来研究的重要方向。
近年来 BRAF V600E 突变肠癌的研究与治疗取得了显著进展,然而仍面临诸多挑战。通过分析现有的文献研究,我们发现靶向治疗与免疫治疗的结合为这一特定类型的肠癌患者提供了新的希望。BRAF V600E 突变不仅影响肿瘤的生物学行为,还可能导致对传统化疗耐药。针对这一突变的靶向药物如 BRAF 抑制剂等,已显示出良好的临床疗效,但其单独使用常常无法达到持久的治疗效果。因此,结合免疫治疗的策略显得尤为重要,这种组合治疗不仅可以通过靶向抑制肿瘤细胞生长,还可以激活机体的免疫反应,从而提升治疗的整体效果。然而,不同研究之间的结果不尽相同,如何平衡这些观点和发现成为当前亟需解决的问题
。
[1]
Al-Salama ZT. Encorafenib: A Review in Metastatic Colorectal Cancer with a BRAF V600E Mutation. Drugs. 2021;81(7):849-856. doi:10.1007/s40265-021-01501-5.















