
全世界每年死于蚊子传播的疾病的有 1 千万人,若出现全球范围内的大爆发,毁灭程度远超 2014 年埃博拉和 2003 年非典。
2017 年 7 月,Discovery 推出新一季的纪录片
Mosquito
(蚊子),制作人员跑遍了四大洲,采访了全球健康领域的领导,以及生活在各大洲的居民,揭示了一个大家可能意识不到的事实:除了战争,蚊子可能是目前具有最大杀伤力的「武器」。
比尔 · 盖茨也为这一季的纪录片录制了宣传片段,文首那段话,正是他在宣传片中所说的。而
这番评价并非危言耸听。
地球上除了冰岛,蚊子无处不在。在已知的 3500 多种蚊子中,大部分体长都小于 15 毫米,体重仅 2~2.5 毫克,而且适应力极强,产下的卵可以存活超过一年,一旦遇水,便立即孵化。
疟疾、登革热、寨卡、黄热病等十多种疾病均是它们的「杰作」,2015 年全球仅疟疾病例就有 2.12 亿,42.9 万人死亡,非洲内陆每分钟就有 2 个人因疟疾而死。
雪上加霜的是,疫苗的研发赶不上疾病谱的变化。公共卫生学家开始改变思路,或者,灭除这种引发虫媒传染病的「罪魁祸首」才是预防疾病的正道?
吴承恩在《西游记》五十三、五十四回写到女儿国——一个从上到下都是女子的国度,当地女人长到二十岁,便会喝「子母河」的水,三天之后就会诞下女孩。
艺术来源生活。科学作家
Carl Zimmer
在
Science
上,就曾发表过这样一个故事:
非洲大陆上,有个叫乌干达的地区,科研人员发现,该地区的蝴蝶 94% 都是雌性。这是蝴蝶的
「女儿国」,但让蝴蝶几乎都是雌性的,不是「子母河」的河水,而是一种叫
Wolbachia(以下简称,沃尔巴克氏体)的
寄生菌。
感染了沃尔巴克氏体的蝴蝶,会被「种群雌化」。
沃尔巴克氏体能够感染蝴蝶的很多器官,但最重要的是感染精巢与卵巢。仅由被感染的雌性蝴蝶把沃尔巴克氏体传播给后代。
沃尔巴克氏体通过改变宿主的生殖能力极大化了其传播,有四种表型:
-
雄性死亡:
被感染的雄性在幼虫发育时死亡,这增加了被感染的雌性的出生率。
-
雌性化:
被感染的雄性发育为雌性或者不能生育的伪雌性。
-
孤雌生殖:
被感染的雌性的单性生殖。一个孤雌生殖的例子是赤眼峰,在感染沃尔巴克氏体情形下无需雄性也能生殖后代。在这个物种中,雄性非常罕见,可能已经被同一菌株的沃尔巴克氏体杀死。
-
细胞质不兼容:
被感染的雄性不能与未被感染的雌性繁殖,也不能与感染了其他基因型的雌性繁殖。
正因为这样,所以被感染的蝴蝶群体,具有极高比例的雌性比例。
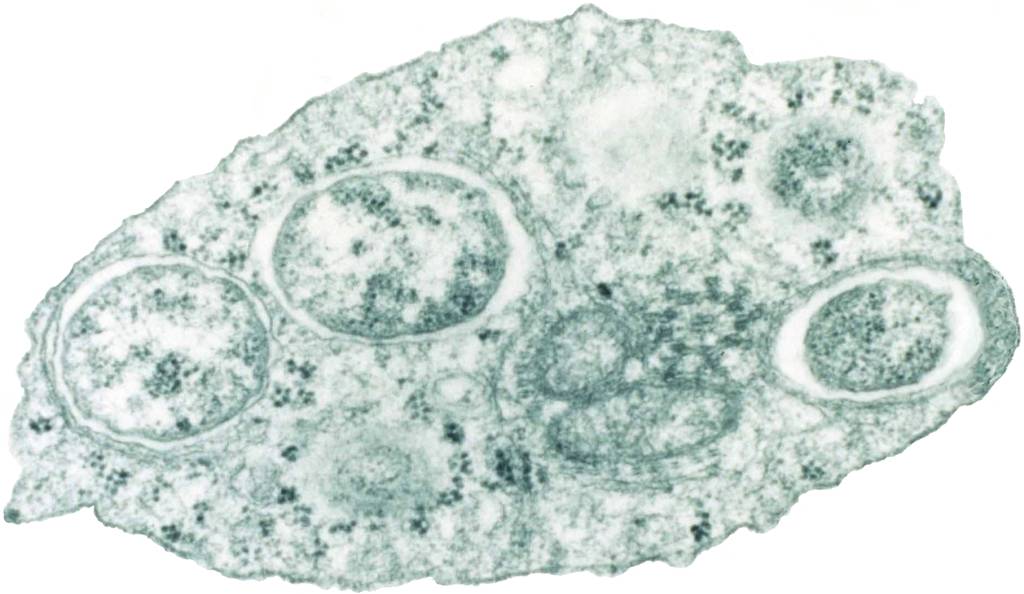
沃尔巴克氏体真容
其实,早在 1927 年,沃尔巴克氏体就被发现。但有两个主要原因导致它并没有被应用到控制蚊子的繁殖中:
第一,沃尔巴克氏体导致物种雌化的现象只在特定物种;
第二,尽管有大约 65% 的昆虫种类和 28% 的蚊虫种类天然携带沃尔巴克氏体(沃尔巴克氏体主要感染非脊柱动物如昆虫,但感染不了人、狗等脊椎动物),但蚊媒疾病的几个主角不在其中。
当学者还在冥思苦想时,蚊媒疾病已经出现合并感染的情况:在加蓬和印度进行的研究结果表明,一个蚊子样本中检出两种病毒,被它叮咬,人可以同时感染基孔肯雅病毒和登革热病毒。
研发速度赶不上疾病发展的脚步,蚊子已经将寨卡疫情发病间隔从 60 年缩短到 3 年左右,但最早能使用的疫苗还到 2020 年才能投入使用。
人真的总是慢虫子一步么?
将针插入气球,再慢慢抽出来,还要保证气球不破,要怎样的技术?
中国广东有世界最大的「蚊子工厂」,里面的研究员一天可以扎 100~200 个「气球」,只是「绣花针」换成了胚胎注射针,「气球」则成了白纹伊蚊的卵。
丁香园
(微信号:dingxiangwang)
联系了「蚊子工厂」
的负责人,中山大学-密歇根州立大学热带病虫媒控制联合研究中心主任奚志勇教授。
奚教授是世界上第一个通过显微胚胎技术在蚊媒间移植沃尔巴克氏体,并实现与伊蚊、疟蚊的共生关系的科学家。

Science 2005(左)和 2013 年
刊登了奚志勇教授的研究
「培育感染沃尔巴克氏体雄蚊,胚胎技术最为关键」,奚志勇教授告诉丁香园,「在显微镜下将虫卵放大 200 倍,在虫卵被产出后 60~90分钟内将沃尔巴克氏体注射在虫卵的生殖器部位,每 500~1000个注射胚胎才可以建立一个感染系统。这期间注射的位置、时间和菌种都不能有差错。」
此外,奚志勇教授将沃尔巴克氏体技术与放射技术相结合,
通过注射、培育、筛选、饲养、辐射、释放等步骤,让这座
2011 年建成、面积超过 3500 平方米、有 4 个车间的「蚊子工厂」每周能生产 500 万只雄蚊,且均携带沃尔巴克氏体。
这个过程可以借用 Google 母公司 Alphabet 旗下的生命科学子公司 Verily 做的 Debug Project 项目解释,因为他们到奚志勇教授的「蚊子工厂」进行了参观学习。
debug.com 的主页上写着:「我们的宗旨是培育『好』蚊子来消灭『坏』蚊子」。
这个过程包括 6 步:
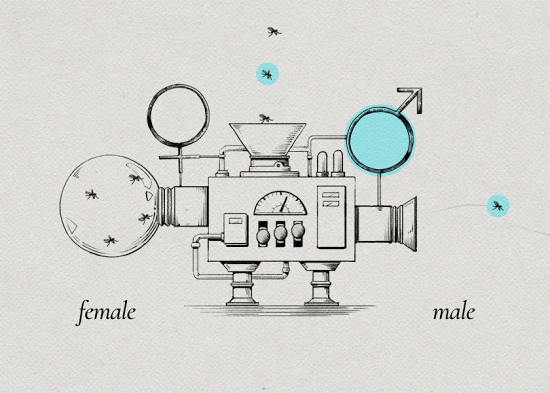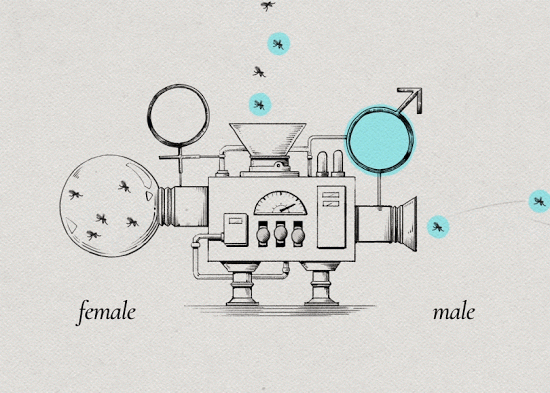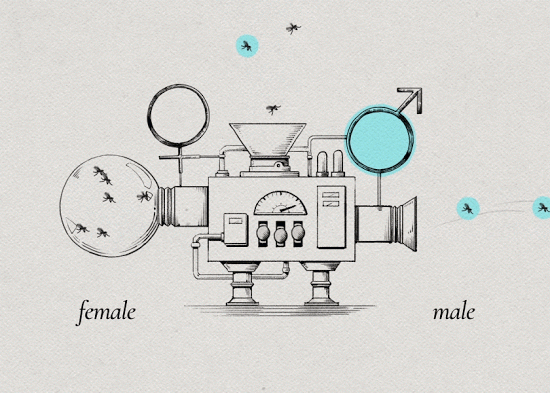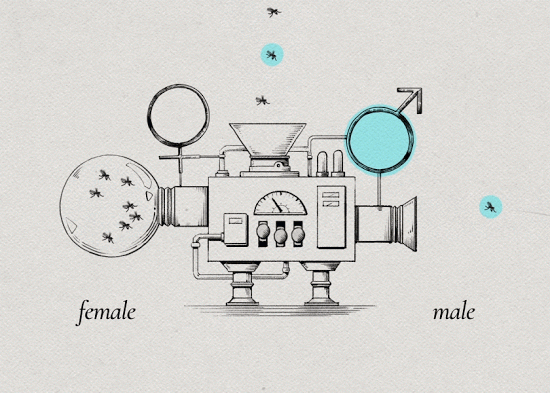
1. 从其他物种上提取寄生菌沃尔巴克氏体。

2. 将沃尔巴克氏注射到埃及伊蚊虫卵内。
3. 将培育成形的埃及伊蚊进行筛选区分,将未感染沃尔巴克氏体的雌蚊和携带沃尔巴克氏体的雄蚊分开。(因为只有母蚊子吸血)
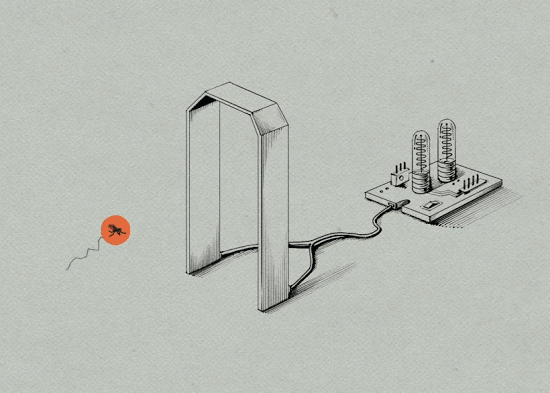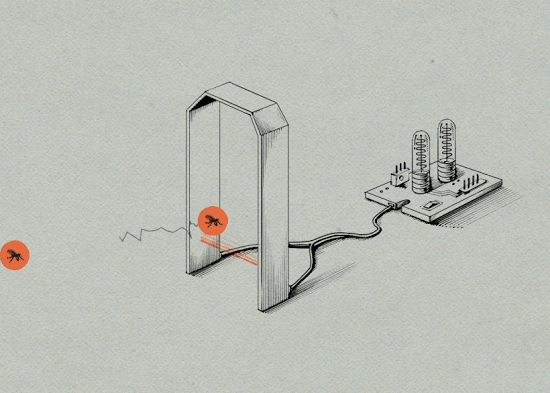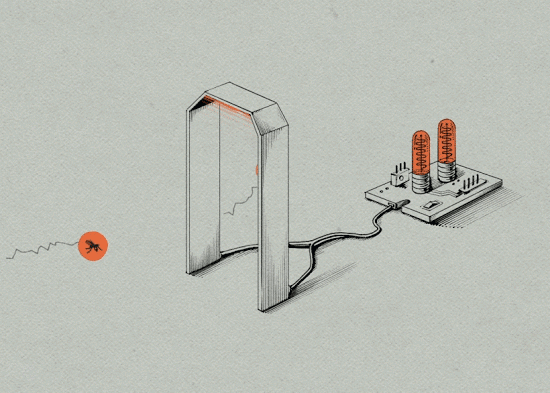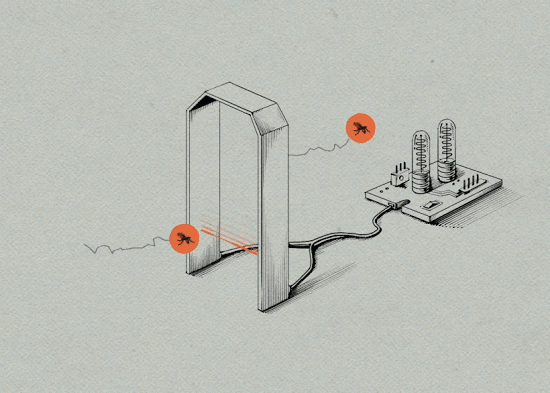
4. 一切准备就绪后,将不孕的雄蚊在指定地点按指定批次释放。

5. 因为埃及伊蚊雌蚊一生只交配一次,当遇到携带沃尔巴克氏体的雄蚊交配后,受精卵受到沃尔巴克氏体的抑制,无法孵化。
6. 释放结束后,研究人员还需对释放效果进行监测。
今年,华盛顿邮报、CNN 等媒体都大幅报道了 Debug 在加州释放 2 千万沃尔巴克氏蚊,其使用的菌株便是奚志勇教授,在博士期间建立并发表在 Science 上的 WB1,这些报道中均提到「蚊子工厂」取得的成就:
广东沙仔岛 2014 年试点释放,监测数据反馈部分地区成虫抑制率达到 95%以上。
在去年第五届世界卫生组织病媒疾病咨询控制年会上,奚志勇教授团队的技术被认可在蚊媒疾病控制上拥有「高效、长远」的效果,同时也被认定为
当下最具有潜力的控蚊三大技术之一,另外两个是转基因雄蚊和昆虫绝育技术。
奚志勇教授告诉丁香园:「日后,沃尔巴克氏体还将用于更多领域,目前针对疟疾的感染沃尔巴克氏体的疟蚊已结束试验阶段;针对稻飞虱(农业害虫)的沃尔巴克氏体也在加紧研制中,未来都将实现规模化生产。」
丁香园也对 Google 的技术团队进行了沟通,并将会密切跟进项目。














