纵观近年医药行业颁布的政策,大致有三个着力点:医药研发、医药生产、医药流通使用,着力的方向在于优胜劣汰鼓励创新、一致性评价提高药品质量、流通整治,今年颁布的政策也延续了这一思路。
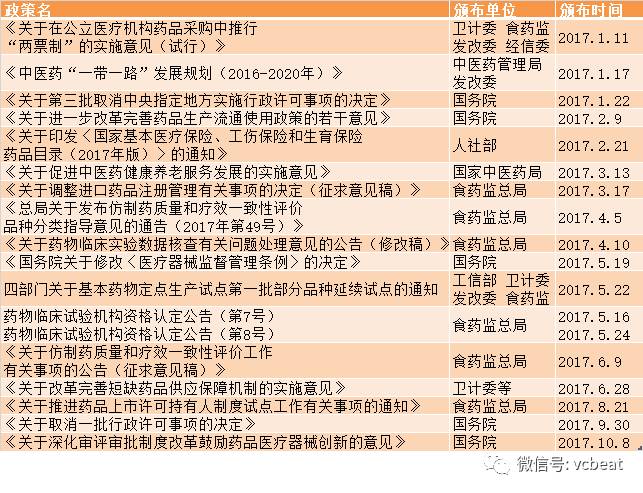
首先来看药物及医疗器械研发方面的政策,最先提及的是CFDA5月11日连发的四项关于鼓励药品医疗器械创新的相关政策。

鼓励药品医疗器械创新系列组合拳从新药研发、临床试验、所有者权益及上市审批等方向出发,鼓励创新,引导建立完整的研发上市路径,对行业影响颇深。
实际上,鼓励新药研发一直是行业的主基调,回溯至2015年8月颁布的国务院“44号文”,明确了药品医疗器械审评审批改革的12项任务,其中就有解决注册积压、推进一致性评价、MAH(药品上市许可持有人制度)试点、临床急需药品加快审批的内容。
先看审批改革,按食药监药品审评中心发布的《2016年度药品审评报告》,药审中心通过加强审评项目管理、细化审评序列、强化时限管理、成立专项小组等方式,不断提高审评效率和质量。
2016年全年完成审评并呈送总局审批的注册申请共12068件,较2015年提高了26%,排队等待审评的注册申请已由2015年9月高峰时的近22000件降至8200件,基本消除了积压。
再是新药引进方面的政策,食药监于今年3月份发布《关于调整进口药品注册管理有关事项的决定(征求意见稿)》,目的是“鼓励境外未上市新药经批准后在境内外同步开展临床试验,缩短境内外上市时间间隔,满足公众对新药的临床需求”。
从实际规则看,国外未上市新药可在国内进行国际多中心临床试验,完成实验之后可直接提出药品上市注册申请;对于申请进口的化学药品新药以及治疗用生物制品创新药,取消应当获得境外制药厂商所在生产国家或者地区的上市许可的要求。这些政策无疑给境外新药在国内上市开了“绿色通道”。
到10月8日,中共中央办公厅、国务院办公厅再发布《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,被称为产业创新发展的“里程碑式”改革。
系列举措涉及六大方面的改革内容:
1)改革临床试验管理,确保临床试验科学、规范、真实;
2)加快临床急需药品和医疗器械的上市审评速度,解决公众用药需求;
3)鼓励创新,推动中国医药产业健康发展;
4)全面实施上市许可持有人制度,加强药械全生命周期管理;
5)提升技术支撑能力,全力为创新服务;
6)加强组织领导,以法治思维和法治方式推动改革真正落地。
食药监官方称,目前,鼓励药品医疗器械创新具备诸多有利条件。
一是国内医药创新风起云涌。
近年来,我国医药企业新药和创新医疗器械申报数量逐年增加。埃克替尼、阿帕替尼、西达本胺、康柏西普等15个1类创新药获得批准生产,29个创新医疗器械获准上市。
二是审评审批制度改革进展顺利。
2015年开始的药品医疗器械审评审批制度改革,提高了审评质量和标准,整治了科研造假不良风气,提高了审评审批透明度。药品审评积压问题如期解决。
三是仿制药质量和疗效一致性评价顺利起步。
2016年2月,国务院专门发文明确相关政策,部分地方政府也出台相关支持政策,企业参与一致性评价的积极性很高,近期将有一批仿制药率先获准通过。
四是上市许可持有人制度十省市试点进展顺利,激发了科研人员创新的热情。
国家食品药品监督管理总局副局长吴浈在政策沟通会上表示,前述举措将推动“药品供给侧改革”,使我国医药产业做大做强,更具有竞争力,改变我国长期依赖新药进口的局面。
仿制药质量和疗效一致性评价方面,细化规定和配套政策陆续颁布,包括人体生物等效性实验豁免指导原则、改规格药品(口服固体制剂)评价技术指南、现场核查指导原则等,以及参比制剂的确定和临床试验机构扩容。这两项政策坚定了企业推进一致性评价的信心,使落实的确定性和可操作性更高。
除了以上两大重点方向之外,短缺药品供应保障、合理使用亦为监管重点。
另外,医药流通方面亦有多项重磅政策出台,包括“两票制”、国务院“13号文”、医药电商资质取消等。
“两票制”要求公立医疗机构在药品采购中要逐步实行“两票制”,鼓励其他医疗机构推行“两票制”,综合医改试点省和公立医院改革试点城市的公立医疗机构要率先执行“两票制”,鼓励其他地区推行“两票制”,争取2018年在全国推开。
据动脉网统计,截至10月中旬,全国34个省级行政区有29个已出台或执行“两票制”相关政策。
“13号文”则指出,应整顿药品流通秩序,推进药品流通体制改革;推动药品流通企业转型升级,推动药品流通企业跨地区、跨所有制兼并重组,培育大型现代药品流通骨干企业。加快形成以大型骨干企业为主体、中小型企业为补充的城乡药品流通网络。鼓励药品流通企业批发零售一体化经营。推进零售药店分级分类管理,提高零售连锁率。
综合分析,从“营改增+两票制+流通整治”,有助于打击医药流通中存在的过票倒票等灰色行为,提升行业的透明度。同时,一批优质企业将放大自身优势,进行行业并购,推进行业集中度提升。
医药零售方面,在“13号文”、“2017医改任务”中均有提及,包括处方药外购,规范零售药店互联网零售服务,推广“网订店取”、“网订店送”等新型配送方式;试行零售药店分类分级管理,鼓励连锁药店发展,探索医疗机构处方信息、医保结算信息与药品零售消费信息互联互通、实时共享等。
回顾2017年医药方面的监管政策,整体逻辑是去芜存菁、鼓励创新,要逐步破除医药领域存在的不合理现象,强化监管,促进行业持续向好发展;并通过简化流程,引入进口新药,同时完善新药创新产业链条基础设施,提升国内药企研发创新的积极性。















