1:BRD4激活Gli1、Gli2等基因的启动子活性,促进Hh通路基因表达和功能
Shh和SAG(Smoothened agonist)都是能够激活经典Hh通路的配体,添加后会显著促进Gli1、Gli2、Ptch1等基因的转录水平。利用Gli1启动子接Luciferase报告基因检测Gli1启动子活性,,研究者证明BRD4抑制剂JQ1能够抑制Gli1启动子活性(Fig.1A)。相应的,Gli1、Gli2、Ptch1等Hh通路相关基因表达水平和蛋白水平也会相应下降(Fig.1B-D)。Brd4是JQ1的靶蛋白中的一个,利用shRNA敲除Brd4同样会导致Gli1启动子活性下降、以及相应的下游基因RNA水平下调(Fig.1E-F)。
研究者进一步在动物体内水平检验JQ1对Hh通路的抑制作用。斑马鱼中Ptc2也是经典的Hh通路蛋白,受到Gli1蛋白的转录水平调控。利用Ptc2::GFP构建的转基因斑马鱼可以作为Hh报告系统。如Fig 1G,JQ1处理能够导致斑马鱼体内Ptc2水平下降。Hsp70l启动子启动Shha过表达的转基因斑马鱼中,Shha水平异常增高导致眼部畸形,因此也常常用来作为Hh通路的报告系统。JQ1处理转基因斑马鱼会部分回复眼部畸形表型,即Hh通路水平过高的表型(Fig.1H)。
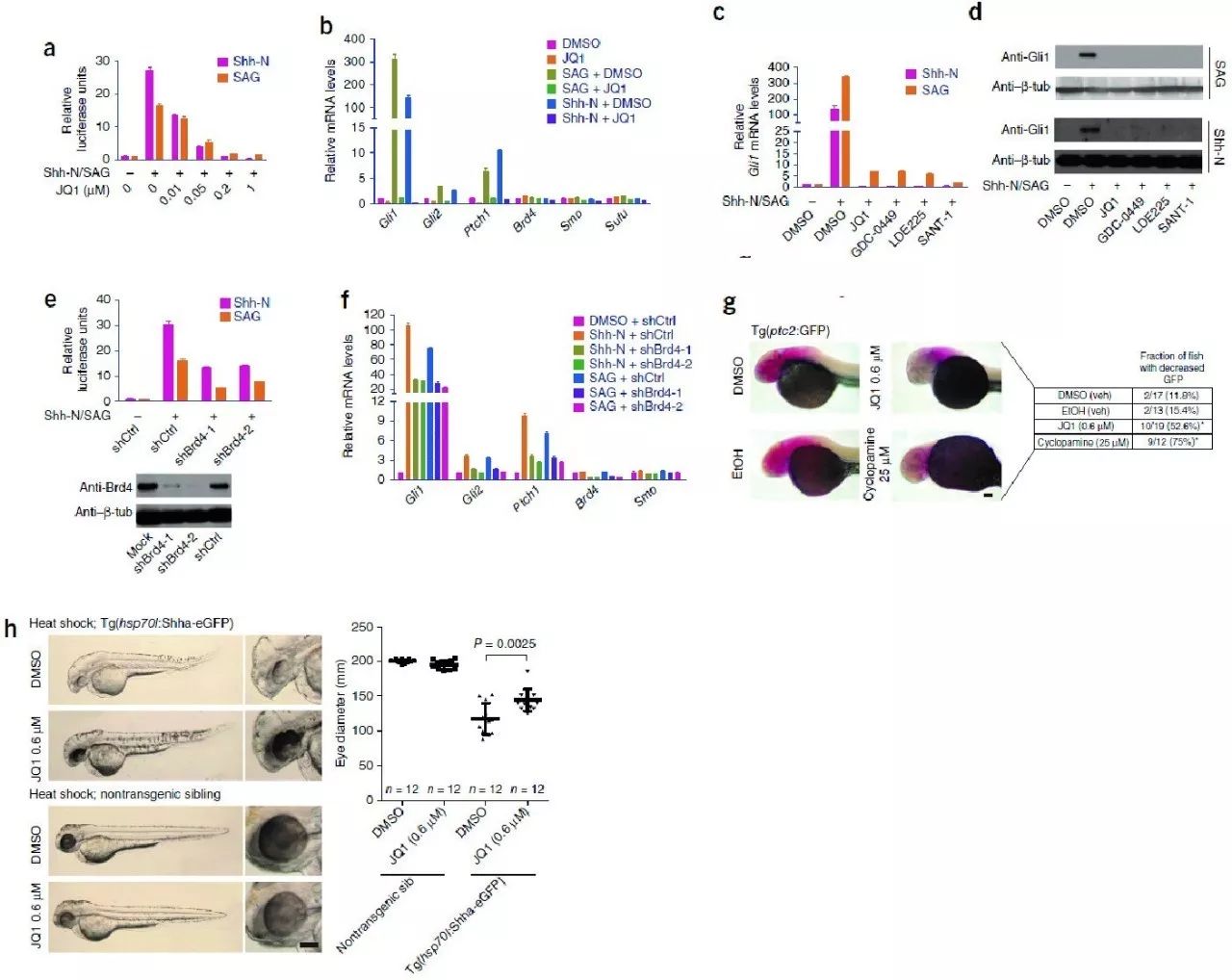
Fig.1 BRD4促进Hh通路蛋白表达
2:BRD4结合在Gli1和Gli2的启动子区域,并且抑制剂JQ1能够抑制这种结合
首先研究者利用两个细胞系,进一步分析了BRD4、BET抑制剂JQ1与Gli1等Hh通路相关蛋白表达之间的关系。
细胞系一:
Sufu敲除的MEF细胞系,由于Sufu能够促进Gli1蛋白降解,故Sufu缺失会导致Gli1稳定性增强、即蛋白水平提高;
细胞系二:
Hh-Light2,其中Gli2过表达。
Sufu敲除的细胞系中,加入BET抑制剂JQ1依旧能够抑制Gli1和Gli2的蛋白水平,另外Smo蛋白水平也有一定下降(Fig.2a)。而Hh通路中Smo蛋白的功能发生在Sufu抑制Gli1/2的上游,故而Smo的三个抑制剂都不能抑制Sufu敲除MEF中Gli1/2的表达水平和蛋白水平(Fig.2B-C)。利用shBrd4能够获得类似的结果(Fig.2D)。与之相似的结果在Hh-Light2细胞系中同样可以观察到(Fig.2E-F)。
统计发现,JQ1处理对于Gli1和Gli2的抑制作用仅仅需要3hr,如此短的作用时间提示了JQ1以及BRD4对于Gli1/2的转录调控很大可能性是直接的。因此研究者利用ChIP-PCR的方法,分析了Gli1和Gli2序列上TSS位点附近Brd4、和Pol II的结合情况。如Fig.2G-J所示:
1- Brd4和Pol II都在TSS位点附近存在富集
2- SAG能够进一步促进Brd4和Pol II的结合
3- JQ1的加入强烈抑制Brd4的结合,并且能抑制Pol II的结合
4- JQ1能完全逆转SAG的促进作用
5- JQ1在Sufu敲除的细胞系中同样起到抑制作用
Pol II的结合水平反映了基因转录水平即mRNA产量,以上结果侧面说明BRD4能够结合Gli1和Gli2启动子,起到促进表达的作用。
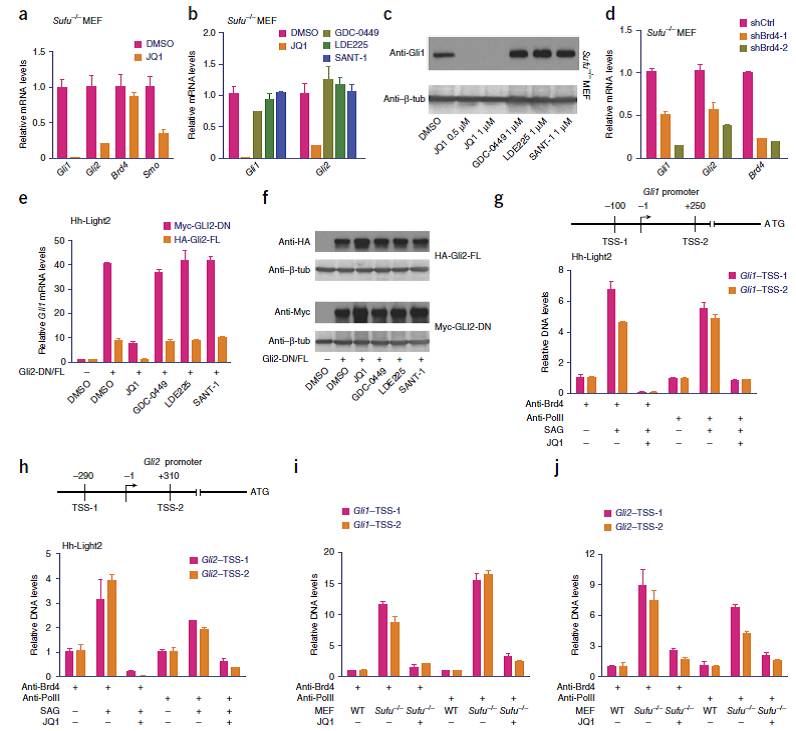
Fig.2 JQ1抑制Gli1和Gli2启动子活性和蛋白表达















