来自上海科技大学iHuman研究所,中科院生物物理研究所,以及美国东北大学等处的研究人员成功解析了人源大麻素受体CB1(human Cannabinoid Receptor 1, CB1)与激动剂——四氢大麻酚(THC)类似物复合物的三维精细结构,揭示了大麻素受体在激动剂调控下的结构特征和激活机制。

iHuman研究团队部分成员合影。从左至右:濮梦辰,吴屹然,刘志杰,华甜,Raymond Stevens,曲露,丁康
这一研究成果公布在7月5日的Nature杂志上,上海科技大学为第一单位,通讯作者为iHuman研究所副所长、教授刘志杰,以及生命学院助理教授赵素文,第一作者为刘志杰课题组博士研究生华甜(与中科院生物物理研究所联合培养)。
今年5月,上海科技大学iHuman研究所还发表了另外一项G蛋白偶联受体研究发现,同样公布在Nature杂志上。研究人员突破了GLP-1R在天然状态下异常不稳定且重组表达产量低的瓶颈,通过构建双融合蛋白和基于结构模型的热稳定突变筛选,鉴定出一个GLP-1R跨膜区的稳定表达克隆。然后,他们借力小分子别构调节剂稳定受体蛋白,首次获得了该受体跨膜区非活化状态的晶体结构(2.7埃)。后者揭示了小分子配体与受体独特的作用方式,即结合在第六个跨膜螺旋(TM6)的外围,与之前报道的胰高血糖素受体与小分子拮抗剂MK-0893的结合位点类似,但模式各不相同。
我国学者第一单位连发两篇《Nature》,报道II型糖尿病治疗新突破
据报道,GPCR是人体内最大的细胞膜表面受体家族,在细胞信号转导过程中发挥核心作用。GPCR也是药物研发领域的“宠儿”,目前有近40%的上市药物以GPCR为作用靶点。GPCR家族成员具有非常保守的七次跨膜螺旋结构,配体与受体结合后,通过跨膜区的构象变化,将信息传递到细胞内。配体的性质决定GPCR的状态:起激活作用的配体(激动剂)使受体活化,而起抑制作用的配体(拮抗剂)则抑制受体活性的发挥,受体与这两类配体结合后呈现的三维结构可以说是这个受体的“阴阳双面”。针对不同的GPCR,激动剂或拮抗剂配体具有不同的药物开发价值。
大麻素受体CB1是人体中枢神经系统表达量最高的GPCR之一,它对人的精神和情绪调节至关重要。去年10月,iHuman研究所团队率先在《Cell》上发表了人源大麻素受体CB1与拮抗剂小分子AM6538复合物的高分辨率三维结构,该结构揭示了CB1在非活化状态下的构象以及拮抗剂小分子与受体之间的作用模式,对设计更加特异、副作用更小的拮抗剂类药物,比如肥胖、及肥胖引起的代谢类疾病,肝纤维化及尼古丁成瘾等疾病,具有极大的促进作用。
大麻素受体CB1的激动剂在疼痛、炎症、多发性硬化症及神经退行性疾病等的治疗中有非常大的潜力,但激动剂小分子,例如大麻里的主要精神类成分THC,是如何与CB1相互作用以及受体的活化机制等尚不清楚。
目前已解析的GPCR三维结构中大部分是与拮抗剂配体的复合物,与激动剂结合的活化状态的GPCR构象非常活跃且不稳定,解析其复合物结构的难度相对较大。
为获得大麻素受体CB1与激动剂复合物的三维结构,iHuman研究团队与美国东北大学的Makriyannis实验室合作,基于THC设计并筛选了一系列特异性高,结合力强的激动剂小分子。研究人员经过多轮蛋白纯化及结晶条件的筛选和优化后,成功解析了CB1与两种新型激动剂小分子AM11542和AM841的三维精细结构。
这一结构不仅揭示了激动剂小分子与CB1的相互作用模式,更重要的是,研究者发现,这与之前解析的CB1-拮抗剂小分子复合物结构相比,发生了很大的构象变化。其中结合口袋体积发生了53%的变化(激动剂的结合口袋体积:383埃3,拮抗剂的结合口袋体积:821埃3,1埃=
10-10米),受体的整体结构变化包括蛋白的N端以及七次跨膜螺旋的构象的显著变化(均方根偏差为3.5埃)是在以往解析的GPCR结构中变化最大的。
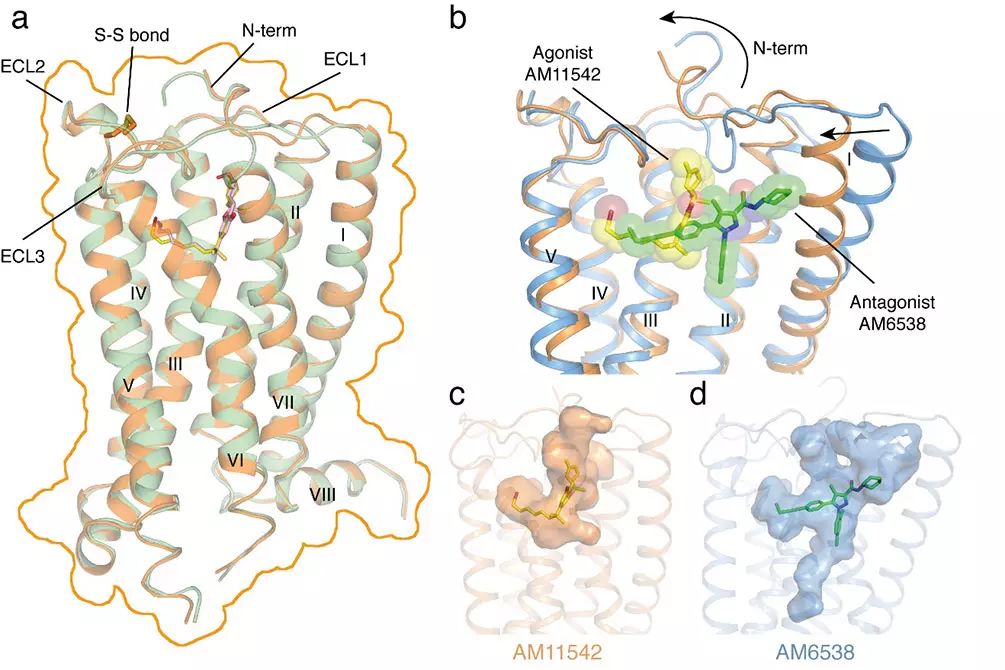
CB
1
与激动剂复合物的三维结构(a);激动剂与拮抗剂小分子结合方式及结合口袋比较
(b-d)
蓝色: 与拮抗剂AM6538结合的受体;橙色:
与激动剂AM11542结合
的受体
这些结构特征也从分子水平解释了为什么大麻素受体CB1可以与多种不同类型的配体相互作用,参与和调控人体中多种非常重要的生理活动,同时也为今后针对GPCR的药物设计提供了新的思路。
这项研究的另一重要发现是,首次从三维结构上观测到两个氨基酸(Phe2003.36/
Trp3566.48)在受体激活过程中的协同构象变化,相当于“双耦合开关”(twin toggle
switch),这一协同变化效应可能与CB1的活化机制密切相关。
此外,通过与iHuman研究所赵素文课题组及北京计算科学研究中心刘海广教授课题组合作,基于该晶体结构对不同类型CB1激动剂进行分子对接及动力学模拟分析,得到了不同配体的结合模式并进行了功能性实验验证。为设计针对CB1的激动剂类药物分子以及探究CB1受体的活化机制提供了非常重要的结构基础。
“掌握了CB1与激动剂和拮抗剂复合物的三维结构信息,或者说看清了这个受体的‘阴阳双面’,不仅对于内源性大麻素系统的功能机制研究极其重要,对一系列疾病,如炎症、疼痛和多发性硬化症等的药物研发有重要的指导意义。同时,由于大麻滥用及合法化等问题,该研究也有非常重要的社会价值。我们很高兴能取得了这个历史性突破”,刘志杰教授说。
这项研究是继去年10月首次发表大麻素受体CB1与拮抗剂复合物的高分辨率三维结构之后的又一重大突破,是GPCR结构功能研究领域的又一项高水平、系统性的研究成果。






