
唐密
1
赵亮
2
杨燕
1
叶子平
3
杜丽侠
4
胡善联
1,5
何江江
1,5
1.上海市卫生和健康发展研究中心
2.拜耳医药保健有限公司
3.沈阳药科大学
4.复旦大学附属华东医院
5.复旦大学公共卫生学院
【
摘要
】
目的
比较中国大陆药物经济学评价指南与其他国家/地区药物经济学评价指南的一致性和差异性,为中国大陆药物经济学评价指南的发展和完善提供有益参考。
方法
使用国际药物经济学与结果研究协会(ISPOR)制定的药物经济学评价指南比较框架对中国大陆与其他国家/地区指南的主要内容进行比较,阐述其异同点。
结果
全球 43 个国家/地区药物经济学评价指南纳入了比较研究,与其他国家/地区的指南相比,中国大陆指南的大多数条目都与全球国家/地区指南一致,存在差异的几个条目主要是指南的类型/制定主体/使用要求、分析方法以及对预算影响分析的要求。
结论
建议未来中国大陆药物经济学评价指南的发展和完善可以从丰富指南的制定主体、强化指南执行力度和预算影响分析的运用、加快药物经济学相关基础研究资料的积累和相关概念的宣讲等方面进行。
【
关键词
】
药物经济学;评价指南;比较研究
药物经济学评价指南(Pharmacoeconomic Evaluation Guidelines)是开展药物经济学研究和评价的工具。指南通过提供统一的框架对研究进行标准化,增加了研究结果的科学性以及研究结果之间的可比性,从而推动药物经济学研究结果应用于卫生决策过程中。自 20 世纪 90 年底以来,全球已有 40 多个国家/地区颁布了药物经济学评价指南(以下简称“国家/地区指南”),并根据指南运行中出现的问题不断更新和完善以更好地指导和规范各个国家/地区药物经济学评价研究
[1]
。2011 年 4 月,中国大陆发布了《中国药物经济学评价指南(2011 年版)》(以下简称“中国大陆指南”),指南运行至今已有 7 年,即将进行修改和调整。因此,笔者旨在对中国大陆指南和其他国家/地区的指南开展比较研究,了解其他国家/地区在药物经济学评价指南方面的具体内容和进展,梳理出中国大陆指南与其他国家/地区指南的异同点并进行讨论,为中国大陆指南的完善提供有益参考。
本研究资料来源于国际药物经济学与结果研究协会(International Society for Pharmacoeconomics and Outcomes Research, ISPOR)网站(www.ispor.org)上公开发表的全球各个国家/地区药物经济学评价指南文件
[1]
。
利用ISPOR网站上的药物经济学评价指南比较表格对中国大陆指南与其他国家/地区指南的主要条目进行比较研究。纳入比较分析的指南条目主要有指南类型、制定主体、指南使用要求、研究角度、对照选择、研究假设、研究时限、纳入成本、效果与功效的选择、首选产出指标、成本和产出贴现率、分析方法、增量分析、建模、是否要求敏感性分析、是否阐述公平性问题、结果的外推性、是否要求预算影响分析、报告格式和经费来源/作者利益披露等。
截至2018年6月30日,从ISPOR网站上共收集到全球44个国家/地区药物经济学评价指南,其中韩国指南未发布英文版本且其药物经济学评价指南比较表格中的内容缺失,最终纳入包括中国大陆在内的43个国家/地区指南。
使用 EXCEL 2010 对 ISPOR 网站上药物经济学评价指南比较表格中的主要指南条目进行统计分析,中国大陆药物经济学评价指南与其他国家/地区指南的比较结果详见表 1。
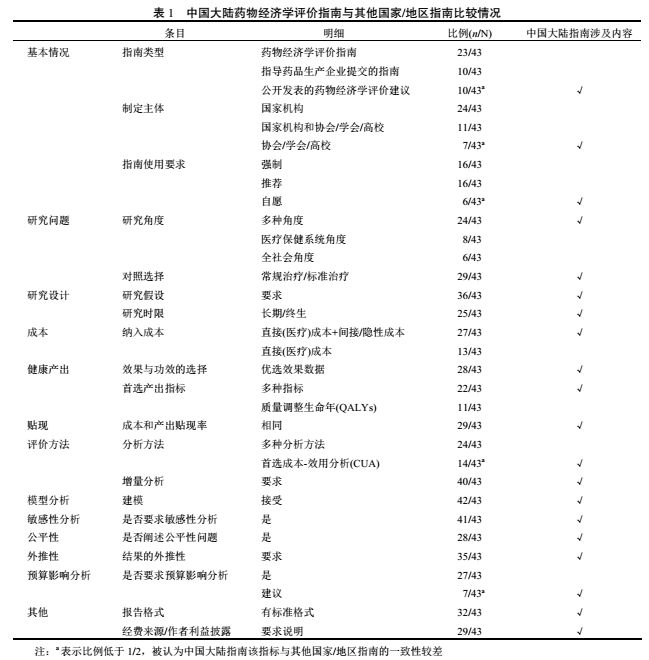
2.1.1 指南类型
通常ISPOR将全球国家/地区指南分为三类:国家或地区正式发表的药物经济学评价指南(PE Guidelines)、有关国家或地区指导制药企业提交审评资料的指南(Submission Guidelines)和公开发表的药物经济学评价建议(Published PE Recommendations)。前两类指南均为国家/地区的官方指南,而公开发表的药物经济学评价建议指南主要用于指导药物经济学研究,不是决策机构纳入药品报销目录时“正式”认可或要求的。中国大陆指南属于该类指南,与其他国家/地区指南的一致性较差(10/43),详见表 2。

2.1.2 作者单位
绝大多数国家/地区指南是由国家机构负责制定(24/43),还有一部分国家/地区指南由国家机构和国内相关协会/学会/高校共同制定,仅有小部分国家/地区指南仅是国内相关协会/学会/高校自发制定(7/43),如中国大陆,与其他国家/地区指南的一致性较差。
2.1.3 指南使用要求
通常有国家机构参与制定的指南使用要求是强制或者推荐执行(32/43),而由相关协会、学会或者高校自发制定的指南主要是自愿执行(6/43)。整体来看,全球国家/地区指南的使用要求呈现出由自愿逐渐转为推荐、强制执行的趋势。如马来西亚国家指南发布的两年内是自愿执行,之后转为强制;埃及指南目前是推荐执行,但未来几年来有望成为强制;苏格兰地区最近更新的指南中将执行要求明确为推荐;中国大陆指南目前是自愿执行,未来几年有望转化为推荐.。
2.2.1 研究角度
不同的研究目的会带来不同的研究角度,因此在药物经济学评价研究中需要对研究角度进行明确。全球多数国家/地区指南中同时提到多种研究角度(24/43),如全社会角度、医疗保健系统角度、雇主角度、医疗提供者角度、患者角度等,部分国家明确了研究角度的优选顺序,如德国指南中指出主要的研究角度是医疗保健系统角度,也可以选择全社会角度。而中国大陆指南中提出最理想的药物经济学研究角度是全社会角度,但也可以选择医疗保健系统、医疗提供者等其他角度。
2.2.2 对照选择
通常来说,对照选择包括常规治疗、标准治疗、最有可能被替代的治疗方案、成本最低的治疗方案、最具成本效果的治疗方案等,并需要充分论证选择对照方案的原因。中国大陆指南与其他国家/地区指南在对照的选择上一致性较好,有超过一半的国家/地区指南选择了常规治疗或标准治疗作为对照(29/43)。
2.3.1 研究假设
研究假设是指对于药物经济学评价研究设计或模型估计中所作的关键假定
[2]
。研究假设会对评价结果产生关键影响,因此全球大多数国家/地区指南包括中国大陆在内都明确要求对研究假设的依据以及合理性进行充分说明(36/43),如比利时指南中提到要尽量减少不是基于临床证据的假设,而德国指南提出要尽量避免基于特定利益相关方的假设,以防止人为地增加治疗效果。
2.3.2 研究时限
全球大多数国家/地区指南(包括中国大陆)都指出研究的时限应该足够长,以能够捕捉到干预和对照带来的主要成本和效果上的相关差异(25/43),其中部分国家/地区指南指出对于慢性疾病或具有长期后遗症的急性病症的治疗来说,研究时限需要囊括患者的整个生命周期,如荷兰、斯洛伐克、西班牙等。
药物经济学研究中成本主要包括直接成本、间接成本和隐性成本三部分,其中直接成本包括直接医疗成本和直接非医疗成本。中国大陆指南与大多数其他国家/地区指南在成本的纳入要求上一致:在纳入直接成本或直接医疗成本的同时也应该考虑将间接成本或隐性成本纳入(27/43),也有部分国家/地区指南仅对直接成本或直接医疗成本进行了要求(13/43)。
2.5.1 效果与功效的选择
效果是指干预措施在自然状态(即非试验的现实条件)下对患者产生的治疗效果,而功效是指干预措施在严格控制的情况(通常为随机临床试验)下对患者产生的治疗效果
[2]
。中国大陆指南与大多数其他国家/地区指南都认为在评价中效果数据优于功效数据(28/43),如果仅有功效数据,应通过模型将功效数据合理转化为效果数据。同时,也存在极少部分国家/地区指南认为效果数据和功效数据均可以接受,如西班牙和奥地利。
2.5.2 首选产出指标
超过一半的国家/地区指南(包括中国大陆)都提到多种产出指标(22/43),如临床效果指标(血压值、血糖值、疾病导致的死亡等)、延长的生命年(life years gained, LYG)、质量调整生命年(quality adjusted life years, QALYs)、节约的货币等。部分指南中提到将 QALYs 作为唯一的产出衡量指标(11/43),并指出最好使用存在基于本国人群的效用值积分体系的量表进行测量,如加拿大、日本等。
全球大多数国家/地区指南所推荐的成本贴现率和产出贴现率保持一致(29/43),如中国大陆指南中成本贴现率和产出贴现率值均推荐采用一年期的国家指导利率或国债利率,但也存在小部分国家/地区指南中采用不同的贴现率,如奥地利推荐的成本贴现率为 5%,产出贴现率为 3%;荷兰推荐的成本贴现率为 4%,产出贴现率为 1.5%;比利时推荐的成本贴现率为 3%,产出贴现率为 1.5%等,成本贴现率均高于产出贴现率。
2.7.1 分析方法
大多数国家/地区指南都提及了多种可选用的分析方法(24/43),如成本-效用分析( cost-utility analysis, CUA )、成本 - 效果分析(cost-effectiveness analysis, CEA)、成本-效益分析( cost-benefit analysis, CBA )、最小成本分析(cost-minimization analysis, CMA)、成本分析(cost analysis, CA)以及成本影响分析(cost-consequences analysis, CCA)等,其种 CUA 和 CEA 被提及最多。另有部分国家/地区明确首选 CUA 或者将 CUA 作为唯一的分析方法(14/43),如中国大陆,CUA 综合考虑了治疗方案对患者生存时间和生存质量的影响,比其他评价方法更为全面。
2.7.2 增量分析
增量分析是药物经济学评价的基本决策原则。除瑞士、丹麦和以色列国家指南没有对增量分析进行说明以外,包括中国大陆指南在内的绝大多数国家/地区指南均明确要求进行增量分析(40/43)。
若现有数据不足以支撑全面评估干预与对照措施的成本和效果,则可以引入模型分析加以辅助。中国大陆指南与其他国家/地区指南在模型分析上的一致性较好,除丹麦指南未对建模问题进行说明以外,其他国家/地区均接受在研究中进行模型分析(42/43)。建立模型时,需要详细介绍模型的假设、模型结构、模型参数以及参数的来源,并评估模型的内外部效度。国家/地区指南提到的常用模型主要有决策树模型、Markov 模型、计量经济学模型、Monte Carlo 模拟等等。
当研究的模型结构、模型假设、数据来源和分析方法等中存在不确定性或者存在对结果有显著影响的参数时,中国大陆指南与绝大多数其他国家/地区指南均要求对其进行敏感性分析(41/43),并根据不确定性产生的原因,选择一种或多种分析方法,如单因素敏感性分析、多因素敏感性分析、概率敏感性分析、阈值分析、极端值分析等等。
公平性是指无论目标群体的年龄、性别或社会经济地位如何,一项干预活动所影响到的所有生命、生命年或质量调整生命年的价值都(假设)是相等的
[2]
。包括中国大陆在内的大多数国家/地区指南中阐述了公平性问题(28/43)。
中国大陆指南与其他国家/地区指南在外推性上的一致性较好,均对研究结果的外推性提出了要求(35/43)。即在研究中所选用的成本、效果以及研究的评价结果应该适用于本国情况,若研究相关数据来自于其他国家/地区,应根据本国的情况调整数据,并证明其适用性。
预算影响分析通过测算新干预措施对国家卫生预算产生的影响以辅助决策。大多数国家/地区指南都要求进行预算影响分析(27/43),其中澳大利亚要求的分析年限最长(6 年),除意大利要求 1~2 年外,其他国家要求分析年限多在 3~5 年之间。部分国家/地区指南则提到在相关数据可获得的情况下,建议进行预算影响分析,如中国大陆。
2.13.1 报告格式
标准的报告格式有利于研究具备一致性和可比性,更便于决策者做出决策。包括中国大陆在内的大多数国家/地区指南中都给出了标准报告格式(32/43),有部分国家/地区指南虽然未明确定义报告的标准格式,但也在指南中制定了研究中主要分析部分的参考案例,如爱尔兰、英格兰和威尔士地区等。
2.13.2 经费来源/作者利益披露
中国大陆指南与大多数其他国家/地区指南都要求对有关研究经费来源和作者的利益冲突问题进行说明(29/43),有少数国家指南中未对经费来源和作者利益披露做出明确要求,但在正式报销申请提交材料时要求对其进行说明,如匈牙利。
通过对中国大陆与其他 42 个国家/地区指南主要条目的比较分析可以发现,中国大陆指南的大多数条目都与其他国家/地区指南保持一致,存在差异的几个条目主要是指南的类型/制定主体/使用要求、分析方法以及对预算影响分析的要求,以下分别对其进行讨论。














