2019年3月,共有11个中国1类化药获得国家药品监督管理局(NMPA)的临床默示许可,其中2个为特殊审批品种。
具体信息如下表所示:

WXFL50010210由青岛黄海制药有限责任公司研发,拟用于治疗非酒精性脂肪肝病(NAFLD)和非酒精性脂肪肝炎(NASH)。
2017年7月,CDE受理本品的临床试验申请(化药1类),并于该月(2017年7月)要求进一步补充资料。
2019年3月,获得临床默示许可,且属于特殊审批。
QBH-196由沈阳药科大学研发,是以卡博替尼为先导化合物设计的一种包括c-Met在内的多靶点受体酪氨酸激酶抑制剂,拟用于治疗胃癌。
2018年7月,CDE受理沈阳药科大学提交的临床试验申请(化药1类)。
2019年3月获得临床默示许可。
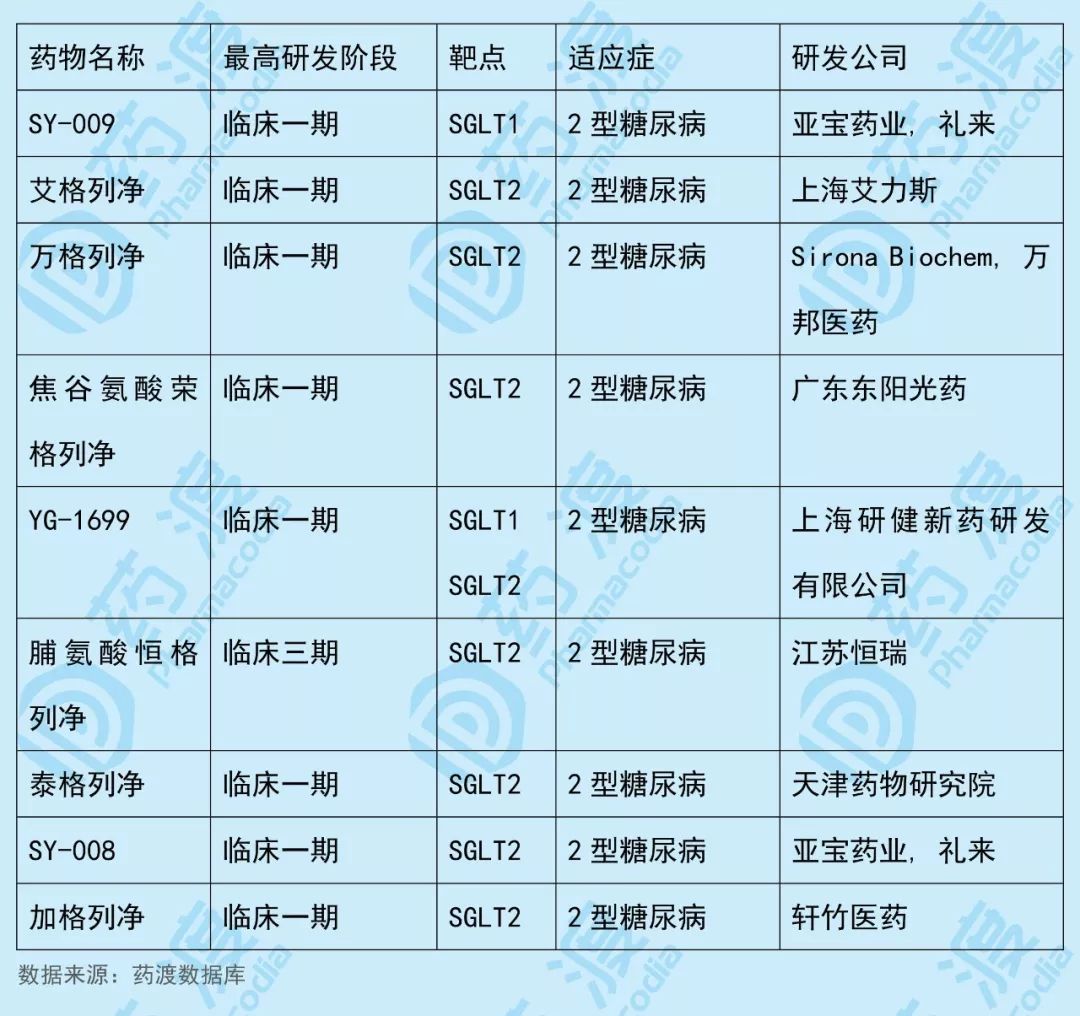
YG-1699是上海研健开发的一种钠-葡萄糖协同转运蛋白1/钠-葡萄糖协同转运蛋白2(SGLT1 / SGLT2)双重抑制剂,拟用于治疗糖尿病。
目前在澳大利亚开展临床一期试验。
据表明,YG1699在成药性方面具有明显优势,与已经上市的列净类药物相比,YG1699拥有更多有效的降糖机制,能够减轻列净类药物的主要毒副作用,且可能的适应人群和适应症更广。
研发里程碑
2019年3月,拟用于治疗糖尿病的申请获得临床默示许可。
2019年2月,YG1699获FDA临床试验许可,将开展临床I期试验。
2018年12月,国家药品监督管理局(NMPA)受理本品的临床试验申请(化药1类)。
该药物中国1类同靶点SGLT(钠-葡萄糖协同转运蛋白)药物如下表所示:
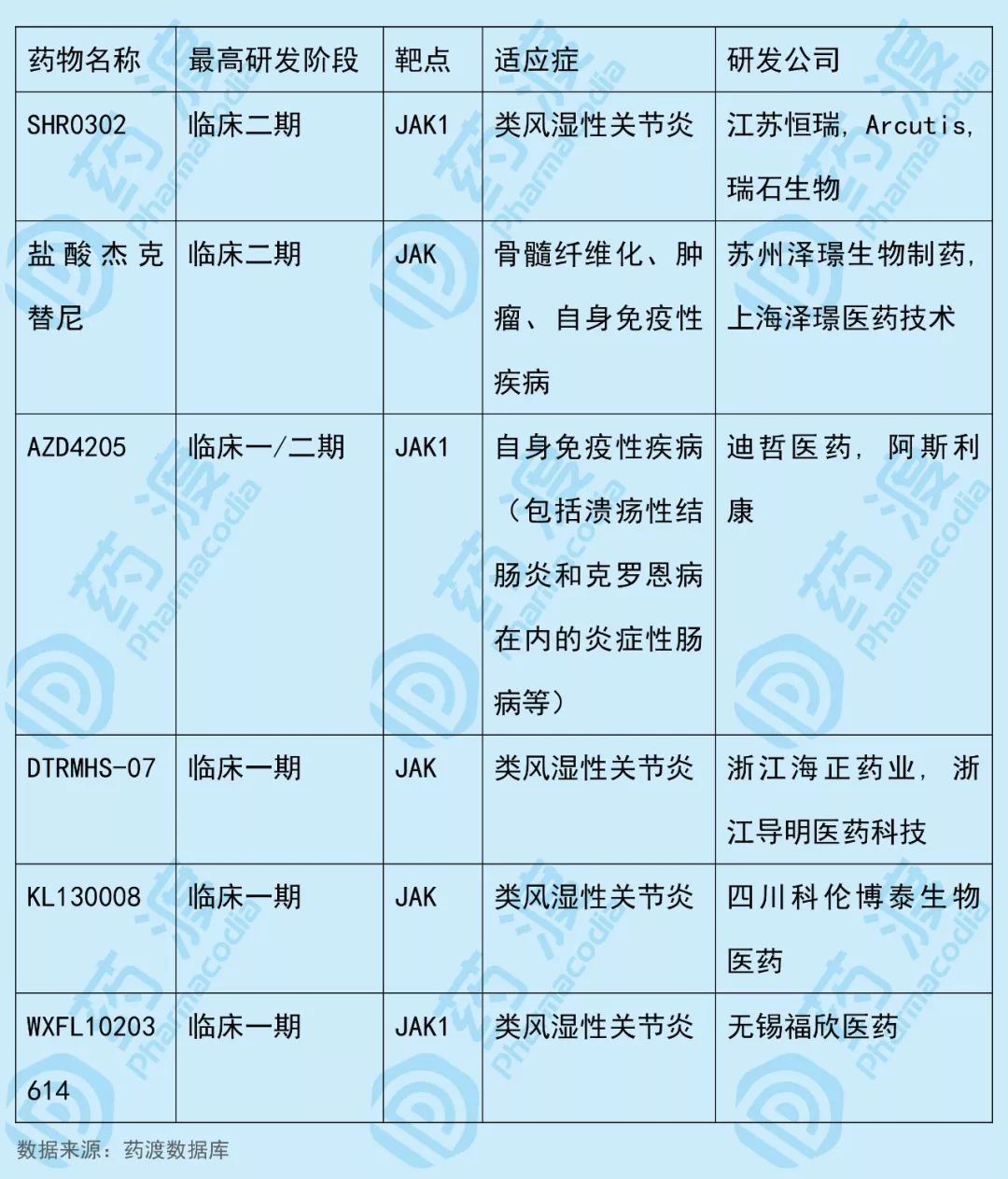
AZD4205是由阿斯利康和迪哲(江苏)医药有限公司(阿斯利康和中国国投创新联合投资创立的公司)联合开发的一种JAK1激酶抑制剂,目前阿斯利康正在进行用于治疗非小细胞肺癌的临床一/二期试验。
2018年12月,国家药品监督管理局(NMPA)受理迪哲(江苏)医药有限公司提交的临床试验申请(化药1类)。
2019年3月,获得临床默示许可,拟用于治疗自身免疫性疾病(包括溃疡性结肠炎和克罗恩病在内的炎症性肠病等)。
该药物中国1类同靶点JAK(酪氨酸蛋白激酶JAK)药物如下表所示:
HEC113995PA·H2O由广东东阳光药业有限公司研发,拟用于治疗抑郁症。
2019年1月国家药品监督管理局(NMPA)受理本品的临床试验申请(化药1类)。
2019年3月获得临床默示许可。
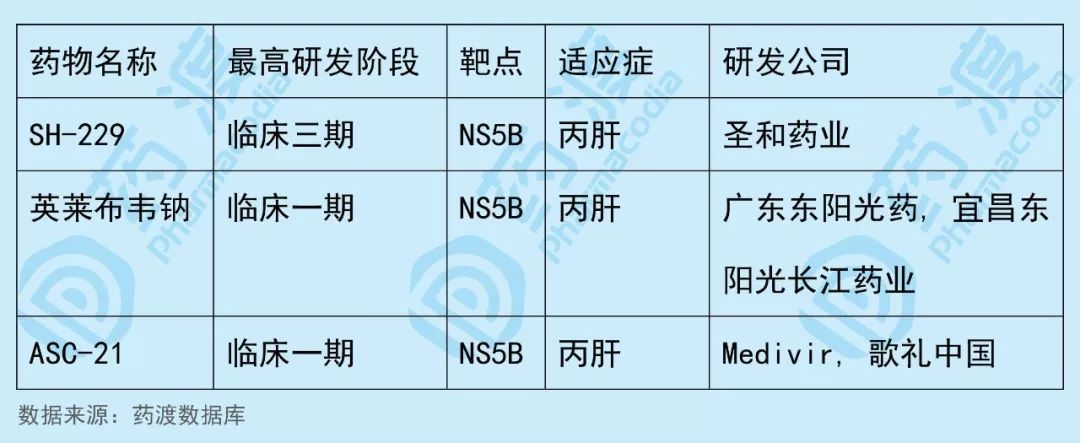
ASC-21(MIV-802)是一种丙型肝炎病毒NS5B RNA依赖的RNA聚合酶抑制剂,最初由Medivir AB研发,2017年歌礼收购其大中华地区的知识产权,歌礼开始负责该药的临床开发、生产和商业化并独家拥有ASC-21大中华地区所有权益。
2019年1月,ASC-21的临床试验申请(化药1类)获国家药品监督管理局(NMPA)受理,并于2019年3月获得默示许可,拟开展针对成人慢性丙型肝炎的研究,不得作为单药治疗。
该药物中国1类同靶点NS5B药物如下表所示:
BPI-23314是一种拟用于治疗癌症的溴结构域和超末端结构蛋白(BET)家族抑制剂,由贝达药业研发。
2019年1月,在中国的IND申请(1类化药)获CDE受理,并于2019年3月获得临床默示许可,拟开展针对恶性血液系统肿瘤(急性髓系白血病、非霍奇金淋巴瘤和多发性骨髓瘤)的研究。
CS3003是基石药业研发的组蛋白去乙酰化酶-6(HDAC6)抑制剂,拟用于治疗晚期实体瘤和复发或难治性多发性骨髓瘤。
2019年1月,在中国的IND申请获得CDE受理(1类化药)。
2019年3月,IND申请获得NMPA临床试验默认许可,拟开展针对晚期实体瘤和复发或难治性多发性骨髓瘤的临床I期研究,将在中国和澳大利亚同步进行。
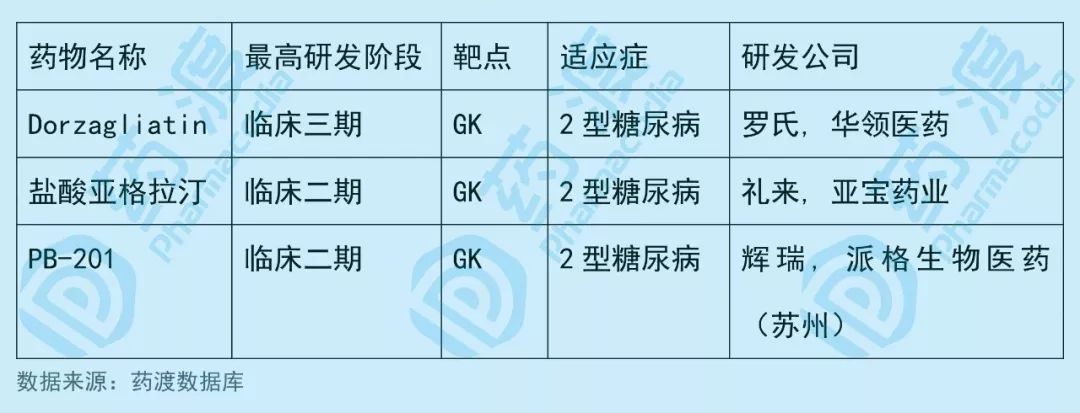
PB-201由辉瑞公司研发,曾经处于临床二期,用于治疗2型糖尿病。
虽然辉瑞已经终止了该项目的研究,但是在2016年12月该药物被授权给派格生物医药(苏州)。
2019年1月,派格生物医药提交的临床试验申请(化药1类)获NMPA受理,并于2019年3月获得临床默示许可。
该药物中国1类同靶点GK(葡萄糖激酶)药物如下表所示:
ZSP0678由广东众生药业研发,拟用于治疗非酒精性脂肪性肝炎(NASH)。
2019年1月,国家药品监督管理局(NMPA)受理广东众生药业股份有限公司提交的临床试验申请(化药1类)。
2019年3月获得临床默示许可。
WXSH0081由石家庄智康弘仁新药开发有限公司研发,拟用于治疗炎症性肠病。
2019年1月,国家药品监督管理局(NMPA)受理本品的临床试验申请(化药1类)。
2019年3月获得临床默示许可。
2019年3月,共有6个中国1类生物药获得NMPA的临床默示许可,其中2个为特殊审批品种。
具体信息如下表所示:
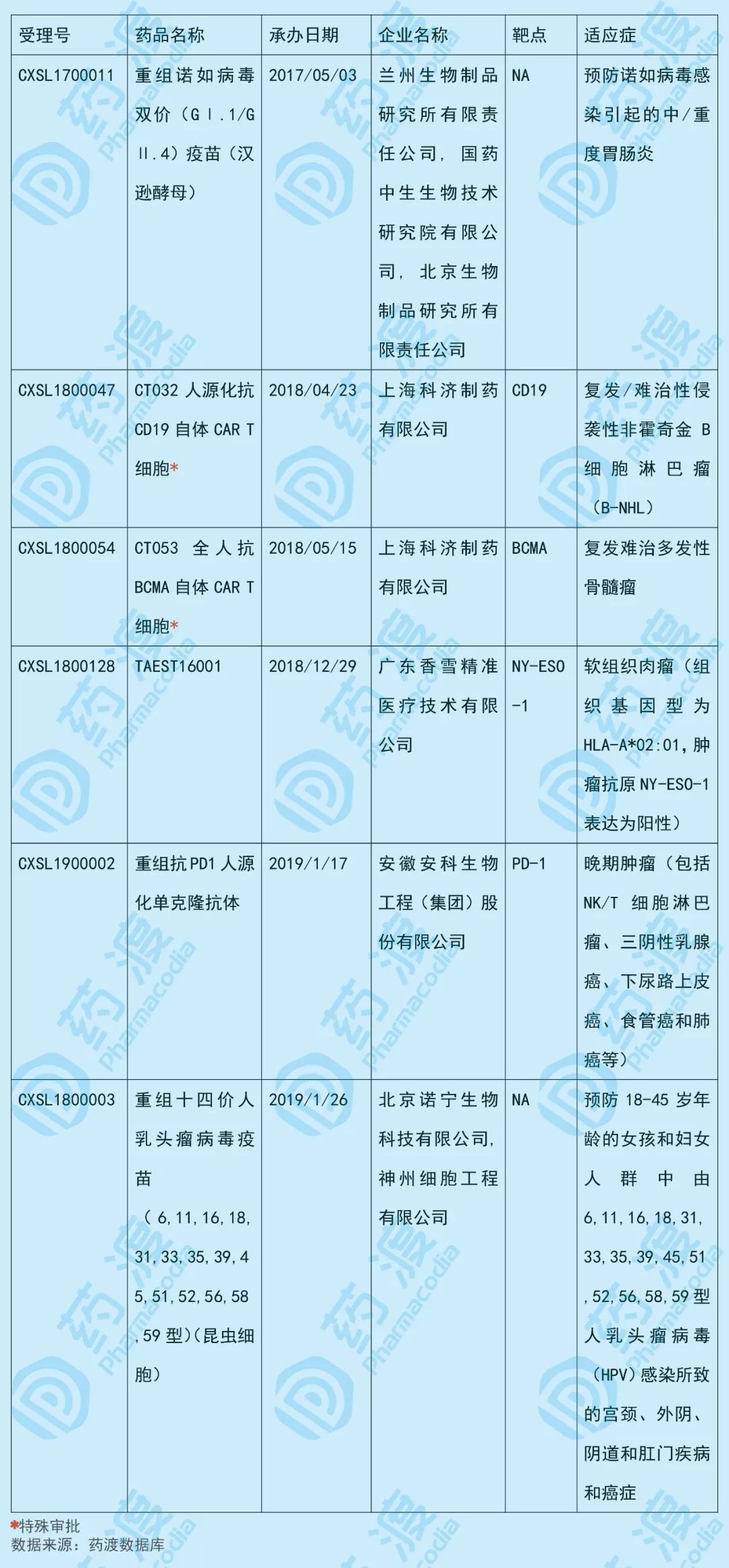
1.重组诺如病毒双价(GⅠ.1/GⅡ.4)疫苗(汉逊酵母)
重组诺如病毒双价(GⅠ.1/GⅡ.4)疫苗(汉逊酵母)由兰州生物制品研究所(Lanzhou Institute of Biological Products)、国药中生生物技术研究院(China national biotec)和北京生物制品研究所(National vaccine and serum institute)联合研发,2017年5月该产品的新药临床试验(IND)申请(预防用生物制品1类)获CDE受理。
2019年3月获得临床默示许可,拟用于预防诺如病毒感染引起的中/重度胃肠炎。
CT032人源化抗CD19自体CAR T细胞由上海科济生物研发,目前处于临床一期研究阶段,用于治疗CD19阳性恶性B细胞性白血病和淋巴瘤。
研发里程碑
2019年3月,该药物用于治疗复发/难治性侵袭性非霍奇金B细胞淋巴瘤(B-NHL)的申请获NMPA默认许可临床试验。
2018年4月,该药的新药临床试验(IND)申请(治疗用生物制品1类)获CDE受理。
2016年11月,开放标签、单组分配临床I期试验(NCT02933775)在中国启动,针对CD19阳性恶性B细胞性白血病和淋巴瘤,当时预计将于2020年1月完成,初步结果于2018年EHA会议公布。
临床结果
对R/R B-cell NHL的I期临床初步结果于2018年EHA会议公布。
截止至2018年3月,该研究共入组3名患者,其中1名诊断为MCL,2名诊断为DLBCL,在CAR-T细胞输注一个月之后,PET-CT或者CT扫描显示,所有患者病情均出现缓解,其中1例为CR,未观察到细胞因子释放综合征,而主要不良事件为中性粒细胞减少(II级)和淋巴细胞减少症(III至IV级)
1
。
融资及交易
2018年4月,科济生物完成6000万美元的Pre-C轮融资,本轮融资由光量资本领投。
2016年1月,科济生物获得3300万元B轮融资,投资方为凯泰资本。
2014年11月,科济生物完成A轮1000万人民币融资,由百奥财富领投。
参考
1.THE EFFICACY AND SAFETY OF HUMANIZED CD19 CAR-T CELLS FOR RELAPSED OR REFRACTORY B-CELL NON-HODGKIN LYMPHOMA (NHL):
A PRELIMINARY REPORT, EHA Learning Center. Huang H.Jun 15, 2018 (Abstract:
PF402).
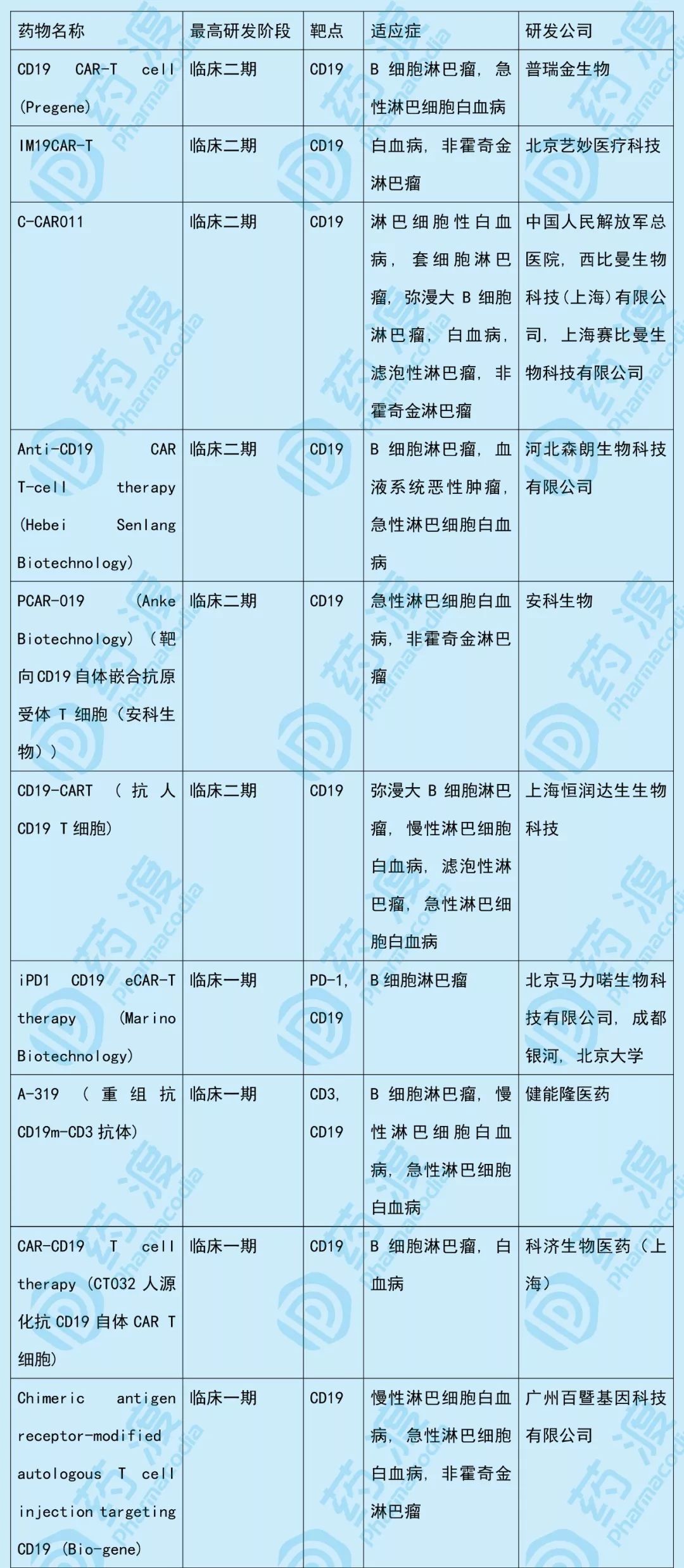
该药物同靶点(CD19)中国1类新药如下表所示:
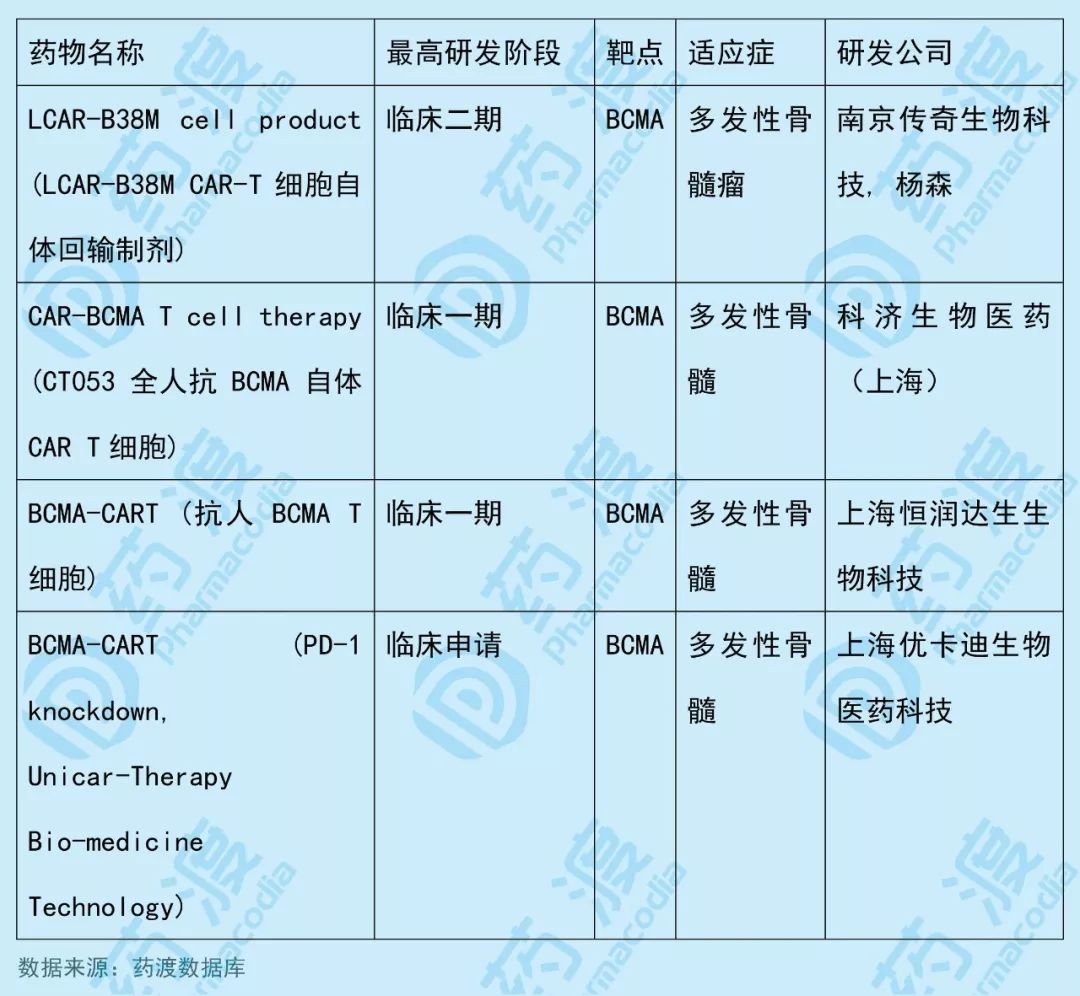
科济生物开发的CT053全人抗BCMA自体CAR T细胞目前已进入临床研究阶段,主要用于治疗难治性或复发性多发性骨髓瘤(MM)。
研发里程碑
2018年5月,该产品的新药临床试验(IND)申请(治疗用生物制品1类)获CDE受理,并于2019年3月获得临床默示许可。
2017年12月,对复发/难治性MM的开放标签、单臂、试点I期研究(NCT03716856)在中国启动,当时预计将于2020年8月完成。
2017年10月,针对复发/难治性MM的单臂、开放标签、试点研究(NCT03380039)在中国启动。
临床结果
2018年12月,BCMA CAR-T细胞治疗复发/难治多发性骨髓瘤(R/R MM)的安全性和有效性临床研究初步结果于ASH公布。
截止2018年7月12日,该研究共有17例R/R MM受试者接受单剂CT053输注,细胞剂量范围为0.5-1.8x10
8
,输注后观察期为10-272天(中位92天),14例受试者获得至少4周的有效性评价。
所有受试者在接受CT053单次注射后1-3天均在外周血检测到CAR-T细胞扩增,14例有效性评价的受试者在CT053输注后2-4周后至少达到部分缓解及以上疗效,总缓解率(ORR)达到100%,非常好的部分缓解(VGPR)及完全缓解(CR/sCR)的比例为78.6%。
安全性数据显示,所有患者均能耐受该治疗,有5例受试者发生细胞因子释放综合征(CRS),包括4例2级,1例3级,于细胞输注后第1-13天内发生,使用托珠单抗等治疗后均于3-6天内症状缓解
1
。
融资及交易
2018年4月,科济生物完成6000万美元的Pre-C轮融资,由光量资本领投。
2016年1月,科济生物获得3300万元B轮融资,投资方为凯泰资本。
2014年11月,科济生物完成A轮1000万人民币融资,由百奥财富领投。
参考
1. CARsgen Presents Preliminary Results of CAR-BCMAT Cell Therapy at ASH 2018, PR Newswire, 2018/12/4.
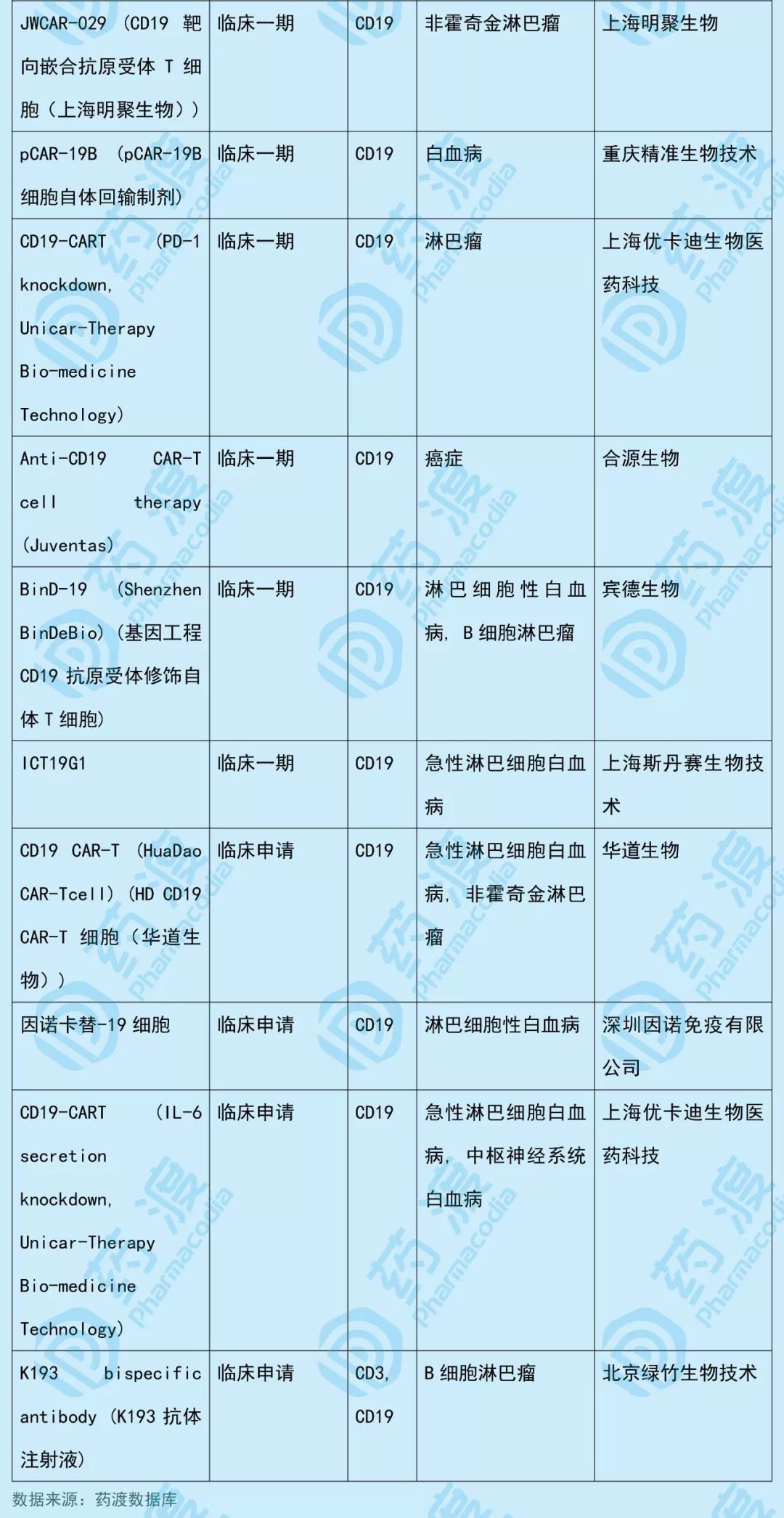
该药物同靶点BCMA(B细胞成熟蛋白)中国1类新药如下表所示: