
结直肠癌是严重危害全球的公共健康难题,发病率和死亡率均位居癌症前三[1]。近年来研究发现,结直肠癌的发生发展与肿瘤免疫逃逸密切相关,然而,相关具体机制尚未彻底阐明。
肿瘤细胞往往通过营造独特的肿瘤微环境来逃避免疫[2]。在肿瘤微环境中,巨噬细胞是最丰富的免疫细胞,而且能随肿瘤微环境的变化而改变,极化为M1表型或M2表型。其中,M2表型的巨噬细胞能抑制局部免疫,促进肿瘤免疫逃逸和进展[3]。
近日,江南大学医学院黄朝晖教授和复旦大学黄胜林团队,针对肠癌细胞利用巨噬细胞免疫逃逸的机制,在国际顶尖医学期刊Advanced Science上发表重要研究成果[4]。

官网论文首页截图
他们发现,肠癌细胞能分泌小细胞外囊泡,囊泡内的miR-21-5p和miR-200a通过PTEN/AKT和SCOS1/STAT1途径,诱导肿瘤相关巨噬细胞发生M2样极化,上调PD-L1表达,进而导致CD8+T细胞活性下降,实现免疫逃逸和肿瘤生长。
首先,研究人员分析了肠癌临床样本,发现越靠近癌症组织中心,M2样巨噬细胞的密度也就越高。体外实验共培养巨噬细胞和肠癌细胞后,巨噬细胞极化为M2表型。这提示巨噬细胞在浸润肠癌组织的过程中发生了表型转变。
随后进一步的生信分析发现,随肠癌病情的进展,发生M2极化的肿瘤相关巨噬细胞比例升高,免疫抑制信号通路富集,PD-L1表达水平上调。生存分析发现,M2样巨噬细胞的PD-L1表达和肠癌预后不良显著相关。
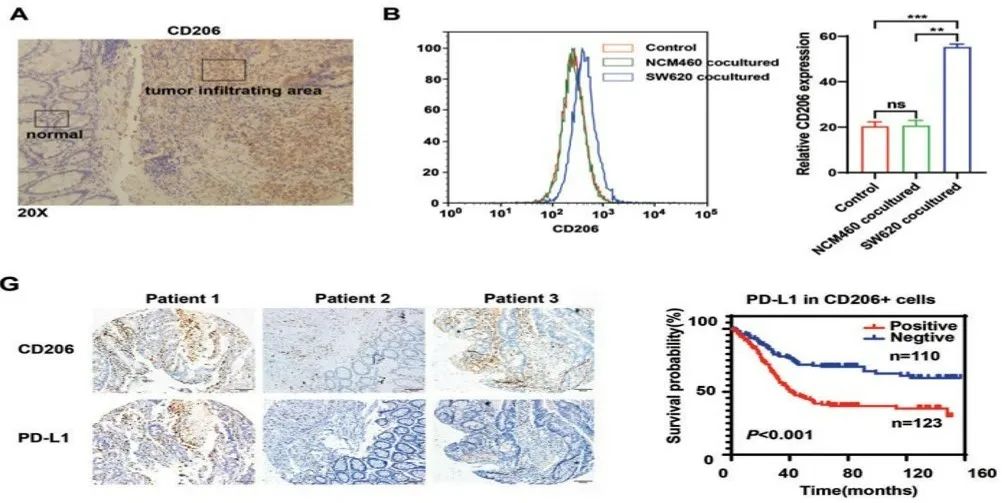
图A:M2样巨噬细胞的密度在肠癌组织中心远高于在组织边缘(CD206为巨噬细胞M2极化的标志物);图B:与正常肠上皮细胞(NCM460)共培养相比,和肠癌细胞(SW620)共培养的巨噬细胞呈现M2样改变;图G:M2样巨噬细胞PD-L1表达阳性的肠癌患者预后不良
PD-L1作为PD-1的配体,能与T细胞的PD-1结合,诱导T细胞失能和凋亡,进而抑制肿瘤抗原特异性CD8+T细胞的激活、增殖和抗肿瘤功能[5]。
那么,在肠癌中,巨噬细胞发生M2极化后,是否是通过表达PD-L1来抑制CD8+T细胞,进而发挥免疫抑制作用?
研究人员把巨噬细胞经肠癌细胞共培养处理后,再与淋巴细胞共培养,发现巨噬细胞PD-L1表达上调,CD8+T细胞比例下降,而在共培养过程中添加抗PD-L1抗体则能抑制CD8+T细胞比例的降低。此外,在肠癌病理组织中,PD-L1+M2样巨噬细胞浸润得越多,CD8+T细胞的比例就越低。
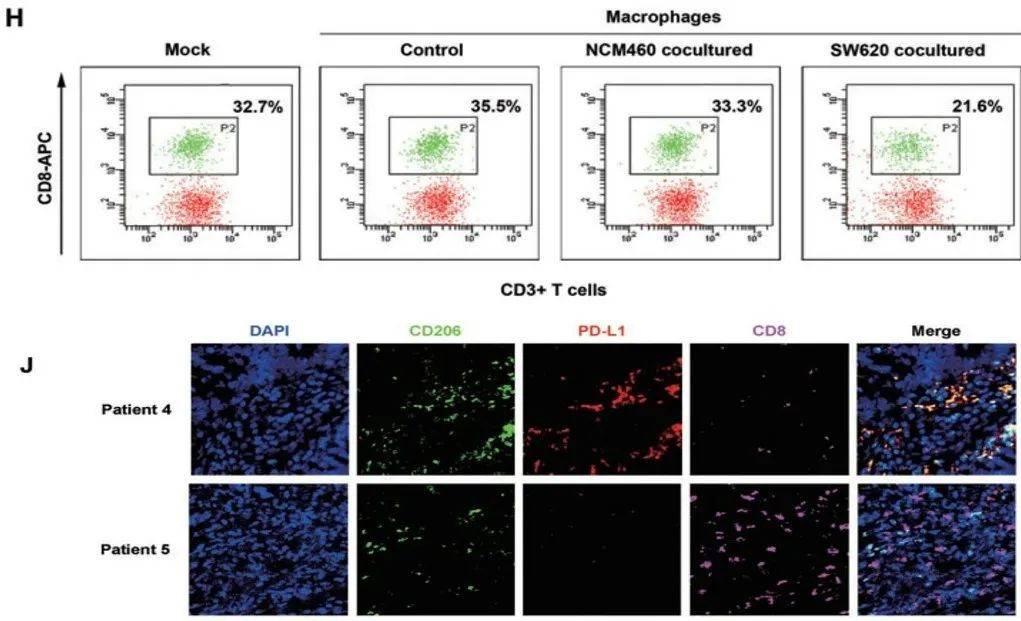
图H:巨噬细胞经肠癌细胞共培养处理后,再与淋巴细胞共培养,能降低CD8+T细胞比例;图J:肠癌组织中,PD-L1+M2样巨噬细胞和CD8+T细胞的比例呈反比
这些结果表明,肠癌细胞能诱导巨噬细胞发生M2极化,表达PD-L1,抑制CD8+ T细胞。
但是,肠癌细胞又是通过何种途径来诱导巨噬细胞呢?
小细胞外囊泡是细胞分泌的直径为30-150纳米的细胞外囊泡,是细胞间信号传导的重要载体[6]。之前的研究发现肿瘤细胞外囊泡和免疫逃逸关系密切,据此,研究人员推测,肠癌细胞通过分泌小细胞外囊泡来调控巨噬细胞,以逃逸免疫。
随后,研究人员进行了实验,验证了假说。在体外共培养实验中,巨噬细胞经肠癌细胞来源的小细胞外囊泡共培养处理后,表现出M2样表型,PD-L1表达增加,再与淋巴细胞共培养,能降低CD8+T细胞的比例;在体内实验中,小鼠经注射肠癌细胞来源的小细胞外囊泡后,体内巨噬细胞的PD-L1表达上调。
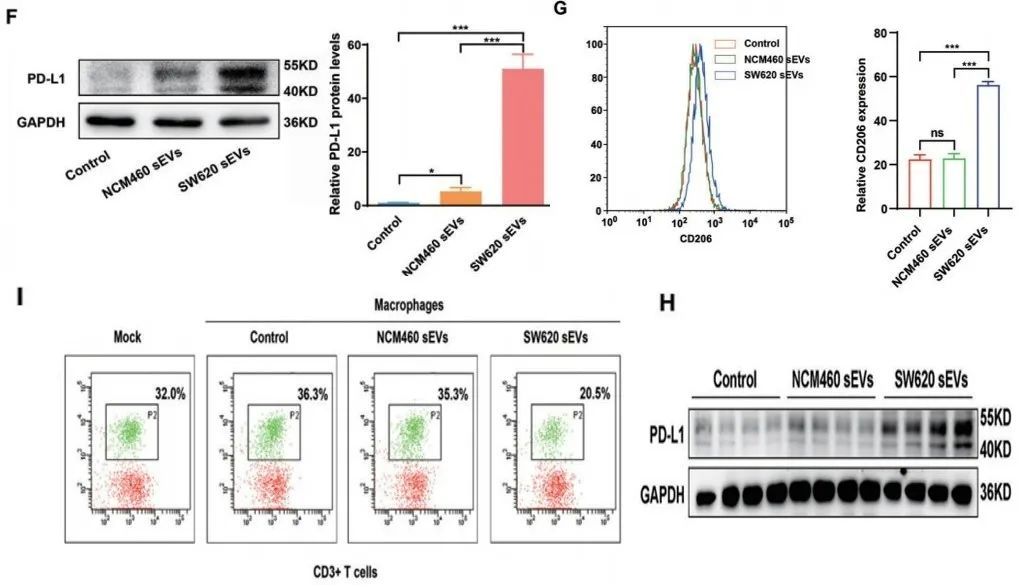
巨噬细胞经肠癌细胞来源的小细胞外囊泡(sEVs)共培养处理后,图F:PD-L1表达增加;图G:表现出M2样表型;图I:与淋巴细胞共培养,能降低CD8+T细胞的比例。图H:肠癌来源的sEVs注射至小鼠,体内巨噬细胞中PD-L1的表达上调
小细胞外囊泡携带复杂的生物分子,包括蛋白质、脂质和核酸。其中,miRNA被认为是最重要的信号分子之一。研究人员又大胆推测,肠癌细胞分泌的小细胞外囊泡对巨噬细胞的调控作用,是通过囊泡内的miRNA来介导的。
研究人员对肠癌来源小细胞外囊泡内的miRNA进行了筛选。在肠癌细胞系和肠癌患者中,有四种miRNA显著富集,将它们分别转染至巨噬细胞,只有miR-21-5p和miR-200a能使巨噬细胞发生M2极化,上调PD-L1表达。
为了进一步验证这两种miRNA对巨噬细胞的影响,研究人员进行了功能缺失实验。肠癌细胞经过miR-21-5p和miR-200a敲除后,与巨噬细胞共培养,发现巨噬细胞M2表型减弱,PD-L1表达下调,再与淋巴细胞共培养,则CD8+T细胞的比例增加,功能增强。
最后,研究人员又在体内验证了两种miRNA的功能。小鼠成瘤实验的结果显示,注射miR-21-5p和(或)miR-200a的小鼠,肿瘤生长得更大,组织中PD-L1+巨噬细胞更多,CD8+T细胞更少。
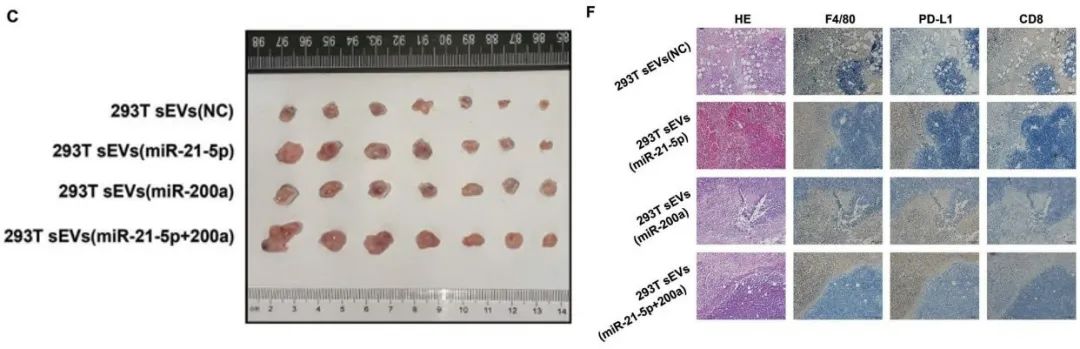
注射miR-21-5p和(或)miR-200a的小鼠,肿瘤生长得更大(图C),组织中PD-L1+巨噬细胞更多,CD8+T细胞更少(图F)
这些数据表明,肠癌细胞分泌的小细胞外囊泡内的miR-21-5p和miR-200a,能诱导巨噬细胞PD-L1表达和M2极化,导致CD8+T细胞活性下降,促进肠癌的发生发展。
那么,miR-21-5p和miR-200a,又是作用于什么信号通路来发挥作用的呢?
生信分析发现,PTEN是miR-21-5p和miR-200a的潜在靶点,SOCS1是miR-21-5p的潜在靶点。实验验证,miR-21-5p能显著抑制PTEN和SOCS1的表达,增加巨噬细胞中p-AKT和p-STAT1的表达,miR-200a能明显抑制PTEN的表达,使巨噬细胞中的p-AKT表达上调。敲除PTEN和SOCS1都能诱导巨噬细胞发生M2极化,降低CD8+T细胞比例。
至此,机制揭示清晰,肠癌细胞分泌小细胞外囊泡,囊泡内的miR-21-5p和miR-200a,通过PTEN/AKT和SCOC1/STAT1途径,协同诱导PD-L1在巨噬细胞中的表达,从而抑制CD8+T细胞功能。
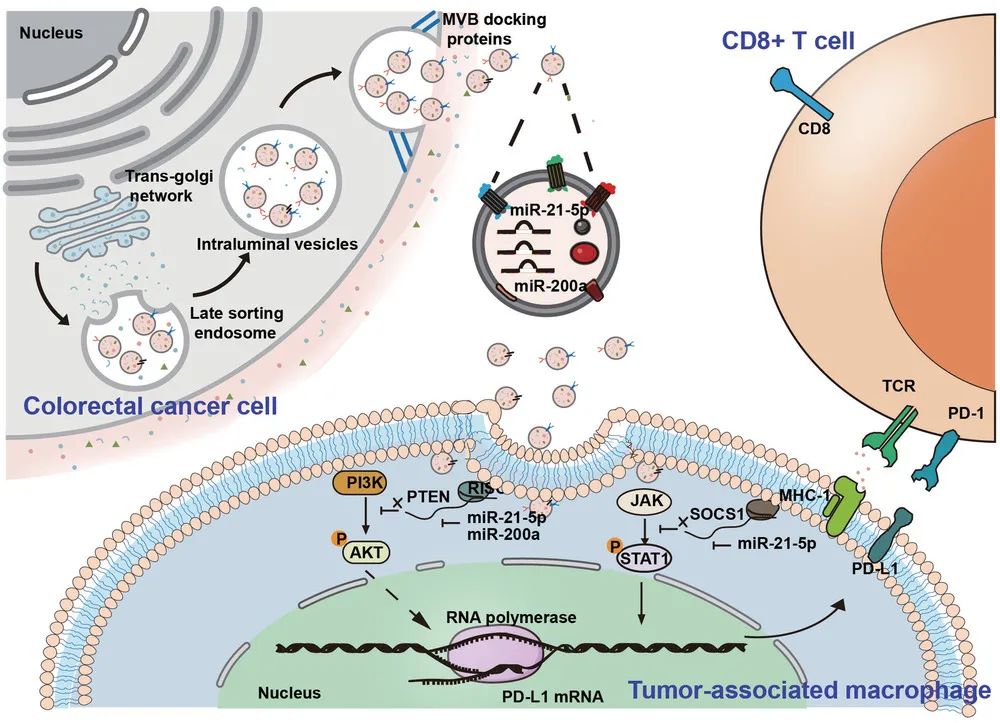
本研究机制示意图
综上所述,黄朝晖教授团队从肠癌的临床病理特点出发,从肿瘤微环境的角度入手,通过丝丝入扣的实验,层层深入地揭示了肠癌细胞的免疫逃逸新机制,为肠癌的免疫治疗提供了一个新思路。从研究方法上看,本研究是一则优秀的“from bedside to bench”研究范例;从研究结果上看,阻断肿瘤相关巨噬细胞中的PD-L1信号,有望成为肠癌治疗的一个新方向。

参考文献
[1] Fitzgerald RC, di Pietro M, O'Donovan M, et al. Cytosponge-trefoil factor 3 versus usual care to identify Barrett's oesophagus in a primary care setting: a multicentre, pragmatic, randomised controlled trial. Lancet. 2020;396(10247):333-344. doi:10.1016/S0140-6736(20)31099-0
[2] Pancione M, Giordano G, Remo A, et al. Immune escape mechanisms in colorectal cancer pathogenesis and liver metastasis. J Immunol Res. 2014;2014:686879. doi:10.1155/2014/686879
[3] Duan Z, Luo Y. Targeting macrophages in cancer immunotherapy. Signal Transduct Target Ther. 2021;6(1):127. Published 2021 Mar 26. doi:10.1038/s41392-021-00506-6
[4] Yin Y, Liu B, Cao Y, et al. Colorectal Cancer-Derived Small Extracellular Vesicles Promote Tumor Immune Evasion by Upregulating PD-L1 Expression in Tumor-Associated Macrophages [published online ahead of print, 2022 Jan 17]. Adv Sci (Weinh). 2022;e2102620. doi:10.1002/advs.202102620
[5] O'Malley G, Treacy O, Lynch K, et al. Stromal Cell PD-L1 Inhibits CD8+ T-cell Antitumor Immune Responses and Promotes Colon Cancer. Cancer Immunol Res. 2018;6(11):1426-1441. doi:10.1158/2326-6066.CIR-17-0443
[6] Kalluri R, LeBleu VS. The biology, function, and biomedical applications of exosomes. Science. 2020 Feb 7;367(6478):eaau6977.

责任编辑丨应雨妍















