
“华兴资本医疗与生命科技行业周报”定期发布,专注从资本角度,解读一周数据,提供最新行业观察。
医疗与生命科技是华兴资本多年来关注并深耕的领域,目前已为超过100个融资及并购项目担任财务顾问。
医疗与生命科技行业创新不断涌现,已经发展成为最活跃的行业之一,华兴资本始终支持、陪伴这一领域创业企业成长,致力为行业带来理性专业的声音。
关注华兴资本微信公众号(ID:iChinaRenaissance),后台点击“兴观点”-“行业观察”-“生命科技”,获取更多医疗与生命科技行业相关信息。
12月4日,艾力斯医药正式在上海证券交易所科创板挂牌上市。此次公开发行股票数量为9,000万股,发行价格为22.73元/股,募集资金总额为20.46亿元人民币,市值已达到186亿元人民币。
艾力斯致力于非小细胞肺癌疾病的研究。即将在中国获批上市的艾弗沙(甲磺酸伏美替尼),是艾力斯独立研发并拥有自主知识产权的第二个国家1.1类新药,其临床研究获得国家“重大新药创制”专项的特别支持。
12月1日,派格生物宣布,完成近8亿元人民币pre-IPO轮融资,并已启动科创板上市准备工作。本轮融资由云锋基金,盈科资本和泰福资本领投,前海母基金,元生创投,中鑫资本和园丰资本跟投。
派格生物是一家临床阶段的,专注于慢病新药研发的生物技术公司。已在II型糖尿病、非酒精性脂肪肝、痛风、便秘和心血管等领域充分布局,形成了一系列既能单用,又能进行联合用药的产品管线。
近日,英派药业宣布,完成5,000万美元C+轮融资。本轮融资由君实生物领投,新投资方安捷资管、贞吉资本、深创投中美基金、奥翔药业投资,老股东礼来亚洲基金、华岭资本继续跟投。
英派药业致力于研发具有自主知识产权的靶向抗癌新药,专注于合成致死作用机制。以DNA损伤修复通路自主研发平台为基础,构建了全球新兴生物技术公司中覆盖面最广的DDR产品组合,并且正在逐步拓展到更多的全新的合成致死靶点。目前所有品种均为自主研发,公司拥有全球权益。
12月4日,BioAge Labs宣布,超额完成9,000万美元C轮融资。本轮融资由Andreessen Horowitz和Elad Gil共同领投,Kaiser Foundation Hospitals、AARP Foundation和Phi-X Capital跟投。
BioAge Labs致力于利用人工智能开发衰老疾病药物。BioAge平台利用人工智能挖掘与衰老疾病相关的药物靶点,采用45年前采集的血液样本搜集患者组学数据,探索详细的健康线路、寿命和疾病结果。其领头产品BGE-117是缺氧诱导因子脯氨酰羟化酶抑制剂,可以通过激活HIF-1目标基因来治疗多种衰老疾病。

12月1日,Church&Dwight以5.3亿美元收购ZICAM™持有公司Matrixx Initiatives。此次收购以现金和债务相结合的方式进行对Matrixx Initiatives股票收购。
Matrixx Initiatives的ZICAM™是美国维生素、矿物质和补充剂中的头号锌补充剂。Zicam预计2021年的年净销售额约为9,000万美元,EBITDA预计约为3,600万美
元。

1.
Moderna3个月试验数据增加人们对COVID-19疫苗耐用性的希望
2.
英国政府批准辉瑞新冠疫苗的使用

Moderna3个月试验数据增加人们对COVID-19疫苗耐用性的希望
12月4日,在给《新英格兰医学杂志》的一封信中,美国国家过敏和传染病研究所和其他研究中心的科学家提供了34名在早期试验中接受100μg剂量的mRNA-1273的最新数据。研究人员追踪了第二次给药后90天内,结合抗体和中和抗体水平略有下降。然而,这两种抗体的几何平均滴度仍高于41名恢复期COVID-19患者的中位数。从诊断供者到康复小组的中间时间是34天。数据显示,mRNA-1273有可能提供持久的体液免疫。《新英格兰医学杂志》的最新报道也提到了疫苗的安全性。在小规模试验中没有发现严重的不良事件,并且在第57天之后没有新的被认为与疫苗有关的不良事件发生。Moderna预计到今年年底在美国提供大约2,000万剂。
信息来源:f
i
ercebiotech.com
英国政府批准辉瑞新冠疫苗的使用
12月3日,英国卫生和社会保健部的一位发言人宣布,英国政府接受了独立药品和保健品管理局的建议,批准辉瑞/BioNTech的Covid-19疫苗投入使用。疫苗将从下周开始在英国全国推广。预计12月或明年1月开始接种。
信息来源:nzherald.co.nz

药品网售新规公开征求意见:电子处方应确保来源可靠
近日,国家药监局公布《药品网络销售监督管理办法(征求意见稿)》,面向社会征求意见。征求意见稿明确,药品网络销售者应是药品上市许可持有人或者药品经营企业。中药饮片生产企业销售其生产的中药饮片,应当履行本办法规定的持有人相关义务。药品网络销售不得超出企业经营方式和药品经营范围。药品网络销售者为持有人的,仅能销售其持有批准文号的药品。药品零售企业应履行建立药品网络销售安全管理制度,实现药品销售全程可追溯、可核查,建立并实施保障药品质量与安全的配送管理制度等。允许药品网络销售者通过自建网站、网络客户端应用程序、第三方平台或者以其他形式依托相关网络服务商自建网上店铺开展药品网络销售。
信息来源:HC3i中数新医

1.
安进CD19/CD3双特异性抗体新药正式在中国获批
2.
强生EGFR/c-Met双抗凭I期数据申请上市
3. 亚盛医药MDM2-p53抑制剂联合Bcl-2抑制剂2a期临床研究在中美两国获批
4. 美敦力的术中神经系统NIM Vital获批FDA
5. 肺结节CT影像辅助检测软件获批上市

安进CD19/CD3双特异性抗体新药正式在中国获批
12月4日,安进公司宣布,其注射用倍林妥莫双抗获中国国家药监局批准,用于治疗成人复发或难治性前体B细胞急性淋巴细胞白血病。倍林妥莫双抗是一款可同时靶向CD19和CD3的双特异性抗体新药,是美国FDA批准的首款双特异性T细胞接合器免疫疗法,且曾被授予突破性疗法认定。倍林妥莫双抗是中国的首款用于治疗成人复发或难治性前体B细胞急性淋巴细胞白血病患者的双特异性抗体药物。
信息来源:医药观澜
强生EGFR/c-Met双抗凭I期数据申请上市
12月3日,强生旗下杨森宣布,向FDA提交EGFR/c-Met双抗amivantamab的上市申请,用于治疗铂类化疗后进展的EGFR外显子20插入突变的转移性非小细胞肺癌患者。针对该适应症,amivantamab在今年3月获得了FDA授予的突破性疗法资格。FDA尚未批准专门治疗EGFR外显子20插入突变的转移性非小细胞肺癌患者的靶向疗法,amivantamab是首个向监管机构提出上市申请用于治疗这类患者的药物。
信息来源:医药魔方
亚盛医药MDM2-p53抑制剂联合Bcl-2抑制剂2a期临床研究在中美两国获批
12月2日,亚盛医药宣布,在研1类新药MDM2-p53抑制剂APG-115作为单药或联合Bcl-2抑制剂APG-2575获得中国国家药品监督管理局药物审评中心的临床试验许可,将开展治疗复发/难治T-幼淋巴细胞白血病的2a期临床研究。此前该研究方案已获美国FDA临床许可。这一联合疗法是全球治疗R/R T-PLL的首创,并有望在多种癌症中激发“合成致死”机制。“合成致死”是指两个非致死基因同时被抑制,导致细胞死亡的现象。利用这一机制找到肿瘤中的特异突变,再找到它的“合成致死搭档”,进而特异性杀死癌细胞。
信息来源:医药观澜
美敦力的术中神经系统NIM Vital获批FDA
近日,美敦力的NIM Vital术中神经监测系统获得FDA批准上市,用于降低头颈外科手术期间神经受损的风险。NIM Vital监测特定位置的肌电信号,当特定神经被激活或受到刺激后,警告外科医生,以减少对神经的伤害。另外,美敦力近期收购了AiBiomed公司,该公司拥有一款术中甲状旁腺位置确认系统。其甲状旁腺确认技术使用激光探针检测甲状旁腺组织的荧光成像,无需造影剂,用于甲状腺切除术和甲状旁腺切除术中,实时检测甲状旁腺组织的位置。
信息来源:医疗人咖啡
肺结节CT影像辅助检测软件获批上市
近日,杭州深睿博联“肺结节CT影像辅助检测软件”获国家药品监督管理局批准。该产品用于胸部CT影像的显示、处理、测量和分析,可对4mm及以上肺结节进行自动识别并分析结节影像学特征。该产品为人工智能医疗器械软件,基于深度学习技术的基本框架,可实现肺结节的自动检出。在保证肺结节检出准确性满足临床需求的基础上,提高检出效率,减轻医师工作量。
信息来源:医疗人咖啡

康方生物PD-1/CTLA-4双抗在MSI-H新辅助治疗中疗效远超联合用药
12月2日,康方生物发布,PD-1/CTLA-4双抗AK104用于MSI-H晚期实体瘤的新辅助治疗研究的数据。AK104在7例疗效可评估的患者中,7例患者均达到缓解,其中3例结直肠癌患者达到完全缓解。同时,AK104治疗晚期MSI-H患者具有良好的安全性。这些初步结果反映了AK104在治疗MSI-H患者的肿瘤反应评价、疗效和安全性方面的表现良好,意味着AK104有望成为针对具有MSI-H生物标志物的肿瘤治疗的更加有效且安全的治疗手段。
信息来源:佰傲谷BioValley

1
.
合全药业、药明生物与Tubulis达成战略合作,加速新一代抗体偶联药物临床研发
2
.
AbbVie与Frontier Medicines合作开发难成药靶标新药和E3降解
剂
3.
索元生物引进吴中医药重组人血管内皮抑素注射液

合全药业、药明生物与Tubulis达成战略合作,加速新一代抗体偶联药物临床研发
12月2日,合全药业、药明生物与Tubulis公司宣布,三方建立战略合作伙伴关系,共同加速Tubulis新一代抗体偶联药物的开发,直至新药临床实验申请。药明生物和合全药业将成为Tubulis的CDMO合作伙伴,提供抗体偶联药物中间体的规模放大、工艺开发和GMP生产服务,其中合全药业专注于连接体和有效载荷,药明生物专注于单克隆抗体和Tubulis专有Tub-tag®技术中使用的酶。药明生物随后将进行工艺开发和生物偶联,并以GMP标准生产偶联原液和制剂,灌装用于临床前毒理研究,同时供应用于临床评价的产品批次。此次合作的财务细节未披露。
信息来源:医药观澜
AbbVie与Frontier Medicines合作开发难成药靶标新药和E3降解剂
12月2日,AbbVie和Frontier Medicines宣布,将合作发现、开发和商业化针对高关注度难以成药的蛋白质靶标的创新性小分子疗法。双方将利用Frontier专有的化学蛋白质组学平台为针对新型E3连接酶以及某些肿瘤学和免疫学靶标的项目识别小分子。AbbVie将向Frontier支付5,500万美元的前期现金付款,Frontier有资格获得额外的里程碑付款。此外,AbbVie将通过临床前开发的确定阶段来偿还Frontier的研发费用。AbbVie将对全球开发和商业化活动以及该项目的费用承担全部责任。
信息来源:医药合作投融资联盟
索元生物引进吴中医药重组人血管内皮抑素注射液
11月30日,吴中医药宣布,将其研发项目重组人血管内皮抑素注射液转让给索元生物。索元生物负责除中国和台湾外的研发、生产、销售及以其他方式开发利用重组人血管内皮抑素注射液和诊断产品。本次交易里程碑款项共计3.13亿元人民币。重组人血管内皮抑素注射液已在国内完成三期临床研究,并未通过国家药监局药品审评。吴中医药向审评中心提出了药品注册撤回申请并获得批准。
信息来源:医药合作投融资联盟

1.
乐普医疗全资子公司“乐普诊断”科创板IPO获受理,IVD拆分上市第一股
2. 第一家IVD微球原料企业科创板过会

乐普医疗全资子公司“乐普诊断”科创板IPO获受理,IVD拆分上市第一股
12月1日,上交所受理乐普诊断科创板上市申请,公司拟募资4.11亿元。乐普诊断是乐普医疗旗下控股子公司,此次申请上市科创板也是上市公司践行分拆上市的重要战略步骤。乐普诊断主营业务为体外诊断试剂及仪器的研发、生产和销售。经过十余年的发展,从最初的单一胶体金POCT试剂产品发展至目前的胶体金和荧光POCT、凝血诊断、生化诊断、化学发光免疫诊断和分子诊断五大系列的技术与产品平台,是国内少数技术和产品覆盖体外诊断多个主要领域的创新型、平台型企业。
信息来源:体外诊断网
第一家IVD微球原料企业科创板过会
12月3日,上海证券交易所科创板股票上市委员会同意纳微科技首次发行上市,是第一家IVD微球原料企业科创板过会。本次拟发行不超过4,400万股,募集资金3.65亿元用于研发中心及应用技术开发建设项目、海外研发和营销中心建设项目及补充流动资金。其中1亿元用于补充流动资金,占募集资金总额的27%。纳微科技是一家专门从事高性能纳米微球材料研发、规模化生产、销售及应用服务,为生物医药、平板显示、分析检测及体外诊断等领域客户提供核心微球材料及相关技术解决方案的高新技术企业。
信息来源:体外诊断网
○
医疗与生命科技资本市场本周动态一览:
近期交易概况(2020年11月28日-12月03日)

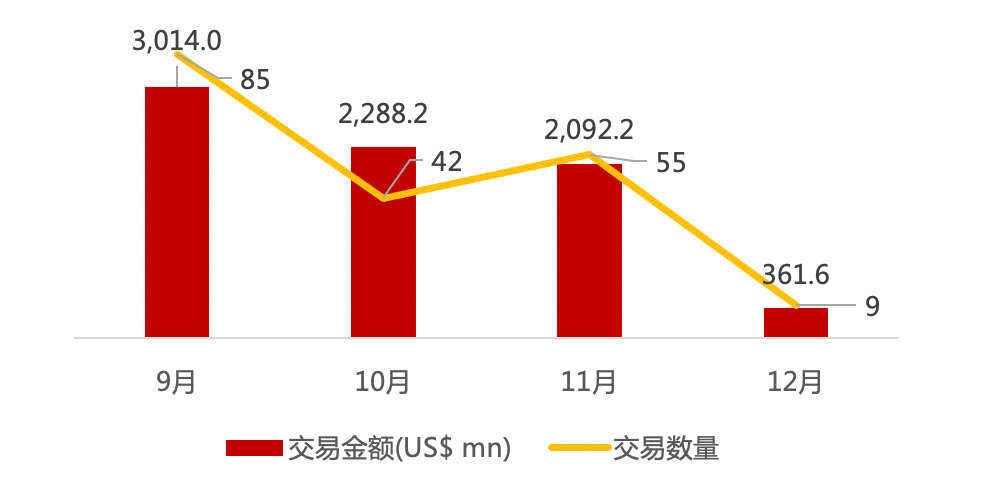
* 数据来源:华兴资本内部整理
上市公司市值及估值倍数一览
(2020年12月04日)市值单位:百万美元

< < 左右滑动图片查看完整表格 > >

< < 左右滑动图片查看完整表格 > >

< < 左右滑动图片查看完整表格 > >















