欢迎点击「科学网」↑关注我们!
CRISPR虽然作为基因编辑工具,现在已经成为生物医学领域的最热门技术,研究该技术的几个科学家也一定会毫无悬念获得诺贝尔奖。但是这种技术源头本身,目前仍然存在一些重要科学问题没有被解释,解释这些问题也具有重要学术价值。
Francisco Mojica不是最早研究CRISPR现象的学者,但他可能是最早对CRISPR着迷的学者,言外之意是他意识到这个系统的重要性。1992年的一天,他了解到这个微生物免疫系统。当对一种嗜盐菌(Haloferax mediterranei)基因组序列进行分析时,他注意到14个异常DNA序列,这些序列长度都是30个碱基。序列特征类似回文结构,每间隔35个碱基再重复一次。不久他找到更多类似重复结构。他对这种现象十分着迷,在西班牙阿利坎特大学对这个现象进行了反复研究。
但是当时对这个现象的研究非常不时髦, Mojica的实验室多年拿不到研究经费。他利用学术会议等机会请教学界大佬们,咨询对这种重复序列的看法,但这些人都提醒他不要沉溺于这种重复序列,重复序列在许多物种都存在,这么多年来大家都弄不懂它们的作用。言外之意就是这玩意很奇怪,量你弄不明白。因为研究条件和经费限制,Mojica发现CRISPR位点(locus)短序列重复结构后,使用序列比对方法发现重复序列之间的间隔序列其实是病毒和细菌的结合性质粒,揭示了CRISPR是细菌的适应性免疫功能。
今天CRISPR简直是如雷贯耳,并不是因为这是细菌的免疫系统,而是因为经过改造后的CRISPR–Cas9已经成为最好的基因编辑工具。
不过Mojica们仍考虑这个系统的纯科学问题,如这个系统是如何工作的?这个系统是如何进化的?这个系统对微生物进化有没有影响?为什么只有一部分微生物使用这个免疫系统?这个系统有没有其他更基本的生物学功能?
最早使用这个系统进行基因编辑的学者,加州大学伯克利分校的Jennifer Doudna教授也认为,CRISPR所以受到大家的关注是因为这个技术成为基因编辑工具,其实这个系统本身仍然有许多基本生物学问题没有解决。
存在CRISPR-Cas系统的优势显而易见。细菌和古菌等原核生物一般都生活在极端环境中,经常面对各种遗传入侵者的攻击。病毒(噬菌体)数量是原核生物的10倍,据说每两天可以杀死世界上一半的细菌。原核生物之间也可以交换质粒DNA,这些质粒DNA能在宿主细菌体内寄生,消耗资源,宿主试图驱逐搭顺风车的病毒和质粒,有时候被迫采用自我毁灭的办法。从土壤、大海,一直到最荒凉的地方,细菌总是无法摆脱病毒和质粒的入侵者。
原核生物进化出了一系列应对这些威胁的武器,例如限制性内切酶可以在特定序列对目标DNA进行切割。但这些防御工具比较迟钝,每个酶只能识别特定的序列,微生物必须有正确的序列拷贝才能受到保护。CRISPR-Cas则更加灵活,能记忆特定遗传入侵者序列并给宿主提供针对入侵者的长期免疫排斥能力。荷兰瓦赫宁根大学微生物学家约翰·范德东说,第一次听说这个说法,许多人都认为这过于复杂,不可能是简单的原核生物使用的免疫工具。
Mojica等根据CRISPR回文重复序列之间序列有的和病毒基因组序列一致,提出CRISPR–Cas的功能是细菌对抗病毒的免疫系统。随后科学家证明,一旦细菌暴露于特定病毒或质粒,CRISPR相关蛋白确实能将这些序列插入宿主基因组。这些插入的序列转录的RNA可以引导Cas蛋白剪切任何能与这一序列配对的入侵DNA或RNA序列。
细菌和古菌是如何拥有了这样一套复杂的免疫系统?这个问题至今无法回答,但是主流观点认为是来自转座子。转座子是可以从基因组一个位置到另一个位置的“跳跃基因序列”。美国NIH进化生物学家Eugene Koonin等发现一组这类遗传序列能编码Cas1,这种蛋白负责将基因间隔区插入基因组。这些Cas转座子可能是CRISPR–Cas系统形成的原因。科学家现在正在研究这些序列如何从一个部位向另一个部位转移,并研究这种转移如何进化出复杂的CRISPR–Cas系统。
Cas蛋白也就是CRISPR关联蛋白,负责将病毒间隔子spacers插入细菌基因组,最近几年对这一过程的分子细节已经了解比较清楚。但是病毒和宿主DNA在化学成分上几乎完全一致,Cas蛋白是如何记住间隔子序列仍然是个疑问。
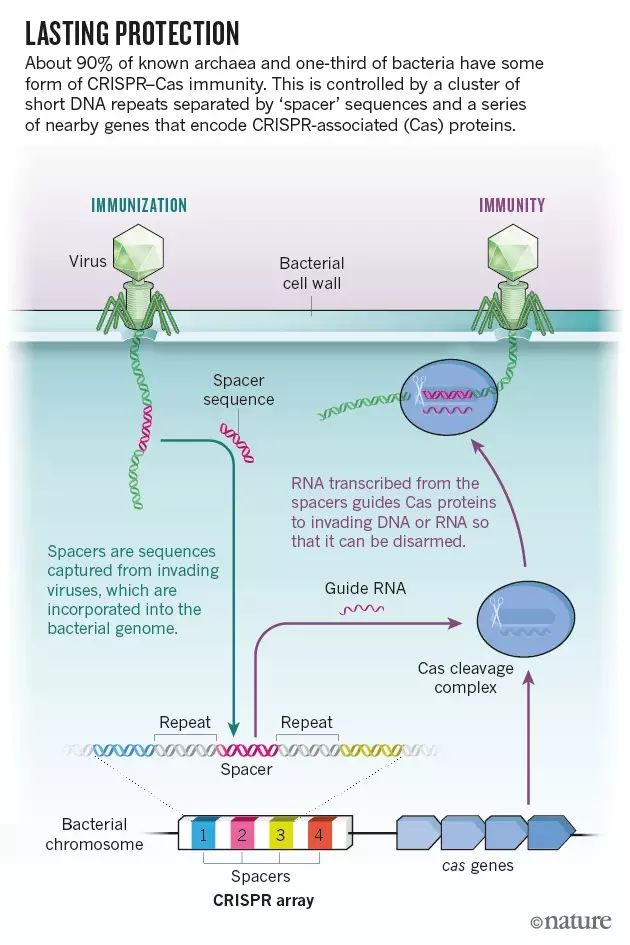
立陶宛维尔纽斯大学生物化学家Virginijus Siksnys说,这是个风险系数比较大的功能,假如细菌把自己的DNA误插入,将会造成自身免疫反应甚至自杀。这一系统是双刃剑。北卡罗莱纳州立大学微生物学家Rodolphe Barrangou认为,在众多的细菌和古菌中,应该有一些因错误把自身序列插入CRISPR,不过用一部分细菌自杀为代价换来耐受病毒的威胁是值得的。高等生物包括人类也有自身免疫疾病,这也是应对外来威胁保存自身的必要牺牲。
当病毒感染了细菌,大约一千万个被病毒感染的细菌才能获得一个隔离子,从而获得对该病毒的免疫力。或者说细菌成功免疫病毒的概率仅有千万分之一。这种小概率事件给研究带来比较大的困难,很难弄清楚是什么让某些细菌获得对某种病毒的免疫力。人类如果掌握了细菌免疫病毒的工作原理,也许可以按照同样的策略治疗病毒感染。这是研究这种现象的功利性目的。洛克菲勒大学微生物学家Luciano Marraffini说,非常难及时发现某个细菌获得了这样的能力。
弄清楚如何识别间隔子,或加快这种编辑速度,都可能是有价值的。研究表明,某些CRISPR-Cas系统作为记录装置,可对遇到的DNA和RNA按照序列进行分类。利用这样的性质,科学家可以示踪细胞的基因表达,或研究某些化学物质对基因表达的影响。
科学家也希望了解这个系统如何把一些少见的序列忘记或屏蔽。大多数拥有CRISPR–Cas系统的微生物只有数量不多的间隔子,有的只有一个,这些免疫系统只能对一种或几种病毒进行切割破坏。超嗜热古菌Sulfolobus tokodaii是个例外,有5套CRISPR–Cas系统,485个间隔子。
继续保持旧的间隔子可能有某种生物学意义,如果病毒发生变异,可以逃避CRISPR-Cas,使旧的间隔子失去价值,继续保留这样的序列对微生物来说是额外负担。以色列雷霍沃特魏茨曼科学研究所遗传学家Rotem Sorek说,细菌不可能持续扩张自己的基因组。
间隔子序列理论上来自于病毒,但是大多数这种序列的来源目前不清楚。已知CRISPR序列只有不足3%能与DNA数据库已知序列匹配,97%以上的序列找不到来源,这说明我们对病毒基因确实非常无知。
首先说明我们对大多数病毒序列不了解。现有测序工作一般集中在人类患者、牲畜或农作物基因组上。雅典大学RNA生物学家Michael Terns说:“我们对细菌和古生菌的敌人,噬菌体知之甚少。”其次是许多序列在病毒中已经消失。当然也有可能是因为某些鬼魂病毒序列,这些序列曾经存在,但为了逃避CRISPR的绞杀而突变进化成其他序列,要知道病毒基因突变是经常发生的。第三种说法最为奇异。科学家发现CRISPR–Cas系统不仅仅是破坏外来入侵基因。一些细菌的CRISPR–Cas元件具有控制DNA修复、基因表达和生物膜形成等功能。也有一些CRISPR–Cas系统是决定感染其他物种的能力。嗜肺性军团菌能引起军可入侵团病,这种细菌必须拥有Cas2才能感染到能感染其天然宿主变形虫。
RNA干扰是植物、动物和非原核生物基因表达沉默系统。RNA干扰也被认为是一种古老的基因入侵防御系统,随着生物进化,这种系统被改造成为基因表达调控系统。也可以参考RNA干扰这样理解CRISPR–Cas系统,细菌抓捕病毒基因序列也是补充自身基因组的一种方式。获得任何新序列也等价于获得一些新功能,这难道不就是进化的本质吗?也许复杂高等生物就是这样进化来的。CRISPR–Cas系统是一种基因猎捕工具。按照基因自私的逻辑,CRISPR–Cas系统为基因的广泛传播提供了跨物种的途径。
四、为什么不是所有微生物都使用CRISPR-Cas系统?
一些微生物体内存在大量CRISPR-Cas序列和蛋白,另外一些比较少,也有的微生物没有这个系统。90%的古细菌具有CRISPR的免疫系统,大约1/3已知细菌细胞内存在这个系统。为什么CRISPR-Cas系统在不同微生物存在如此大的区别?
关于CRISPR-Cas系统目前发现最奇特的一种古菌是纳米古菌Nanoarchaeum equitans,这种寄生古菌自身缺乏许多与能量产生和表达调控相关的基因,只能寄生于另一种沸水古细菌细胞内。仅有49万个碱基对组成的微小基因组中,竟然拥有约30个CRISPR-Cas系统。

根据数学模型和一些初步的实验研究,如果CRISPR–Cas只有4-5个类型的病毒序列,这种系统只能在细菌基因组记录有限数量的病毒序列。如果病毒序列发生广泛突变,CRISPR–Cas系统无法有效避免病毒的入侵。另外一种解释是,生活在极端条件下的古菌无法使用其他防御系统。细菌对抗外来入侵的方法是把突变蛋白包裹起来,但是这需要消耗比较多的能量,这对古菌这种物种来说具有很大挑战性。使用CRISPR系统则相对比较轻松。
科学家热衷于研究CRISPR-Cas9系统,是因为基因组编辑作为一种技术,简单性和多功能性的CRISPR-Cas9系统受到更多科学家的热爱。简单是容易操作容易被重复,多功能是应用广泛,这是一个新技术被重视的最重要特征。但是微生物对Cas9没有多大兴趣,相反细菌更热爱使用多个CRISPR-Cas系统,这样才能应对不同的入侵者。存在多种不同的系统使细菌可以从其同伴中获取新的CRISPR-Cas系统,并迅速丢弃原有的类型。目前已经确定6种不同CRISPR系统,共19个亚型。
揭开这些CRISPR-Cas系统的分子机制可能是寻找新型基因编辑技术的关键。CRISPR-Cas9属于II型系统,利用RNA分子转录间隔子序列,引导Cas对入侵基因进行切割。去年发现的VI系统则不是对DNA,而是对RNA进行切割。IV型系统CRISPR-Cas相关基因,但是缺乏重复序列和插入间隔子序列的功能。
存在如此多不同特点,说明存在一些CRISPR–Cas系统进化的关键影响因子。必须保证这种系统能破坏病毒入侵的同时避免自身受到伤害。极端环境似乎对特别眷顾CRISPR–Cas系统,这也是为什么一些科学热衷于从海底或火山口微生物寻找新的CRISPR–Cas系统。不过CRISPR–Cas系统对细菌生存环境有重要影响。一种鸟类支原体寄生在鸡体内有CRISPR–Cas,但寄生在野雀体内没有这种系统。
III型系统也是自然界最常见的CRISPR–Cas,但是也是研究最少的类型。证据提示这种系统并不对入侵DNA或RNA本身反应,但是能干扰DNA向RNA的转录过程。如果这个现象被确认,这个系统可以开发成CRISPR–Cas基因编辑工具的新功能。
也可能会有新的类型被发现,特别重要的是科学家从可培养微生物向不能培养的更多类型的微生物寻找目标,最近Jennifer Doudna刚刚报道的更小分子Cas就是利用这个思路。
Mojica对不同类型的CRISPR系统研究是为了回答基础科学问题,他沉迷于CRISPR已经1/4个世纪,虽然关于基因编辑的研究经费非常多,但是这并不是他的菜。虽然他也清楚,这个系统对基因更能的研究甚至人类疾病治疗都具有巨大应用前景,但是他就是想知道这个系统背后的秘密。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:http://blog.sciencenet.cn/blog-41174-1028347.html














