CRISPR基因组编辑领域可谓日新月异,每月都有新成果涌现。不久前,CRISPR技术先驱张锋(Feng Zhang)领导的团队发表文章,介绍了如何使用Cpf1来进行多重的基因组编辑。与常用的Cas9相比,Cpf1将多重编辑大大简化,这是如何实现的呢?

Cpf1出现之前
在这种新的Cpf1方法出现之前,其他的CRISPR多重基因编辑完全依赖于Cas9。总的来说,这些方法主要有两个缺点:
1. 大部分方法需要转染不止一个载体,它们表达gRNA和Cas9。由于拷贝数的差异,共转染可能导致表达水平有变化。此外,还有一个普遍存在的缺点,只能瞬时表达,并且需要可转染的细胞系。
2. Cas9系统需要较大的表达载体,这使其难以转染或包装到病毒载体中。Cas9多重载体往往更大,因为它们需要调控序列来实现多个gRNA的表达,比如Csy4切割序列、tRNA以及多个单独的启动子。
表1:Cas9多重编辑方法
|
多重方法
|
导入方法
|
优点
|
缺点
|
参考文献
|
|
Golden Gate Assembly
|
转染
|
一个载体表达
Cas9
和多达
7
个
gRNA
|
每个
gRNA
需要自己的启动子
|
Sakuma et al
|
|
Multiplexed Lentiviral Expression Cassettes
|
慢病毒
转导
|
一个载体表达
Cas9
、
eGFP
和多达
4
个
gRNA
|
每个
gRNA
需要自己的启动子
|
Kabadi et al
|
|
Csy4-Cleavable Cassettes
|
转染
|
通过一个多顺反子的转录本表达
gRNA
|
需要共转染
Cas9
|
Nissim et al
Tsai et al
|
|
PTG Cassettes
|
转染
|
通过一个多顺反子的转录本表达
gRNA
|
需要共转染
Cas9
|
Xie et al
|
Cpf1出现之后
与Cas9不同,Cpf1能够自身加工前体crRNA,随后利用加工的crRNA特异性地靶向和切割DNA。Cpf1这种加工crRNA的能力能够简化多重基因编辑。张锋实验室的研究人员证明,Cpf1在体外和哺乳动物细胞中最多能够切割4个crRNA的阵列(Array)。这样,单个启动子就能驱动crRNA阵列的表达,而不需要表达其他的核酸酶,如Csy4。
小贴士:在克隆过程中,研究人员使用了4个特别的寡核苷酸,它们包含直接重复和crRNA。与拼图类似,这些寡核苷酸带有粘性末端,只能朝一个方向退火。具体示意图如下。记得订购5’磷酸化的寡核苷酸,或者用T4多聚核苷酸激酶处理哦。
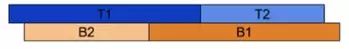
图1:crRNA寡核苷酸只能朝一个方向退火。
如何导入
既然Cpf1具有这种自我加工的能力,那也就没必要用多个启动子来驱动crRNA表达,或者添加一些方便加工的序列,如Csy4切割位点。因此,crRNA表达载体更加简化,更加轻巧,适用于多个表达平台:转染、慢病毒转导以及腺相关病毒(AAV)转导。
在张锋实验室的大多数实验中,他们使用了共表达Cpf1和crRNA阵列的单个载体。当表达crRNA阵列、Cpf1和GFP标签的单个质粒转染时,6.4%的HEK293T细胞实现了4个目标的编辑。不过,若转染多个质粒,其中每个质粒表达一个crRNA,再加上一个Cpf1表达载体,4重编辑的细胞仅为2.4 %。图2比较了单个质粒和混合质粒的编辑效率。对于多重编辑,单个质粒显然更有效。
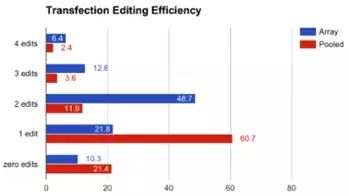
图2:在HEK293T细胞中转染单个质粒或混合质粒后的编辑效率。
最后,作者还贡献了一些AAV载体转导的经验。在这些实验中,他们将两种AAV以1:1的比例混合,并感染细胞,其中一种表达Cpf1,另一种表达crRNA阵列以及GFP标签。在感染后四周,约75%的神经元被Cpf1和GFP共同转导。在这些神经元中,三个位点全部被编辑的神经元占15%。













