责编 | 狄德罗
大脑工作依赖于神经元间的信息传递,而神经元间的信号传导主要是通过递质释放完成的。自从1952年Bernard Katz首次发现量子化的递质释放以来,科学家们一直在努力探索神经递质是如何释放的。许多间接证据提示,递质释放是通过膜融合时产生的孔道释放的。然而,
经过六七十年的研究,活细胞膜孔道开放过程至今没有被直接观察与证实,它的调控过程也因此不为人知。
近日,
美国国立卫生研究院
巫凌刚
实验室在最新仪器的
Cell
上发表了题为
Visualization of Membrane Pore in Live Cells Reseals a Dynamic-Pore Theory Governing Fusion and Endocytosis
的长文,其研究
首次利用超高分辨率受激发射损耗显微镜(STED)观察到囊泡融合孔的结构和动态过程。在短至26毫秒,长至数秒的时间内,膜孔道可在0到490纳米间打开
(图1)
,随后可保持不变,扩张,收缩和闭合。

图1. 囊泡融合时产生的融合孔(箭头位置)

这一动态过程决定了囊泡内递质的释放与回收的效率,它们是由融合孔的扩张和收缩之间的竞争产生的。扩张和收缩分别由F-肌动蛋白依赖性的膜张力和钙/Dynamin介导。这些发现提供了证实融合孔假说所缺失的活细胞证据,并建立了一个阐述膜融合,分裂和调控的
融合孔理论
(图2)
。这一新理论替代和完善旧有的“窄孔理论”。所谓“窄孔理论”是指膜融合形成了一个狭窄的孔隙,它可以快速闭合以限制囊泡内物质释放(kiss-and-run),或者不可逆转地扩展直到变平(完全塌陷)以促进释放。这种两极分化的释放模式过于简单,无法解释活细胞上膜孔道的动态变化过程,新理论可以替代旧理论来解释数十年来关于递质释放的研究结果。
本项工作打开了膜孔道动态研究的大门
。
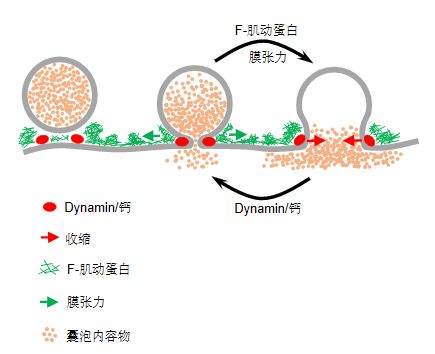
图2. 新膜融合孔动态理论
膜融合与回收是细胞赖以生存的生物过程。例如神经递质与激素的释放,胞吐,胞吞,细胞内运输,细胞分裂,受精和病毒侵入都依靠这一过程。
巫凌刚研究员实验室长期以来致力于膜融合与回收的研究。研究室的主要工作如下表所示:
|
2002 Nature
|
利用细胞膜电容记录方法在calyx of Held巨型神经末梢上测量了单个与多个囊泡的释放与回收过程
|
|
2006 Nature
|
运用细胞贴附微电极记录技术首次揭示了在神经突触上存在“kiss-and-run”和“完全塌陷”两种递质释放模式,并且测量了囊泡融合孔的膜电导来推测膜孔道动力学
|
|
2009 Nature Neuroscience
|
发现钙通过钙调蛋白激活各种内吞过程: 快速胞吞,慢速胞吞,巨胞吞和overshoot
|
|
2014 Nature Communications
|
结合STED显微镜技术揭示了囊泡融合后结构的变化,提出了新的“Ω-胞吐-胞吞”模型
|
|
2016 Nature
|
首次在活细胞上发现囊泡半融合结构,其调控机制,以及在膜融合与分裂中的重要作用
|

图3. 实验室成员在大瀑布公园郊游
本项工作由美国国立卫生研究员巫凌刚实验室独立完成,第一作者Wonchul Shin,第二作者葛礼浩。共同作者刘会生(现北京航空航天大学教授),赵伟东(中国医科大学教授,第十三批“青年千人计划”)已回国任职。
1. Single and multiple vesicle fusion induce different rates of endocytosis at a central synapse. Sun J.Y., Wu X.S., Wu L.G.
Nature
, 2002; 417, 555-559
2. Two modes of fusion pore openings revealed by cell-attached recordings at a synapse. He L., Wu X.S., Mohan R., and Wu L.G.
Nature
, 2006; 444, 102-105
3. Compound vesicle fusion increases quantal size and potentiates synaptic transmission. He L., Xue L., Xu J., McNell B., Bai L., Melicoff E., Adachi R. and Wu L.G.
Nature
, 2009; 459, 93-98















