摘 要:目的
筛选和鉴定淡豆豉炮制过程中产纤溶酶的优势菌株。
方法
按《中国药典》
2020
年版制备淡豆豉;采用酪蛋白平板法和纤维蛋白平板法分别对淡豆豉炮制不同时间点样本中产纤溶酶的微生物进行初筛和复筛;将产纤溶酶微生物分别接种在特定的液体培养基中培养,获得纯种发酵液,用纤维蛋白平板法测定发酵液的纤溶酶活力;应用
16S rDNA
和
18S rDNA
通用引物分别对产纤溶酶细菌和真菌进行
PCR
扩增、对扩增产物进行测序,测序结果通过
NCBI
同源性比对、
MEGA 4.1
软件构建系统发育树进行分子生物学鉴定。
结果
筛选获得
3
种产纤溶酶细菌,分别为枯草芽孢杆菌
Bacillus subtilis
、嗜麦芽窄食单胞菌
Stenotrophomonas maltophilia
、微球菌
Micrococcus
。纤维蛋白平板法测定纯种发酵液纤溶酶活力的结果显示,嗜麦芽窄食单胞菌所产纤溶酶活力最高,达
527.49 IU/mL
。
结论
淡豆豉炮制过程中存在高产纤溶酶的优势菌株,淡豆豉的溶栓作用值得进一步研究。为揭示淡豆豉炮制中纤溶酶形成机制奠定基础。
淡豆豉
Sojae Semen Praeparatum
,又名香豉、淡豉、豆豉,作为一味药食两用传统中药至少己有
1 700
余年的应用历史。其为豆科植物大豆
Glycine max
(L.) Merr.
的成熟种子的发酵加工品,以黑色种皮品系大豆为主要原料,桑叶、青蒿为辅料经发酵炮制而成。
历版《中国药典》记载淡豆豉的功效和主治为解表、除烦、宣发郁热,用于感冒、寒热头痛,烦躁胸闷,虚烦不眠等。目前针对淡豆豉的研究主要集中在药理作用、活性物质、炮制工艺优化、质量评价等
[1-4]
。研究表明淡豆豉具有抗肿瘤、防治动脉粥样硬化、防治骨质疏松和糖尿病以及抗菌等药理学作用
[5-9]
,目前普遍认为大豆异黄酮类是淡豆豉主要活性成分。古今应用和现代研究均未涉及淡豆豉的溶栓作用。
血栓栓塞性疾病是一类严重危害人类生命健康的心血管疾病,其病因是纤维蛋白聚集于动脉管壁所导致。溶解血栓是治疗这一类疾病的重要手段。纤溶酶是能催化纤维蛋白水解而溶栓的蛋白水解酶,广泛存在于生物体中。目前,关于淡豆豉炮制中产生纤溶酶的研究报道非常少。检索文献,国外无淡豆豉纤溶酶的报道,国内主要是对不同产地中药淡豆豉活性成分的变化研究
[10-11]
以及采用传统微生物学方法对淡豆豉炮制阶段优势菌株进行筛选与分离鉴定
[12-13]
。本课题组前期研究发现淡豆豉炮制过程中存在高活性纤溶酶
[14]
。淡豆豉炮制过程中的纤溶酶是如何产生的?产纤溶酶的优势菌又是什么?其所产纤溶酶活力如何?基于此,本研究采用传统微生物学方法结合现代分子生物学技术,首次对淡豆豉炮制过程中不同时间点样本中产纤溶酶的优势菌株进行筛选、鉴定和纯种发酵液纤溶酶活力测定,获得高产纤溶酶的优势菌株。研究结果将为揭示淡豆豉炮制中纤溶酶形成机制奠定基础,对进一步发掘淡豆豉的溶栓新功效具有重要意义。
1
材料与仪器
黑大豆、桑叶、青蒿均购自安国冷背药材有限公司,由江西中医药大学附属医院杨安金主任中药师鉴定,分别为豆科大豆属植物大豆
Glycine max
(L.) Merr.
的成熟种子,桑科桑属植物桑
Morus alba
L.
的干燥叶,菊科蒿属植物黄花蒿
Artemisia annua
Linn.
的干燥地上部分。
尿激酶(批号
140604-201224
)、牛纤维蛋白原(批号
140626-201611
)、牛纤维蛋白溶酶原(批号
140606-201325
)、牛凝血酶(批号
140605-201526
)均购自中国食品药品检定研究院。琼脂糖,批号
GS201-01
,
Invitrogen
公司。
细菌基因组
DNA
提取试剂盒(批号
DP302-02
)、植物基因组
DNA
提取试剂盒(批号
DP305-02
)、
2
×
Taq PCR master Mix
(批号
KT201- 02
),天根生化科技有限公司;
DM2000 Marker
(批号
CW0632S
),康为世纪生物科技有限公司;
Golden View
(批号
EP0601
),
Biomed
公司;脑心浸液肉汤培养基(批号
HB8297-1
)、马铃薯葡萄糖琼脂培养基(批号
HB0233
),青岛高科园海博生物技术有限公司;蛋白胨(批号
P8450
)、硫酸链霉素(批号
S8290
)、琼脂粉(批号
409Y029
)、酪蛋白(批号
C8210
),北京索莱宝公司;酵母膏(批号
01-014
),北京奥博生物技术有限责任公司。其他试剂均为分析纯。
细菌发酵培养液:脑心浸液肉汤培养基
38.5 g/L
(固体培养基加
2%
琼脂粉)。
霉菌发酵培养液:蛋白胨
20 g/L
、葡萄糖各
20 g/L
,酵母膏
10 g/L
,硫酸链霉素
40 mg/L
(用时现加)(固体培养基加
2%
琼脂粉)。
酵母菌发酵培养液:马铃薯葡萄糖琼脂培养基
37 g/L
,硫酸链霉素
40 mg/mL
(用时现加)(固体培养基加
2%
琼脂粉)。
Advantage A10MILLI-Q
超纯水仪,
Millipore
公司;
SIGM2-16K
高速低温离心机,
Sigma
公司;
DHP-9082
细菌培养箱、
MJ-150Ⅰ
霉菌培养箱,上海一恒科技有限公司;
PTC-200
普通
PCR
仪,
BIO- RAD
公司;
Ose-470p
凝胶成像紫外分析仪,天根生化科技有限公司。
2
方法
2.1
淡豆豉的炮制和取样
本课题组前期参照《中国药典》
2010
年版已建立规范的淡豆豉炮制工艺
[14-15]
(历版《中国药典》记载的淡豆豉制法相同,含
2020
年版)。具体炮制工艺如下:取桑叶
90 g
、青蒿
100 g
,分次加入生药量
18
倍水煎煮
3
次,每次
1 h
,滤过,合并
3
次滤液,药液浓缩至
1 000 mL
。将黑大豆洗净并于
40
℃烘干至恒重(约烘
3 d
),取
1 000 g
黑大豆拌入上述药液中,药液吸尽至豆粒充分饱胀为度(约
6 h
)。将豆粒置于蒸锅内,隔水蒸
1.5 h
,取出,摊凉,置竹编中,用煎煮过的桑叶、青蒿药渣覆盖,放入温度为(
30
±
2
)℃、湿度为
70%
的培养箱内进行自然发酵,定时翻动,发酵
6 d
至豆粒表面均匀布满黄衣(称“黄衣上遍”,此过程每
3 d
取样
1
次,为发酵第
3
、
6
天样品),取出,除去药渣,洗去黄衣,置陶瓷圆形容器中,桑叶、青蒿渣覆盖,盖容器盖并用水密封,进入“再闷”环节:置温度为(
30
±
2
)℃、湿度为
70%
的培养箱再闷
15
~
20 d
,再闷期间每
3 d
倒出,翻动(此过程在再闷第
3
、
6
、
9
、
12
、
15
、
18
、
20 d
取样),至充分发酵,香气溢出时取出。最后蒸
0.5 h
,
37
℃干燥,即为淡豆豉成品。其成品性状:表面黑色,皱缩不平。质柔软,断面棕黑色。香气浓郁,味微甘。成品性状和各项理化指标均符合《中国药典》
2020
年版要求。各样品尽快置于
4
℃保存,
1
周内完成检测。
2.2
淡豆豉炮制过程中不同时间点样本的微生物培养和菌落计数
按照实验室前期确定的实验方法
[16]
对淡豆豉炮制过程中不同时间点各样本的微生物进行培养。具体如下:称取各样本
1.0 g
,置灭菌研钵研磨后倒入无菌
EP
管中,加无菌生理盐水至
10 mL
,置摇床震荡
30 min
。吸取
1 mL
样液到另一装有
9 mL
无菌生理盐水的
EP
管中,摇匀,依次稀释为
0.1
、
0.01
、
1
×
10
−
3
、
1
×
10
−
4
、
1
×
10
−
5
、
1
×
10
−
6
、
1
×
10
−
7
、
1
×
10
−
8
、
1
×
10
−
9
。分别吸取
9
个稀释梯度的
100 μL
稀释液均匀涂布于细菌、霉菌、酵母菌选择性固体培养基上,细菌置
37
℃培养箱中培养约
24 h
,酵母菌和霉菌置
28
℃培养箱中培养约
72 h
。依据培养皿上的菌落数(肉眼可计数范围),选择
3
个合适的稀释梯度重复实验,并分别进行菌落计数,尽可能挑选更多的优势微生物进行纯化并保菌。
纯种液体发酵:将保存的微生物活化后分别接种于相应的液体培养基,
28
℃、
220 r/min
培养
72 h
,取发酵液
500 μL
,
9 659.52
×
g
离心
5 min
,上清进行纤溶酶活力测定。
2.3
产纤溶酶微生物的筛选
2.3.1
产纤溶酶微生物的初筛
(
1
)
制备酪蛋白平板
[17]
:
Na
2
HPO
4
1.3g/L
、
ZnSO
4
0.02 g/L
、
KH
2
PO
4
0.36 g/L
、
CaCl
2
2 mg/L
、
NaCl 0.1 g/L
、琼脂粉
15 g/L
、酪蛋白
4.0 g/L
,
pH
值
7.2
。
(
2
)
产纤溶酶微生物的初筛:根据“
2.2
”项菌落计数的结果,分别选取各样本合适稀释梯度的稀释液
100 μL
涂布于酪蛋白平板上进行产纤溶酶微生物的初筛,置于
37
℃培养箱培养
1
~
3 d
,挑取产生透明圈的菌落。
2.3.2
产纤溶酶优势菌株复筛
(
1
)
制备琼脂糖
-
纤维蛋白平板:称取纤维蛋白原
18.0 mg
溶解于
10 mL
灭菌生理盐水中,配制成纤维蛋白原溶液,于
37
℃水浴保温;称取
0.16 g
琼脂糖加双蒸水定容至
10 mL
并煮化,待冷却至
55
℃左右加入
0.1 mL
凝血酶(
160 BP/mL
),摇匀后加入配制好的纤维蛋白原溶液,迅速摇匀后倒入直径为
100 mm
的平皿中,室温平放
1 h
以上,待平板凝固后现用或置于
4
℃冷藏备用。
(
2
)
验证纤溶活性:将在初筛中获得的产生溶解圈的菌落接种至相应的发酵培养液中,
37
℃、
200 r/min
培养
24 h
,收集菌液并离心取上清,取
10 μL
上清液加入到琼脂糖
-
纤维蛋白平板小孔中验证其纤溶活性,有透明水解圈的即为产纤溶酶的优势菌株。
2.4
产纤溶酶优势菌株鉴定
2.4.1
形态学鉴定
接种环蘸取复筛获得的产纤溶酶菌株,分别划线于细菌、霉菌、酵母菌选择性固体培养基中进行活化培养,细菌置
37
℃培养箱中培养约
24 h
,酵母菌和霉菌置
28
℃培养箱中培养约
72 h
。对产纤溶酶微生物菌落进行肉眼观察和显微镜下观察其形态特征。
2.4.2
分子生物学鉴定
菌株的分子生物学鉴定按照课题组前期已发表论文中的方法
[16]
,采用细菌基因组
DNA
提取试剂盒进行细菌
DNA
的提取,植物基因组
DNA
提取试剂盒提取真菌
DNA
。细菌采用
16S rDNA
的通用引物
27F/1492R
进行扩增,
PCR
扩增条件如下:模板
DNA 2 μL
,上下游引物各
1 μL
(浓度
10 μmol/L
),
2
×
Taq PCR master Mix 12.5 μL
,补充
ddH
2
O
至
25 μL
;反应程序:
95
℃、
3 min
;
94
℃、
30 s
,
56
℃、
30 s
,
72
℃、
1.5 min
,
30
个循环;
72
℃、
10 min
。真菌采用
18S rDNA
通用引物
ITS1/ITS4
进行扩增,
PCR
扩增条件如下:模板
DNA 2 μL
,上下游引物各
1 μL
(浓度
10 μmol/L
),
2
×
Taq PCR master Mix 12.5 μL
,补充
ddH
2
O
至
25 μL
。反应程序:
94
℃、
1 min
;
94
℃、
30 s
,
56
℃、
30 s
,
72
℃、
1 min
,
30
个循环;
72
℃、
10 min
。扩增产物用
1%
琼脂糖凝胶进行电泳,将
PCR
产物送生工生物工程(上海)股份有限公司测序。测序结果在
NCBI
网站上进行比对,下载同源性高的序列及模式菌株的序列,选用
MEGA 4.1
软件上的
Clustal W
功能进行序列比对,
Kimura 2
模型计算序列距离矩阵的系数,和邻接法(
NJ
)构建目的序列的系统发育树,
bootstrap
值设为
1 000
。
2.5
纤溶酶活力测定
纯种发酵液的纤溶酶活力,采用纤维蛋白平板法
[14,18]
进行测定,以尿激酶为标准品。实验中制备
2
组纤维蛋白平板,取其中
1
组平板置于电热恒温培养箱中
85
℃加热
30 min
制成加热平板(烤板),另
1
组纤维蛋白平板为未加热平板(常温板),将
2
组纤维蛋白平板用于纯种发酵液的纤溶酶活力测定,
用以判断淡豆豉纤溶酶降解纤维蛋白的作用方式。
3
结果与分析
3.1
产纤溶酶微生物的筛选
3.1.1
产纤溶酶微生物的初筛
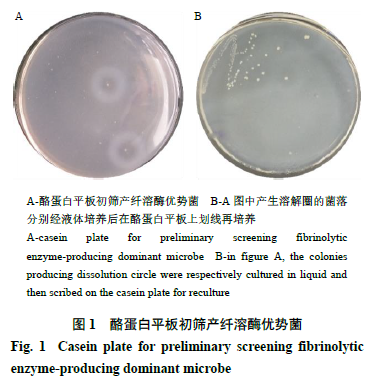
通过酪蛋白平板法对各样本进行产纤溶酶优势菌的初筛,挑取在酪蛋白平板上产生透明溶解圈的菌落进行液体培养。为确保产生透明溶解圈的菌落是单菌落,用接种环蘸取菌液在酪蛋白平板上再次划线分离,重新挑取产生溶解圈大的单菌落进行液体纯种培养,产纤溶酶菌株的初筛结果如图
1
所示。
3.1.2
产纤溶酶微生物的复筛
将酪蛋白平板上初筛获得的具有蛋白酶活力的菌株进行液体纯培养,收集菌液并离心取上清,采用纤维蛋白平板法验证纤溶酶活性,如图
2
所示。对发酵液在纤维蛋白平板上产生透明溶解圈的菌落进行保菌和后续的分子生物学鉴定。
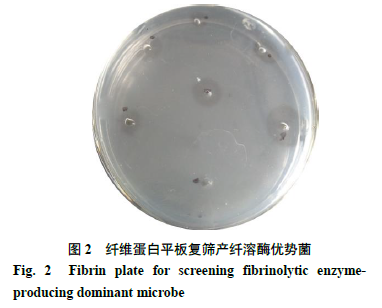
由图
2
可知,经酪蛋白平板初筛确认产生透明溶解圈的菌株,在纤维蛋白平板上进行纤溶活性的验证,结果显示,只有部分菌株的发酵液在纤维蛋白平板上产生明显的透明溶解圈。
通过纤维蛋白平板复筛,课题组筛选获得
21
株能够分泌产生纤溶酶的菌株,编号分别为
1
~
12
、
17
、
19
、
21
、
22
、
26
、
29
、
30
~
32
(编号中缺失的序号为仅在酪蛋白平板上产生透明溶解圈,在纤维蛋白平板上未产生溶解圈的菌株号)。
3.2
产纤溶酶优势菌株鉴定
3.2.1
形态学鉴定
经肉眼观察菌落和革兰氏染色镜检,初步鉴定复筛获得的
21
株菌均为细菌。其中
13
株(编号分别是
3
、
4
、
8
~
10
、
12
、
21
、
22
、
26
、
29
~
32
)具有相似的形态特征:菌落光滑、细小、呈透明状,革兰氏染色均为阴性的杆状细菌,且产生了抗硫酸链霉素抗性;
7
株(编号分别是
1
、
2
、
5
~
7
、
11
、
19
)具有相似的形态特征:菌落大,灰白色,表面粗糙不规则,有很多隆起和皱褶(其中
6
号和
7
号的菌落形态与其他
5
株菌略有不同,呈蜡状),革兰氏染色均为阳性的杆状细菌;
1
株(
17
号)为革兰氏阳性圆球状细菌(图
3
)。

3.2.2
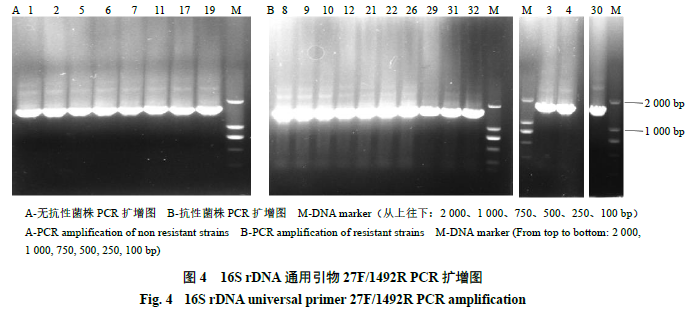
分子生物学鉴定
采用细菌基因组
DNA
提取试剂盒提取
21
株产纤溶酶菌株的
DNA
,并用
16S rDNA
的通用引物
27F/1492R
对
21
株产纤溶酶菌株进行
PCR
扩增,结果发现均扩增出目的
DNA
条带(图
4
);采用植物基因组
DNA
提取试剂盒提取
13
株产生了抗硫酸链霉素抗性菌株的
DNA
,并用
18S rDNA
通用引物
ITS1/ITS4
对
13
株产纤溶酶菌进行
PCR
扩增,结果均无目的
DNA
被扩增,再次说明此
13
株菌为产生了抗硫酸链霉素抗性的细菌,与形态学和革兰氏染色鉴定结果一致。
21
株产纤溶酶菌株的
PCR
产物送测序公司测序。测序结果通过
NCBI
进行序列比对,同时对产纤溶酶的菌株构建系统发育树进行分子生物学鉴定。为了使鉴定结果更为准确,采用相似属种进行了建树,见图
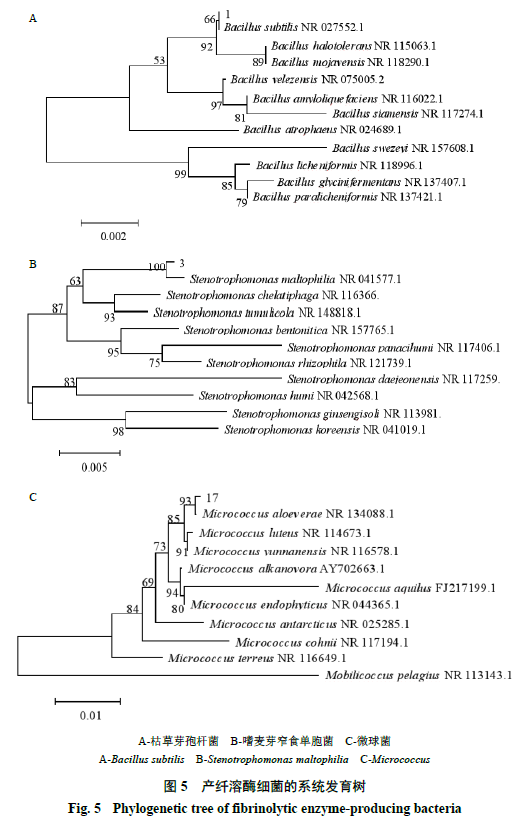
5
。分子生物学鉴定结果为
1
、
2
、
5
~
7
、
11
、
19
号菌株均为枯草芽孢杆菌
Bacillus subtilis
,
3
、
4
、
8
~
10
、
12
、
21
、
22
、
26
、
29
~
32
号菌均为嗜麦芽窄食单胞菌
Stenotrophomonasmaltophilia
,
17
号菌为微球菌
Micrococcus
。