儿科患者的范围是从早产新生儿到未成年儿童。与成年人的气道相比,小儿气道存在许多解剖学和生理学差异,影响着婴幼儿的气道管理。气道问题是小儿麻醉中最常见的关键事件,而在婴幼儿中出现的概率是年长儿童的 4 倍。新生儿定义为孕龄( PCA =胎龄 + 出生后周数 )小于 44 周。婴儿是指任何小于 1 岁的孩子。
婴儿和小儿一样具有一个不相称的大头和短颈。相对于下颌骨,他们的舌显得较大;与成年人相比,他们的喉更向前侧及头侧倾斜。需要使用专用的鼻通气道,但必要时很难切换为经口呼吸。无论是先天性还是获得性的鼻腔堵塞均会引起严重后果。
小儿会厌本身比较长且“柔软”,呈 U 形并处于声门开口上方45°。小儿气道最狭窄的部分是在环状软骨水平,而成人是在声带水平的喉入口。
新生儿的气管长约5cm,在出生后的第一年气管长度会增加至约8cm。隆突最初是在 T2 的水平( 成人是T4),隆突宽于成人。
左、右主支气管成角最初是相似的。然而随着时间的推移,右主支气管的角度变得小于左侧,同时直径变大。因此,如果气管导管置入过深,往往进入右侧支气管内。
新生儿和婴儿肋骨呈水平状,且肋间肌肉比较薄弱。因此,潮气量相对固定,增加每分通气量的唯一方法是增加呼吸频率。在这个年龄组呼吸主要通过膈肌。大约 30% 的足月新生儿的膈肌属于Ⅰ型 ( 慢收缩;抗疲劳)。1 岁后它将会增加至成人数值,即55%。
新生儿和婴儿的功能残气量(FRC)相对较小,往往闭合容积会超过 FRC 和潮气量。因此,在一个正常的潮气量呼吸结束时,小气道易于关闭。低功能残气量及高耗氧率意味着小儿在气道阻塞或呼吸暂停的情况下很容易出现快速缺氧。
受孕后小于 60 周的新生儿和早产儿经麻醉后易发生呼吸暂停,从而影响他们的术后护理。术后第一晚,除了连续监测饱和度外,还应该将其置于一个可监测呼吸的床垫上进行护理。
小儿较大的枕骨可使脊柱产生一定程度的俯屈。操作中通常将头部保持在中立位置(在小婴儿中甚至是轻度过伸位),以避免颈部气道过度俯屈而导致的气道梗阻。
婴儿和小儿的舌肥大意味着麻醉诱导后,失去气道张力易堵塞气道。可以通过简单的手法,例如,通气时确保嘴巴一直张开,早期插入口腔通气道或通过呼吸回路的 CPAP 来克服。
放置面罩时必须小心,压力过大容易损伤颜面部结构。婴儿颈前部软组织的压力可能会推动舌根接触到腭裂从而引起气道梗阻,因此,当面罩给氧时应注意指尖的位置。
婴幼儿面罩通气时往往出现胃胀气,当面罩通气延长/ 困难或腹胀时应采用鼻胃管来降低胃内压。
直喉镜镜片适用于约 3-6 个月的婴儿。婴儿的舌体相对肥大,会厌大而松软易倾斜进入气道内腔并覆盖声门,同时头侧倾斜的喉头使得常规喉镜很难观察到声门(即通过放置喉镜片前端在会厌和舌根之间来间接抬高会厌)。
直镜片占用口腔空间更少,允许直接挑起会厌以显示声门开口。可采用两种技术中的任何一种:先暴露会厌,然后将喉镜片滑至它的下面,提高镜片尖端以暴露声门,或将喉镜片有意前进至食道,然后,随着尖端向前慢慢抬高,慢慢撤回直到可以看到声门。这两种技术叶片直接与会厌接触,可能会引起强烈的迷走神经反射。
小儿气管导管正确大小和深度的选择是根据年龄计算的(见表21.1)。小儿气道最狭窄的部位是环状软骨,它在气道周围形成完整的一圈。气管导管理想的大小是能够在环状软骨平面适当贴合,在允许足够通气的同时,确保在 20cmH2O 压力下只有少量漏气。
基于这个原因,8 岁以下儿童一般采用无囊气管导管。气道黏膜很容易因为位置和大小的不合适而受到损伤,潜在的黏膜损伤可导致气道水肿及拔管后喘鸣,最严重的情况可出现继发性声门下梗阻,这种风险主要发生在婴幼儿。
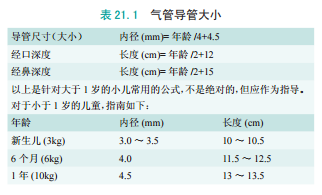
如今,在小儿患者中使用带气囊的气管导管越来越多。支持者认为,带气囊的气管导管可增加在首次插管过程中选择合适尺寸的可能性并可避免多次气管插管相关的潜在创伤。
带气囊的气管导管对于重症监护管理肺顺应性差的患者很重要,因为对于这些患者,大量漏气会影响机械通气效果。
然而,带气囊的小儿气管导管设计存在很大的差异性,尤其是膨胀时气囊的位置及其与声门关系。关于带气囊的气管导管相关的并发症研究已出现矛盾的结果。最近一项多中心、前瞻性、随机对照试验发现带气囊导管较少因大小不合适而更换导管,且拔管后哮喘发病率无明显差异。
但气管导管的选择仍然是儿科麻醉医师的一个热门话题,应该记住的是所有的气管导管都可能与气道损伤相关。一个合适的气管导管经过精心选择和放置,无论是否带不带气囊,对于最大限度地减少气道损伤都很重要。
与气管导管不同的是,小儿喉罩是根据患者的体重确定大小的(见表21.2 )。
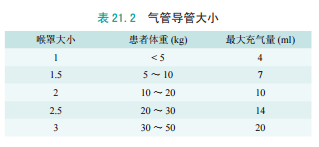
小儿喉罩并不是专门为儿童使用设计的,仅仅是成人版的缩小版,小儿患者使用喉罩同样会有成人喉罩的相应并发症。
对于小儿 LMA 的使用存在一个学习曲线。随着 LMA 的使用,并发症的发生率与 LMA 大小成反比;尺寸 1 号和 1.5 号的 LMAs 出现错位和气道梗阻的频率最高。
如果 LMA 推动大而松软的会厌向下移,即形成气道堵塞,堵塞声门。当将传统的成人技术应用于小儿 LMA 时会遇到困难,可能是由于小儿扁桃体腺样体肥大以及会厌触碰到 LMA 边缘。大量文献报道,LMA 是婴幼儿和小儿困难气道时的有效通气装置。1 号 LMA 在新生儿复苏中也发挥着作用。
Pro-seal 喉罩从1.5 号开始有很多型号可供选择。它有一个与主气道伴行的管腔可供食管引流,允许引流食管内容物且最大化降低胃胀气的风险。可供引流的管腔也提供了放置胃管及上消化道内镜检查的途径。
LMA 插入及拔除的不同技术描述:
LMA 部分插入到舌侧面并继续向前直到遇到阻碍(扁桃体),然后折回到中线。或者,LMA 可以利用“back to front”手法:气囊朝着上颚方向插入, 一旦到达下咽部再旋转 180°。
关于拔出小儿 LAM 的最佳时机还没有共识。然而,年轻患儿具有气道高反应性,且如果一直拖延到出现气道反射才去除 LMA 则比较容易形成喉痉挛。许多医师更倾向于在患者仍然睡着时就去除 LMA。
大部分小儿困难气道具有可预测性。一个孩子意外出现气囊及面罩通气管理障碍是比较罕见的。已发现有许多与困难气道管理相关的综合征和病理改变 (见表21.3 )。困难插管在小儿人群中的总发病率仍然未知。困难喉镜检查在唇腭裂患儿中报道的比例为 4.7%,但有相关的小颌畸形时发 生率明显高于年轻患者。
插管困难和插管失败在粘多糖症小儿中的总发病率分别为 25% 和 8%。在患有 Hurler 综合征(黏多糖症的经典亚型)的小儿中,插管困难和插管失败的发生率将上升至 54% 和 23%。
小儿困难气道管理中使用的许多技术均是从成年人实践中转变来的。主要区别在于使用清醒气管插管技术来确保气道安全对于儿童来说,不能 很好耐受。这就对小儿麻醉医师提出了一个严峻的挑战。正如任何困难气道一样,准备和计划对于一个成功的结果是至关重要的。

表3中概述的情况中均应引起麻醉医师的警惕。具有打鼾或睡眠呼吸暂停综合征的患者在麻醉诱导中存在气道梗阻的风险。
气道受损的症状包括呼吸急促,使用辅助肌和喘鸣。应进行气道检查;检查的程度受到患者合作程度的限制。类似于成人,高 Mallampati 评分患者, 开口度小、颈部活动度受限、小颌畸形、颌挛缩等畸形特征都预示着困难气道,尽管在小儿实践过程中 这些预测困难气道的指标没有经过正式验证。
小儿麻醉史的回顾非常重要,由于潜在的疾病状态,许多患者会接受重复麻醉。但需要明白这些孩子的气道可能随着成长而改变。例如,随着时间的推移,黏多糖症的小儿气道将趋于恶化,而随着下颌骨的生长,彼埃尔罗宾(Pierre Robin)综合征的 儿童气道将会改善。
术前应口服、静脉或肌内注射止涎剂如阿托品20μg/kg。对于焦虑症患儿,给予镇静作用的术前药可能会有用,然而如果有气道堵塞的风险时,则应避免使用这些药物。
麻醉前准备并检查所有设备,最好有两位麻醉医师在场,这对于计划行纤支镜操作至关重要。
最新的一项调查证实了,给予 100% 氧气和七氟烷吸入诱导仍然是管理婴儿和年幼小儿困难气道的技术选择,也可以选择给予精确滴定剂量的异丙酚作为替代。
在诱导过程中失去肌张力会引起气道阻塞,气道阻塞可以通过改变患者的体位或选用一个适当大小的口咽/ 鼻咽通气道进行管理。Guedel 口咽通气道从 0—4 号多种规格可选,尺寸的大小根据从口角至下颌的角度测量来区分。
鼻咽通气道可通过剪切气管导管自己制作,因为其商业成品只有成人型号。如果未建立静脉通道的情况下出现气道阻塞,则应三角肌肌内注射琥珀胆碱5mg/kg。
除了直喉镜片及弯喉镜片处,也可以使用 McCoy 喉镜片和 Polio 喉镜片的小儿型号。直接喉镜检查往往借助于压迫环状软骨使声门进入视野 范围内。探条和管芯均有小儿型号,但探条越小越难操作。还有一种“双人”技术:一人在喉镜检查时通过压喉获得最佳声门暴露,另一人放置探条。
对小儿进行清醒的光纤插管具有很高的挑战性。由于缺乏患者的合作和理解,光导纤维的操作主要在小儿麻醉后进行。如果采用光导纤维技术, 应同时有两位麻醉医师,一位负责麻醉诱导和维持,一位负责确保气道通畅。
这即引出了另一个问题,如何在气道操作期间维持麻醉深度。如上所述,保留自主呼吸的吸入诱导可以作为小儿困难气道的技术选择,在插管过程中必须维持氧合和麻醉深度。选择的方法能否实现这个目标,将取决于潜在的气道病理条件,插管途径的选择和计划的手术方式。
可采用与麻醉回路直接连接的鼻咽导管(剪切的气管导管),专门设计的内镜面罩或带有 Rusch 连接器的 LMA(见图 1 、图2)。
小儿光导纤维支气管镜具有三种型号。最小的外径为 2.2mm,可容纳一个 2.5mm 的气管导管。然而由于材质柔韧,可能会难以操作且没有吸引的通道。不同型号纤支镜的特性归纳如下(见表21.4 )。
一般经鼻光导纤维插管推荐用于存在颞下颌关节问题或张口受限的患者,或手术时必须要采用经鼻插管患者。
麻醉维持可以通过在对侧气道放置一个鼻插管,直接将气道与呼吸回路连接或通过使用内镜面罩连接。导管安装在纤维内镜上,然后穿过鼻腔可以清晰观察到声带,继续前进纤维内镜直到可看到隆突,然后导管越过纤维内镜。
此时需要抑制喉反射以确保导管可以通过声带,可通过吸引通道给予利多卡因 (3 mg/kg) 表麻,或吸入麻醉药或小剂量异丙酚加深麻醉来实现。如果气道易于维护,则可以选择单剂量的短效阿片药或神经肌肉阻滞药。
该方法也可用于有或无导丝情况下的经口气管插管。如果采用了导丝技术,则纤维内镜不必进入气管,但仍应在声门上附近。通过吸引通道,将导丝直视下放置入气道,然后除去内镜,导管通过导丝进入声门。
这项技术在小儿纤维镜无法完成的插管情况下特别管用。但由于导丝本身比较精细脆弱,常常首先穿入 Cook 交换导管以硬化导丝,然后气管导管顺着交换管进入气道。
采用 LMA 辅助小儿纤维支气管插管是一项很好的技术。LMA 不仅可作为一种纤维内镜导管,而且在气道操作过程中通过提供通畅的气道保证了 足够的麻醉深度。
如果利用 LMA 可以充分控制通气,有些人会选择给予神经肌肉阻滞药来改善插管条件。一旦麻醉达到足够深度,通过 LMA,纤维内镜直接看到声门,继续插入到气管中直到可观察到隆突。小儿气管导管较短意味着其顺着纤维镜进入会到喉罩内部。
这个问题可通过连接两个气管导管解决:使用上面的导管将下面导管推送到位, 扶着上面导管,退出喉罩。
有一项较为流行的技术是使用导丝和气道交换导管:导丝通过吸引孔进入气道,退出纤维光导镜,Cook 交换导管经喉罩顺着 导丝进入,撤出导丝,气道交换导管由 CO2 图形定位,退出喉罩,气管导管顺着交换管进入气道。
插管型喉罩有 3 号和更大号可选,它可以作为大于 25kg 的小儿光学纤维镜的导管,并对那些患有颈部病变的患者具有重要的作用。
对于处理小儿困难气道还可使用其他工具。
Bullard 喉镜是一个硬质的纤维喉镜,具有三种尺寸:新生儿/ 婴幼儿、儿童和成人。它有助于口腔、咽和喉的轴线不一致时声门的可视化。一旦观察到喉,气管导管可以通过 Bullard 插管芯或探条前进。当导管经鼻进入时,Bullard 喉镜可以通过使声带可视化而辅助经鼻插管。使用时,它对颈部活动度要求最小,适用于张口度只有 6mm 的患者( 见图3 )。
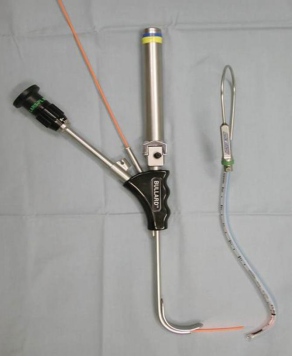
图 3 Bullard喉镜
视频喉镜通过纤维光导内镜将喉镜尖端的视野转化为视频信息。对于学习小儿气管插管技术是一个很好的教具,麻醉医师可以追踪喉镜位置、监测气管导管的路径。视频喉镜也可用于小儿困难气道。
光棒是一个预制的管芯,内含有一个可以照透颈部软组织的发光尖端。不论有无喉镜均可以使用,尤其适用于张口受限或颈椎不稳定的患者。当光棒沿着中线向喉部前进时,可在颈部前面监测发光尖端的通过。光棒有两种小儿型号,婴儿型号与 2.5mm 管径一致,小儿型号适合 4mm 管径( 见图4 )。
图 4 光棒
小儿气道梗阻的形成原因有许多,包括先天性和获得性( 见表5 )。在不考虑潜在原因的情况下,气道管理的一般原则是相同的,但是有两种情况值得特别关注。此外,麻醉医师还应该警惕梗阻后负压性肺水肿的发生,这种情况可能会需要一段时间的正压通气。
这是 1-3 岁年龄组进行支气管镜检查最常见的原因。伴有上气道阻塞时的表现为急性事件或在轻度气道堵塞时可能出现咳嗽或喘鸣数天伴随非典型的临床表现。耳鼻咽喉科和麻醉科团队的早期干预十分重要( 见图5)。
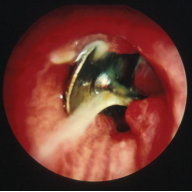
图 5 吸入性异物
应评估气道并判断气道受损程度。重要的体征包括呼吸频率、喘鸣程度、呼吸辅助肌的使用,胸骨、肋骨下及肋间凹陷。如果小儿疲惫,情况会更加紧急。
孩子与他们的父母一起来到手术室。随后患儿接受高流量给氧。由于氦氧混合气本身具有相对低的密度可降低湍流的阻力,也可以考虑氦氧混合气。可以实施100% 纯氧及高浓度七氟醚的吸入麻醉诱导,并保持自主呼吸。
一旦进入深度麻醉,应确保静脉通道和完善的标准化监测。然后进行喉镜检查对会厌、喉和声带部位喷 1% 利多卡因。要有充足的时间让利多卡因发挥作用,以避免外科医师插入硬质支气管镜时发生咳嗽和喉痉挛,然后呼吸回路连接到支气管镜的侧臂上。
传统经验认为,由于正压会将异物推进气道,整个过程中应保持自主通气。然而,如果异物位置较深,使用神经肌肉阻滞药可以使异物更易取出。术中可考虑给予单剂量的地塞米松0.25 mg/kg,尤其是取出时格外困难。
孩子应该禁食至少2 小时,利于表麻的利多卡因药效消失。需要在可以检测喘鸣并接受湿化氧疗的病房进行护理。预先准备肾上腺素喷雾器(400μg/kg) 以应对喘鸣。
这是一种急性的、可危及生命的疾病。根据经验,这通常是由一种潜在的嗜血菌属 B(HiB) 感染引起的。
然而现在引进的儿童 HiB 疫苗意味着最常见的病原体是链球菌属,非 B 型嗜血杆菌的感染本身具有高的发病率和死亡率,发病高峰在 2-3岁,它包括会厌周围水肿的急性发作。大约 60% 的会厌炎小儿需要气管插管。同样,资深的麻醉医师和耳鼻喉科医师早期参与也至关重要( 见图6 )。
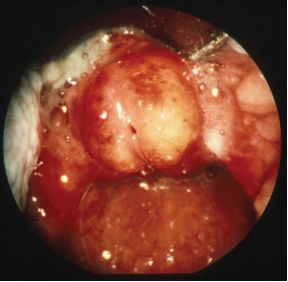
图 6 会厌炎
患儿看起来不舒服、高热、因不能吞咽而流涎,存在呼吸受损的症状,急性发作时吸气和呼气性喘鸣,选择一个可以保持气道通畅的体位至关重要,一般前倾或俯卧位。
小儿和家长应该即刻转移至手术室,由于存在诱发气道完全闭塞的风险,尽量将小儿的镇静保持在最低限度。应在一位资深耳鼻喉科医师的参与下诱导麻醉,且准备好环甲膜切开术或气管切开术的所有设备。
诱导采用氧气和七氟烷进行。由于气道堵塞,诱导可能会比较慢。一旦达到麻醉深度才能开放小儿外周静脉通道。必须准备各种型号的气管导管。
喉入口很难识别,气泡可能是开口定位的唯一线索,因此喉镜检查可能会非常困难。在这种情况下,使用探条和加强导管有益。神经肌肉阻滞药只能在气道安全的情况下给予。
手术后,孩子转移至重症监护室,并保持气管插管直到套囊周围出现可听到的漏气声( 抗生素治疗后通常 24-36 小时)。
小儿胃内容物误吸的风险比例为 10000 例中出现 1-9 例,误吸后严重发病率的风险非常低。
择期手术前的禁食可以最大限度地促进胃排空并减少误吸的危险。然而,这些应该保持在最低限度,以防患者不适,避免新生儿及婴儿出现低血糖和明显的脱水。目前禁食建议是清亮液体 2 小时,母乳 4 小时,配方奶或固体食物 6 小时。
对于急诊手术,饱胃的管理金标准是快速序贯诱导(RSI)。但需要仔细考虑新生儿或幼儿进行RSI 的实际和潜在的风险。
在一个清醒的脱水的儿童患者中可能很难找到可靠的静脉通路。
对于一个无法配合并且痛苦的小儿,很难实现适当的预充氧。对于一个哭泣小儿,事实上反而会增加氧耗,减少氧储备。
在给予神经肌肉阻滞药后的呼吸暂停期间,低功能残气量 FRC 和高氧耗可能导致氧气快速去饱和,尤其是新生儿或小儿。为了避免缺氧,常常会在插管前将新生儿的肺部充气或在合适的位置轻轻按压婴儿环状软骨以维持氧饱和度。
刚出生时环状软骨较高,处于C4 水平。缺乏经验的助手过度或不正确的应用环状软骨按压可能会导致气道扭曲和气管插管困难。
调查发现,50% -60% 有经验的小儿麻醉医师不会在小儿气管插管时使用环状软骨按压。
在美国,RSI 广泛使用,虽然报道误吸风险很低,但实际上高于法国,而在法国环状软骨按压使用频率更低。基于 RSI 的实际限制,对于患有严重腹胀或活动性上消化道出血的小儿保留 RSI,而其他患儿采用优化的技术似乎是合理的。
陈伟 曾莉 译 ;姜丽华 李民 校
图文节选自《气道管理的核心问题》
本微信公众号所刊载原创或转载内容不代表新青年麻醉论坛观点或立场。文中所涉及药物使用、疾病诊疗等内容仅供参考。
新青年麻醉论坛病例版2019年有奖原创病例征集活动进行中,欢迎各位同仁参与并投稿。
精品病例讨论微信群:邀请制,定期进行病例讨论和内部交流,凡在论坛发布或向版主提交原创病例者(请注明姓名,单位,微信,以word文件发送至版主邮箱)受邀加入。
病例管理团队:有充足的业余时间和一定的专业能力,愿意积极参与病例数据库和相关事业群建设,有志向与新青年一同成长进步的精英。
联系人:
卜版主 微信号:buyebo
蒋版主 微信号:jf1277636690
邮 箱:[email protected]














