众所周知,癌基因信号通过增强增殖同时减少细胞凋亡来导致肿瘤生长。但过去十年中,越来越多的证据表明癌基因和与免疫系统存在相互作用,
癌基因
RAS是最早也是研究最多的癌基因,以此为例了解癌基因的免疫调节功能。
RAS蛋白是小GTP酶,充当分子开关,导致各种信号通路的激活(MAPK、PI3K、RAL-GEF),促进各种关键的细胞过程,如细胞增殖,分化和响应细胞外刺激的存活。
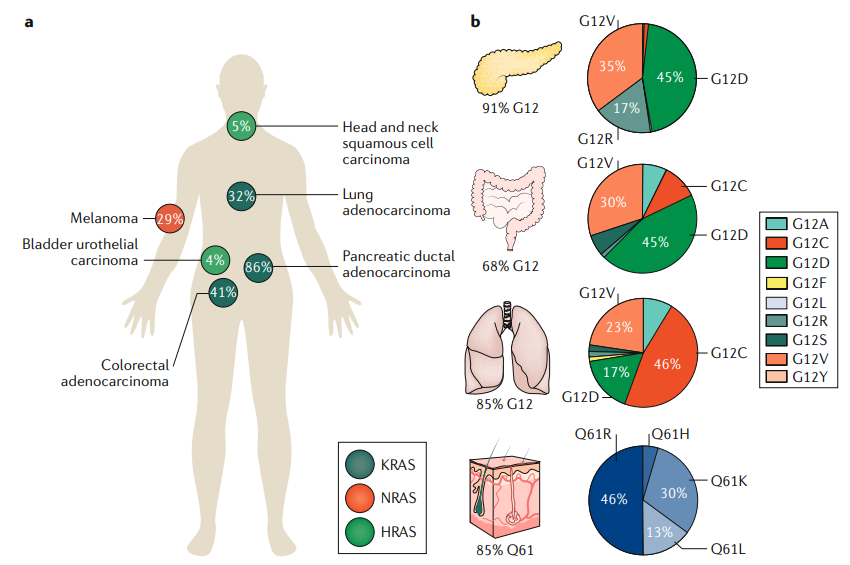
RAS家族成员由高度同源基因HRAS,NRAS,KRAS4A和KRAS4B基因编码,在~25%的人类癌症中发现了它们的激活突变,
大多数突变影响KRAS亚型
(~86%),KRAS突变主要见于胰腺导管腺癌(PDAC,~98%)、结直肠癌(CRC,~52%)和肺腺癌(LAC,~32%)。
Nat. Rev. Drug Discov 2014
致癌的KRAS突变介导自分泌效应,影响TME各类免疫细胞,促进炎症和逃避免疫反应,最终导致肿瘤进展,侵袭和进展。
炎症和癌症之间的关系可以追溯到18世纪,当时Rudolf Virchow在观察到肿瘤组织中存在白细胞后,首次假设癌症起源于慢性炎症部位.
-
由感染诱导的炎症信号和自身免疫性疾病触发的外在途径;
-
KRAS突变与促进肿瘤的炎症密切相关,被认为是致癌的主要因素。

Nat Commun 2020
致癌KRAS诱导几种炎性细胞因子、趋化因子和信号通路,促进这些癌症的肿瘤发生和侵袭性。
IL-6:肿瘤炎症、癌症转移核心分子
IL-8促进肿瘤发展
IL-1β:肿瘤治疗双向作用
IL-17与肿瘤免疫,敌人or朋友?
KRAS可以通过诱导对内皮细胞,成纤维细胞和ECM的影响来促进基质重塑,这也可以促进转移。
大多数实体瘤含有各种免疫细胞的浸润,包括髓系和淋巴谱系细胞,包括免疫抑制细胞:Tregs,MDSC,肿瘤相关巨噬细胞(TAM),中性粒细胞和肥大细胞等。
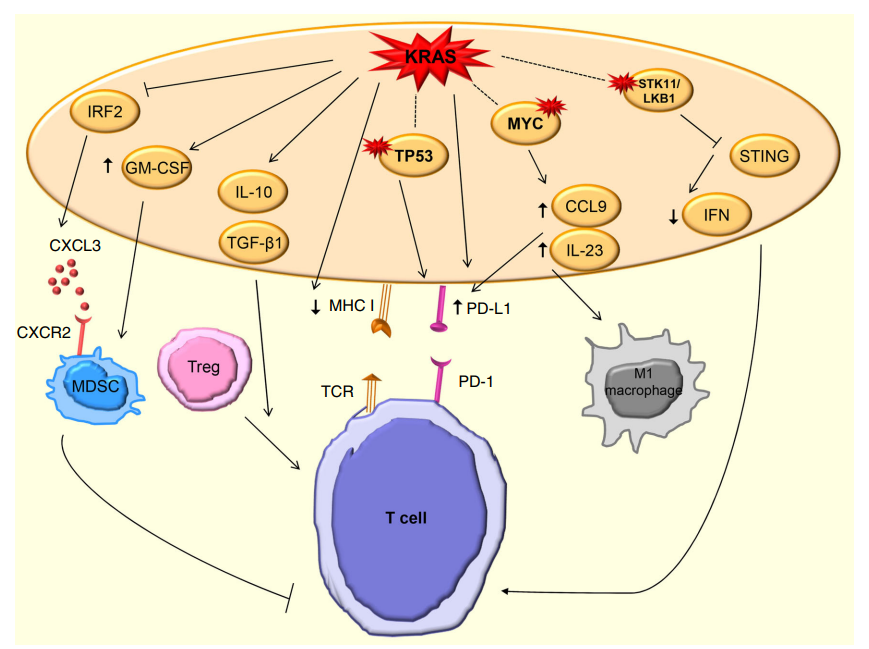
KRAS下游途径在塑造免疫微环境中起着至关重要的作用
,通过诱导NF-κB,激活了几种细胞因子和趋化因子的产生,包括TNF-α、IL1α/β、IL-6、CXCL1/2/5/8等,通过RAF/MAPK和PI3K也诱导IL-10,TGF-β和GM-CSF产生。
后PD-1时代,临床研究的一个主要目标是克服对针对PD-1和PD-L1的耐药性。比如医科院肿瘤医院Jie He(赫捷)院士曾发文报道:
KRAS-G12D mutation drives immune suppression and the primary resistance of anti-PD-1/PD-L1 immunotherapy in non-small cell lung cancer,Cancer Communications. 2022;42:828–847。
尽管经历30 多年的努力,RAS 通常被认为是不可成药的靶点。
针对RAS癌基因的单一疗法在初始反应后大多失败,因为通过不同的机制(如RAS下游途径的反馈再激活)发生耐药性。
临床试验,也有一些专门针对KRAS突变癌症的炎症和免疫调节的治疗探索。
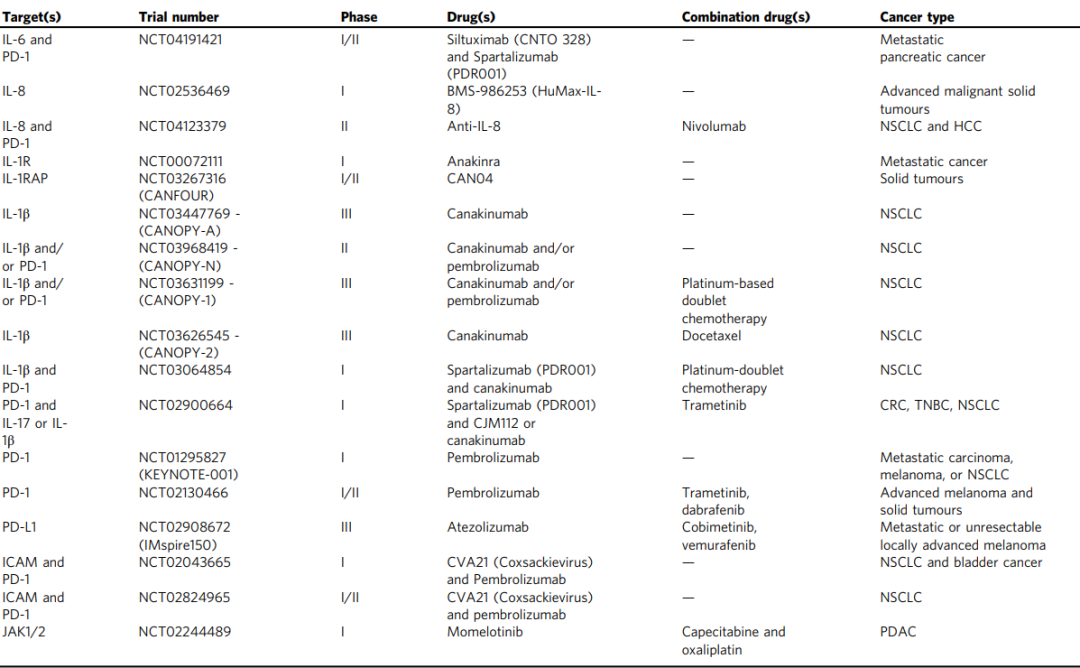
抗IL-6单克隆抗体siltuximab作为KRAS突变实体瘤的单一疗法进行了临床试验,但显示出有限的临床获益(NCT00841191)。















