2017 年6月6日晚,复星医药 (股票代码:600196.SH,02196.HK)宣布,其控股子公司复宏汉霖近日收到乌克兰卫生部关于复宏汉霖自主研制的新药——注射用重组抗HER2人源化单克隆抗体(以下简称“该新药”)用于转移性乳腺癌适应症的III期临床试验的批准。

复宏汉霖HLX02项目“重组抗HER2人源化单克隆抗体”是赫赛汀®的生物类似药。该新药已于中国境内(不包括港澳台地区)完成I期临床研究,I期临床研究结果证实,该新药安全、并与原研药赫赛汀®等效;目前该项目国内III期临床试验研究已全面开展。
2017年1月,复宏汉霖就该新药用于转移性乳腺癌适应症向乌克兰卫生部递交了临床试验申请。根据 IMS MIDASTM的资料显示,2016 年度,全球已上市 HER2 抑制剂于全球销售额约为80.9亿美元。截至2017年4月,复星医药现阶段针对该新药(包括转移性乳腺癌适应症及转移性胃癌适应症)已投入研发费用人民币约2.02亿元。
复星医药始终将创新研发作为企业发展的源动力,在全球范围内有效配置资源,通过自主研发、技术引进、对外许可、合作研究,持续完善“仿创结合”的研发体系。复星医药现已在上海、重庆、台北、美国旧金山等地建立了高效的国际化研发团队,通过不断加大对研发平台的投入,推动新产品上市。作为复星医药大分子生物类似药的研发重要平台,复宏汉霖将继续秉承“质量、速度、创新”的核心理念,以“开发优质抗体药物,造福全球病患”为使命,积极打造成为深得信赖,领先中国进而影响全球的生物制药企业。
按照本次临床实施方案规定,入选的患者将被随机分配接受注射用注射用重组抗HER2人源化单抗(HLX02)+多西他赛或者欧洲进口版曲妥珠单抗(赫赛汀)+多西他赛治疗。
如果您(或者您认识的某人) 符合下列条件,将有可能参加本研究:
1.
年龄 ≥18 的女性;
2. 经组织学和/或细胞学确诊的乳腺腺癌且HER2过表达
3. 患者既往未对复发或转移性疾病进行过全身性化疗、生物或靶向药物治
4. 既往新/辅助阶段(使用赫赛汀亦可)间隔12个月以上出现复发或者转移
(您的医生还会根据其他医学标准进行检查,以确定您是否适合参与本研究)
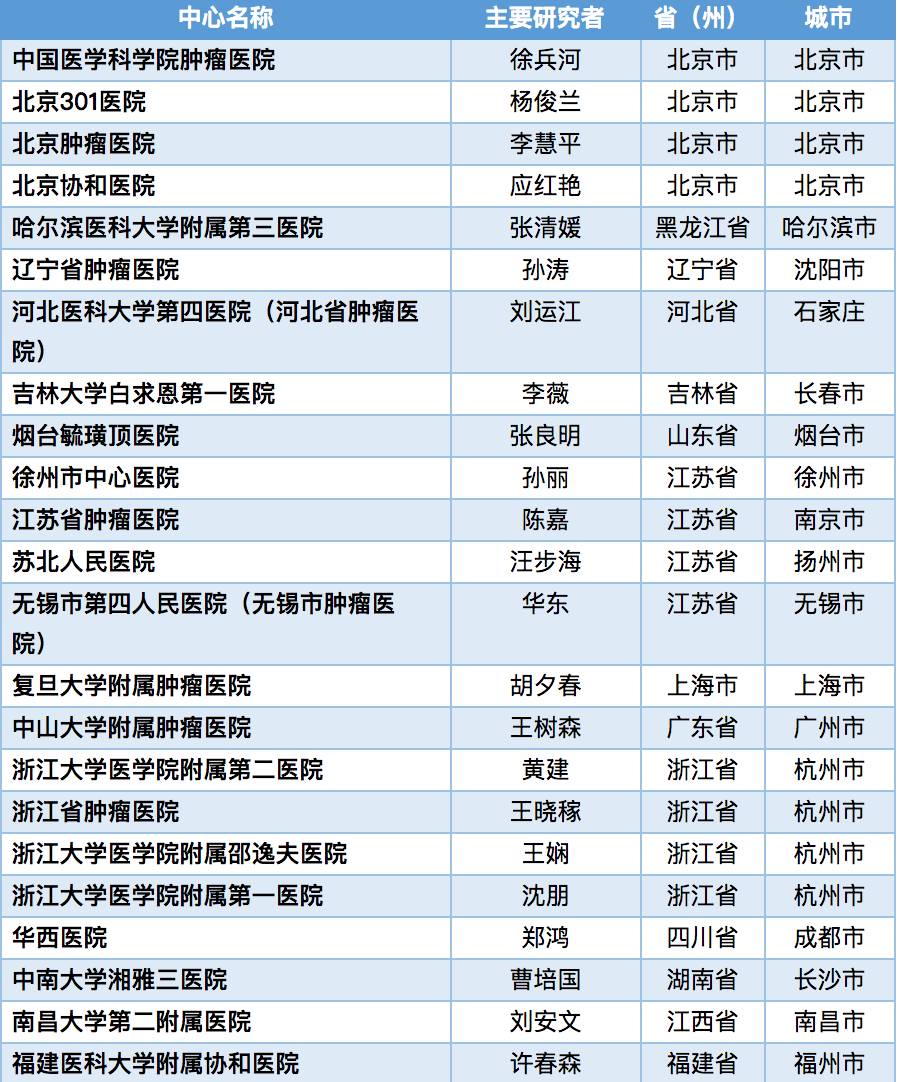
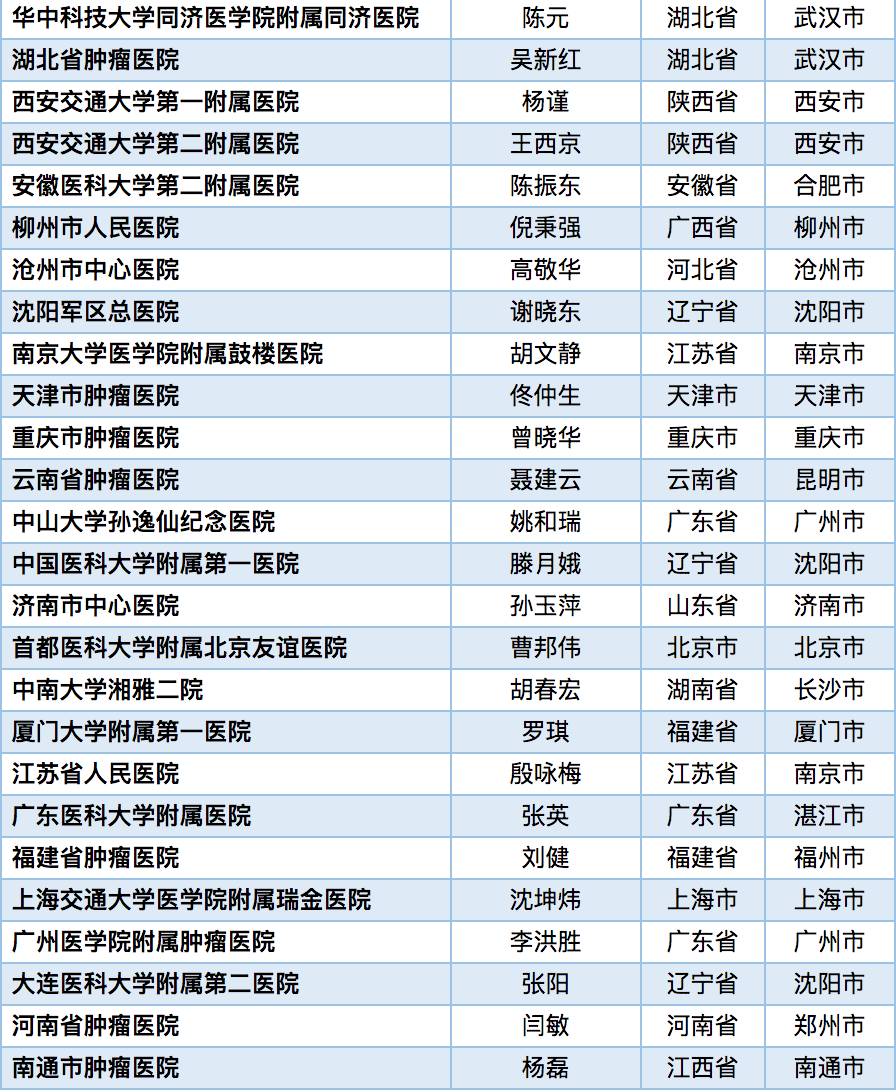
入选的患者将可获得研究相关的免费药物、免费检查、交通补助。考虑参加或者希望了解更多有关的临床研究信息,可与以上研究人员和机构(医院)的药物临床试验办公室取得联系。






