细胞治疗作为一种“活的
”
生物药物,
给
肿瘤治疗带来了新的曙光。以细胞来源分类,
此类
治疗方案包含体细胞治疗和干细胞治疗。
其中
干细胞治疗是指利用自体或异体骨髓或脐带造血干细胞移植治疗血液病和恶性肿瘤,
或
利用骨髓和脐带等来源的间充质干细胞经移植后转化为成骨细胞、
心肌细胞
等用于治疗。
根据
是否存在基因改造应用进行分类,
又可以
分类为非基因改造治疗和基因改造细胞治疗,
后者
还可以进一步分为体外基因改造细胞治疗和体内基因改造细胞治疗。
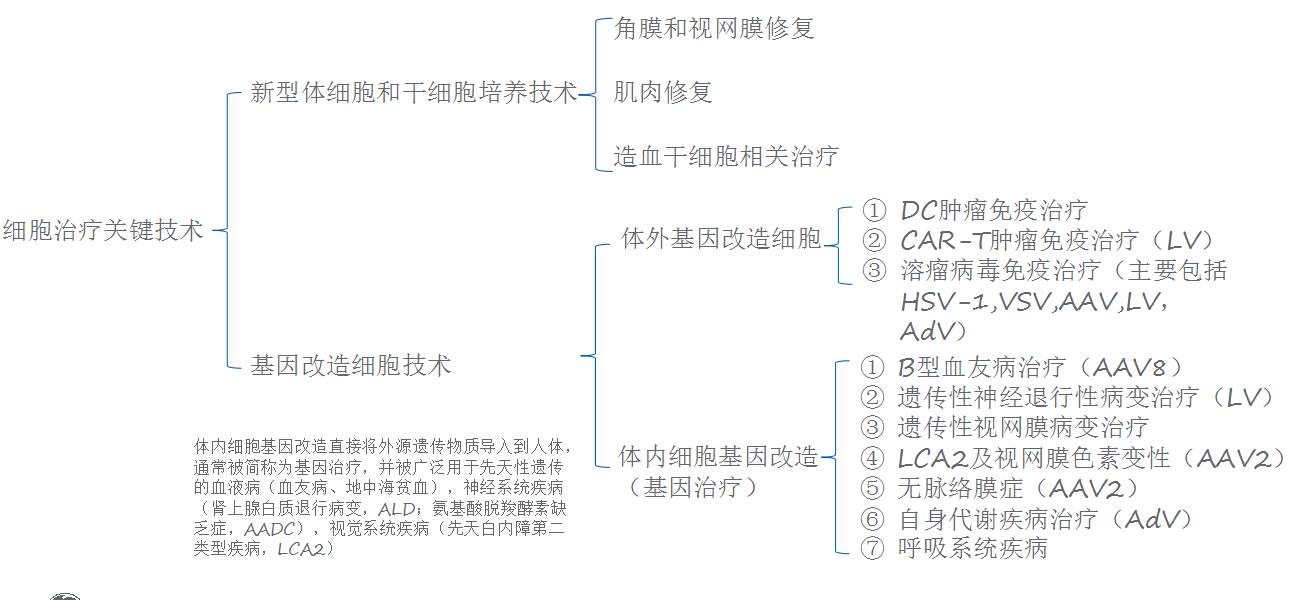
由于病毒载体技术的进步,不仅可以在逆转录病毒、慢病毒和腺病毒内装载大片段目的基因,还可以将其大量地转染到哺乳细胞。该技术可以用于体内和体外基因改造细胞。体外基因改造细胞是在人体外将提取的细胞导入外源遗传物质后,回输改造后的细胞到人体。其中,最具代表性的治疗包括嵌合抗原受体T细胞免疫疗法(chimeric antigen receptor T-cell immunotherapy,CAR-T)。实验结果表明,提高质粒的纯度和病毒载体(主要是慢病毒)的滴度有利于提高转染效率。体内细胞基因改造又称为基因治疗,它主要是通过病毒载体(主要是腺病毒,腺相关病毒,慢病毒)直接将外源遗传物质导入到人体。基因治疗是以携带目的基因的病毒作为最终的产品用于病人,因此这些病毒载体一般都需要通过纯化去除杂质,并且病毒的培养规模一般比较大。本文总结了在基因/细胞治疗中所涉及到的细胞培养技术和纯化技术。

由于大肠杆菌所需要的接种体积非常小,一般为1:1000.我们建议在加入适当的细菌培养液前一开始就把细胞培养袋中的培养体积加到最大。在LB培养基中当细胞生长18-24小时后,即可进行治理收获的操作。一般当处于指数生产期并且OD值即将或刚好到达最高时,质粒的质量及产率可以维持在最高。大肠杆菌的培养可使用XDR-50MO一次性生物反应器,优势在于大规模进行质粒生产,提高质粒得率,防止质粒污染。通过XDR-50MO一次性生物反应器对E.Coli进行培养,在营养充足的Fed-Batch培养中,大肠杆菌浓度可达到120OD。
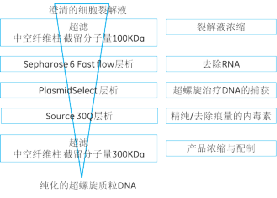
质粒DNA(pDNA),可以用于核酸疫苗或细胞治疗,以达到预防和治疗疾病的目的。DNA疫苗比病毒类疫苗安全,但是因为药物使用量大,因此对药物的质量要求很高。用于基因治疗,质粒DNA必须为超螺旋结构并且不含细菌染色体DNA,RNA,蛋白质和内毒素。用于超螺旋质粒DNA纯化的三步法层析工艺,具有操作简单、高纯度、易于放大的优势。
![]()
1977年,Frank Graham博士建立了使用贴壁依赖性呈上皮样人胚肾细胞293细胞(HEK293)在无辅助病毒的情况下产生重组腺病毒的实验方法。之后,HEK293细胞被发现转录组中存在SV40增强子,而SV40增强子能够帮助细胞有着转染效率高的特点。因此,此后大部分实验都会通过HEK293细胞进行质粒的转染,用于生产慢病毒、腺病毒、逆转录病毒。与腺病毒不同的是,慢病毒、逆转录病毒可以将自身携带的外源基因片段插入宿主的基因进行改造,从而在细胞治疗领域获得了广泛应用。目前通过HEK293细胞获得慢病毒、逆转录病毒,并通过病毒改造宿主细胞,再将改造后的T细胞回输回体内,已经成为细胞治疗领域主流的研究方法。
HEK293细胞根据培养方式的不同可分为:贴壁培养和悬浮培养。不同的培养方式各有优缺点,为了得到最好的培养效果,需要选择合适的生物反应器。
HEK293细胞的悬浮培养必须先对细胞进行“驯化”培养,同时配合高密度无血清培养的培养基配方才能实现。而在目前HEK293的悬浮培养中,由于缺少血清和蛋白的保护作用,使得HEK293对剪切力的敏感度增加,从而难以达到高密度的培养且导致悬浮培养的HEK293产生的病毒数量比贴壁培养低5-10倍左右。因此,当细胞株进行悬浮培养放大的时候,更适合使用低剪切力的生物反应器(WAVE25)。通过对感染条件、收获时间等进行优化,使用WAVE20/50反应器(GE Healthcare)悬浮培养293细胞,并应用于不同类型病毒的生产,可获得更高的病毒产量。
10L细胞培养袋-5L培养体积-连续灌注培养-HEK293细胞密度最大达到1×10
7
cell/ml,最终得到10
14
VP(virus particle),IU:VP<100,单个HEK293的病毒产量为5000IU/cell。
HEK293贴壁培养的优势在于:转染效率高、病毒滴度高,因而会有更多的应用。微载体工艺目前已经成功应用于几ml-6000L规模的细胞培养中,技术相当成熟。
由于Cytodex1球型的表面结构更利于质粒及病毒的转染,同时HEK293细胞在Cytodex1上能够进行很好的贴壁,因此多使用Cytodex1(4.3E6微载体/g)进行HEK293的贴壁培养。在HEK293的放大培养时,可按照常规培养的比表面积接种比例进行计算(一般为1:3-1:4接种)。还需要优化微载体上的HEK293细胞株的消化时间,以大部分细胞刚离开微载体为佳。由于转染过程中需要HEK293细胞以非聚团状贴附于微载体才可以获得高转染效率,及较高滴度的病毒,在消化成功的情况下,一般我们可以通过调整生物反应器的转速来控制HEK293在微载体上的贴壁情况。在HEK293细胞贴壁培养的工艺中,由于该细胞贴壁性不好,容易脱落;同时,微载体自身比重较大,容易沉降,使用WAVE25需要更大的转速和角度才可以实现较好的混合。因此,为了实现HEK293贴壁细胞在微载体培养的工艺放大,可以通过Xcellerex生物反应器进行。
随着病毒载体在临床中的应用,一种高效的、高质量的生产工艺也包括下游纯化。实验室中用于病毒纯化的方法基本为氯仿抽提、氯化铯密度梯度离心的方式进行纯化,尽管该纯化方式非常有效、可重复性好,但是比较耗时、难以放大生产,并且氯化铯和氯仿为有毒试剂,在制药生产中使用有潜在的危害。所以,基于层析技术的纯化方案成为了人们的研究热点。病毒的层析纯化主要涉及到的层析技术包括亲和层析(Heparin亲和层析、AVB Sepharose HP等)、离子交换(capto Q,capto Q/SP ImpRes,Q sepharose XL,Q HP,SP sepharose HP等)、分子筛(如4FF,6FF)和多模式层析交换层析(如capto core 700)。
腺病毒(adenovirus,AdV)是一个20面体的无包膜双链DNA病毒,直径70-90nm,有252个壳粒,含有14种蛋白,蛋白质占87%,DNA占13%,氯化铯中的浮力密度1.34g/cm14。腺病毒载体近十年已从第一代发展到了第三代,最大限度得去除病毒的基因,为包装病毒微载体系统或“gutless vector“,病毒所需要的复制和包装的蛋白是以细胞表达。它用于基因治疗是基于它的几种优良特征:在培养液中很容易生产;能感染各种细胞类型;腺病毒基因整合进宿主细胞染色体的危险小;容易对其进行基因水平的操作和制备突变体或删除病毒;病毒颗粒非常稳定,不易被破坏。
用于细胞治疗的腺病毒在纯度、活性以及病毒制品中热源、支原体、杂蛋白、牛血清、Benzonase的残留都有严格的指标。这就要求在设计生产工艺时,选用特异性、高效的分离纯化方法。层析纯化已经成为腺病毒规模生产的首选方法。与离心法相比,腺病毒载体的层析纯化更容易以低成本安全、直接地放大到工业生产规模。除了作为基因治疗用载体使用外,腺病毒疫苗也在逐步发展。2016年,有文章报道使用Q HP+capto core 700纯化HEK293细胞培养用于预防TB的腺病毒疫苗。通过层析纯化,杂蛋白去除98%,病毒颗粒的回收率超过60%,并且该工艺可以顺利的由3L放大至60L的规模进行大规模生产。
![]()
腺相关病毒(adeno-associated virus,AAV)
腺病毒相关病毒(adeno-associated virus,AAV)属于细小病毒科,无包膜的20面体结构的病毒。病毒颗粒大约20-26nm,含有4.7-6kb线状单链DNA,cap基因编码3种衣壳蛋白,即VP1,VP2,VP3。腺相关病毒具有安全、宿主广、可特异性整合、可长期表达外源基因等优势。
Nicole Brument等2002年成功使用2步离子交换(SP sepharose HP;Source 15Q)纯化AAV病毒,纯度达98.5%,是目前最稳定,易于放大、经济的AVV纯化方法。除此之外,其他的层析技术也可应用于AAV的纯化。如多模式层析填料Capto Core 700、AVB、Heparin亲和层析等。
![]()
慢病毒载体是来源于人类免疫缺陷病毒-1 (HIV-1)的一种病毒载体,对分裂细胞和非分裂细胞均具有感染能力。目前重组慢病毒被广泛地应用于表达RNAi的研究中。重组慢病毒载体的包装难度较大,因此其滴度较难提高。下游工艺的目的主要是病毒载体的浓缩和杂质的去除。
![]()

版权为生物制品圈所有。欢迎个人转发分享。其他任何媒体、网站如需转载或引用本网版权所有内容须获得授权且在醒目位置处注明“转自:
生物制品圈
”。